人工养殖半滑舌鳎卵巢发育及其产卵类型研究
陈彩芳, 温海深, 陈晓燕, 张葭人, 金国雄, 史 宝, 史 丹, 杨艳平, 何 峰,
李吉方
(中国海洋大学 水产学院, 山东 青岛 266003)
人工养殖半滑舌鳎卵巢发育及其产卵类型研究
陈彩芳, 温海深, 陈晓燕, 张葭人, 金国雄, 史 宝, 史 丹, 杨艳平, 何 峰,
李吉方
(中国海洋大学 水产学院, 山东 青岛 266003)
研究了人工养殖半滑舌鳎(Cynoglossus semilaevis)卵巢发育组织学的季节变化及其与性成熟系数(gonadosomatic index, 简称GSI)和肝质量指数(hepatosomatic index, 简称HSI)的关系。结果表明, 半滑舌鳎成熟鱼卵巢发育经历Ⅱ期、Ⅲ期、Ⅳ期、Ⅴ期、Ⅵ期, 再到重复发育Ⅱ期; 人工养殖条件下, 3~5月份大部分鱼卵巢处于Ⅱ期, 从6月份开始, 其卵母细胞内开始沉积卵黄颗粒, 9~11月份, 卵母细胞内卵黄颗粒充盈整个胞质, 基本达到生长成熟, 排卵后至翌年 2月份, 卵巢进入了退化吸收Ⅵ期或重复发育Ⅱ期; 繁殖期GSI达到最高峰; 产卵后或重复发育Ⅱ期, GSI显著下降, 此时HSI显著升高至全年最高峰; 半滑舌鳎在1 a中只有1个繁殖期, 进行分批产卵。
半滑舌鳎(Cynoglossus semilaevis); 卵巢; 产卵类型
半滑舌鳎(Cynoglossus semilaevis)属于鲽形目(Pleuronectiformes), 舌鳎科(Cynoglossidae), 舌鳎属(Cynoglossus), 为近海暖温性底层鱼类, 常年栖息在中国沿海, 不做远距离洄游, 是比目鱼中最珍贵的品种。半滑舌鳎雌性个体生长速度比雄性快2~3倍,性成熟雄鱼个体体质量只有雌鱼的 1/3, 其精巢质量只有成熟卵巢的 1/200~1/900, 这种现象在鱼类中十分罕见; 雄鱼生殖力弱, 造成自然状况下卵子受精率不足10%[1]。目前, 有关半滑舌鳎人工繁殖与养殖技术研究报道较多[2~4]; 对半滑舌鳎性腺分化、分子标记、功能基因研究起步较晚, 但受到研究者高度重视[5~10]; 关于半滑舌鳎性腺发育研究报道较少[11,12],对卵巢发育组织学研究更为鲜见[13]。本研究以人工养殖半滑舌鳎为对象, 系统研究不同发育期卵巢组织变化, 并结合GSI和HSI进行分析, 以期丰富半滑舌鳎繁殖生理学内容, 同时为优化人工繁殖技术提供科学依据。
1 材料与方法
1.1 材料
2007年3月~2008年2月, 在烟台莱州一养殖场每3个月(3月~5月、6月~8月、9月~11月、12月~翌年2月)采集1次, 共采集雌性半滑舌鳎40尾, 平均体长为(464.5±3.15) mm, 平均体质量为(731.28±192.72)g。实验前测量所有鱼生物学指标(表1), 采集尾静脉血液, 分离血浆用于生理学指标测定; 解剖后取性腺和肝质量, 计算 GSI=[性腺质量/(体质量-内脏质量)]×100, HSI=[肝脏质量/(体质量-内脏质量)]×100。
1.2 方法(H.E染色)
在卵巢的前、中、后 3部分取小块组织, 以Bouin’s 液固定 24~36 h, 系列酒精脱水, 二甲苯透明, 石蜡包埋, LEICA-RM2016切片机连续横切, 厚度5 µm, H.E染色, 中性树胶封片。Nickon E200型光学显微镜观察及显微摄影。
1.3 数据分析
实验所得数据均表示为平均值±标准差(Mean±SD), 采用 SPSS 13.0统计软件中的 Duncan’s法多重比较进行数据处理和检验分析, 当 P < 0.05时认为差异显著。
2 结果
2.1 GSI和HSI的季节变化
随着卵巢发育周年变化的进行, GSI也相应地发生变化。根据对全年数据的统计, 雌性半滑舌鳎在繁殖季节(9~11月份)出现全年最高峰, GSI均值高达6.16(n=8); 12月~翌年2月份为越冬期, GSI显著下降(P<0.05), 均值为 3.25(n=8); 之后 GSI继续下降,3~5月份降至全年最低点, 均值为1.54(n=16); 6~8月份, GSI呈升高趋势, 但是无显著性变化, 均值为1.72(n=8), 结果见图1。

表1 雌性半滑舌鳎生物学指标Tab. 1 The biology index of female Cynoglossus semilaevis
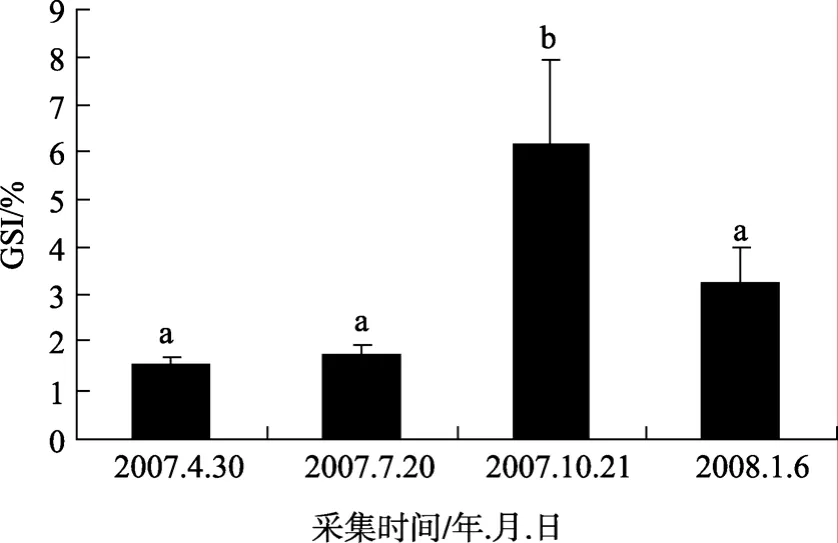
图1 雌性半滑舌鳎GSI季节变化Fig. 1 GSI in female Cynoglossus semilaevis数据均表示为平均数±标准差, 图中标有不同的字母(a,b)表示存在显著性差异(P<0.05, Duncan氏多重比较)Values are expressed as mean±standard error of mean. Different letters (a, b) indicate significant difference(P<0.05, one-way ANOVA, followed by Duncan’s)
伴随着卵巢发育的不断进行, 不仅 GSI会相应地发生变化, HSI也会发生变化, 这与鱼类的性腺发育和生长有关。根据对肝质量指数数据的统计, 雌性半滑舌鳎在繁殖季节(9~11月份)出现 1个高峰,HSI均值达0.87(n=8); 12月~翌年2月份为越冬期,HSI呈升高趋势, 且差异显著, 均值为1.02(n=8)(P<0.05); 之后 HSI显著下降, 到 3~5月份, 均值为0.85(n=16)(P<0.05); 到 6~8月份, HSI继续下降,均值为0.67(n=8)(P<0.05), 结果见图2。
2.2 卵巢形态
半滑舌鳎卵巢一对, 位于背腹两侧的卵巢腔内,侧面观察呈现漏斗状。Ⅱ期卵巢呈半透明状, 肉红色,表面可见有细小血管分布(图 3-1), 但用肉眼尚看不清卵粒。Ⅲ期卵巢体积增大, 外观上呈现土黄色, 透过卵巢壁, 肉眼可见丰富的毛细血管(图 3-2)。Ⅳ期卵巢体积进一步增大, 呈淡黄色, 透过薄层卵巢壁可看到浅黄色卵粒, 卵粒不分离, 纵走血管和分枝的扩展达到高峰(图 3-3)。Ⅴ期卵巢体积增大为全年最高, 从体外肉眼已能明显看到假体腔膨大突出,呈松软状, 卵粒游离(图 3-4), 提起亲鱼或轻压腹部即有成熟卵排出。Ⅵ期卵巢体积显著缩小, 呈黄色,透过卵巢壁可见黄色不规则物质(图 3-5)。重复发育二期卵巢较Ⅵ期卵巢更为萎缩, 卵巢变得干瘪, 呈暗淡的黄色(图3-6)。

图2 雌性半滑舌鳎HSI季节变化Fig. 2 HSI in female Cynoglossus semilaevis数据均表示为平均数±标准差, 图中标有不同的字母(a,b,c)表示存在显著性差异(P<0.05, Duncan氏多重比较)Values are expressed as mean±standard error of mean. Different letters (a,b,c) indicate significant difference(P<0.05, one-way ANOVA, followed by Duncan’s)
2.3 卵巢发育组织学分期
根据国内外鱼类发育分期方法[18], 结合鲆鲽鱼类性腺发育特点, 采用本研究室关于牙鲆卵巢分期方法[14], 将半滑舌鳎卵巢发育分为Ⅱ期~Ⅵ期。
2.3.1 Ⅱ期卵巢
2007年3月~5月所采雌鱼性腺发育基本处于Ⅱ期, 从组织学切片上可以看见, 这个时期的卵巢主要以2时相卵母细胞为主体(图4-1)。此时2时相卵母细胞核大圆形, 核仁沿核膜内缘分布, 其胞质呈强嗜碱性反应, 胞径 49.3~147.9 µm, 核径 29.58~78.88 µm, 核胞径比介于 0.5~0.8(图 4-2)。

图3 半滑舌鳎卵巢形态Fig. 3 Morphology of Cynoglossus semilaevis ovaries3-1.Ⅱ期卵巢外观;3-2.III期卵巢外观;3-3.IV期卵巢外观;3-4.Ⅴ期卵巢外观;3-5.Ⅵ期卵巢外观;3-6.重复Ⅱ期期卵巢外观3-1. morphological structure of ovary in the stageⅡ; 3-2. morphological structure of ovary in the stage Ⅲ; 3-3. morphological structure of ovary in the stage Ⅳ; 3-4. morphological structure of ovary in the stageⅤ; 3-5. morphological structure of ovary in the stageⅥ; 3-6. morphological structure of the convalescence of ovary in the stageⅡ
2.3.2 Ⅲ期卵巢
2007年6~8月所采雌鱼性腺发育基本处于Ⅲ期,这个时期卵巢以 3时相卵母细胞为主, 胞径197.2~246.5 µm, 核径 108.46~128.18 µm, 核胞径比0.55~0.6(图 4-3), 在近卵母细胞膜的细胞质内出现1-2 层液泡, 随后逐渐向核中央扩大, 同时在较大的卵母细胞卵膜边缘出现卵黄沉积。开始时, 层次少而颗粒细, 后来逐渐长大, 由卵膜边缘向核周分布(图4-4)。此外, 卵巢也含有少量 2时相的卵母细胞(图4-3,4)。
2.3.3 Ⅳ期卵巢
2007年9~11月所采雌鱼中有性腺发育处于Ⅳ期,此时以 4时相卵母细胞为主, 胞质中沉积大量卵黄颗粒, 卵黄颗粒分为大小两种颗粒, 被HE染成紫红色(图 4-5)。卵核偏位和卵黄颗粒充满卵黄囊是卵母细胞生长成熟的标志, 此卵母细胞胞径246.5~305.66 µm, 核径 49.3~69.02 µm, 核胞径比0.19~0.23(图 4-6)。此时滤泡细胞层、放射膜更加明显(图4-7),其他还有2时相的卵母细胞和3时相卵母细胞(图 4-6)。
2.3.4 Ⅴ期卵巢
与Ⅳ期卵巢相似, Ⅴ期卵巢的采样时间也处于2007年9~11月。这个时期卵巢以5时相卵母细胞占主导地位, 胞径 315.52~394.4 µm, 细胞质中充满粗大的卵黄颗粒, 在成熟过程中有相互融合现象, 且核崩解消失(图 4-8, 4-9)。此时, 还有 2时相卵母细胞、3时相卵母细胞和4时相卵母细胞(图4-8)。
2.3.5 Ⅵ期卵巢
2007年12月~翌年2月份所采雌鱼有退化期的卵巢, 即Ⅵ期卵巢, 卵巢组织中有排空的滤泡细胞, 成为产后黄体(图4-10); 未排出的过熟卵粒放射膜增厚, 卵黄颗粒融合成块状(图4-11)逐渐被分解和吸收。
2.3.6 重复发育Ⅱ期卵巢
同Ⅵ期卵巢采样时间相同, 这个时间段所采雌鱼性腺发育也有进入重复发育二期。由Ⅴ期卵巢产卵后或者经由Ⅵ期卵巢自由退化的鱼, 卵巢呈萎瘪的囊状, 表面血管充血, 以后转变为Ⅱ期卵巢(图 4-6,图4-12)。此时卵巢还是以2时相卵母细胞为主, 还有未吸收完全的滤泡细胞空泡和液化成块状的卵黄颗粒(图 4-12)。
2.4 繁殖期与产卵类型
半滑舌鳎的卵巢周年发育变化表明: 从 3月份开始到5月份, 卵巢基本处于发育Ⅱ期, 进入卵母细胞生长期的小生长阶段。经过 3个月的培育进入 6月份到8月份, 卵母细胞体积增大, 胞质内卵黄颗粒开始出现并沉积, 且由于滤泡细胞分泌活动的加剧,在卵细胞膜和滤泡细胞之间出现了一薄层非细胞结构的放射膜, 此时卵巢进入了III期。至9月份到11月份繁殖季节, 卵巢基本处于Ⅳ期和Ⅴ期, 卵母细胞内卵黄颗粒大量沉积并充盈整个胞质, 且胞核开始偏位或完全崩解消失, 此时两层滤泡细胞、放射膜更加明显。繁殖季节过后进入了越冬期, 此时的卵巢处于退化吸收Ⅵ期或重复发育Ⅱ期。排卵后卵巢内可见大量的产后黄体, 卵黄颗粒融合成块状,放射膜显著增厚, 此时Ⅱ时相卵母细胞占主导。同时, 由图1可以看出, GSI在1 a中只出现一个峰值,说明半滑舌鳎雌鱼为每年有 1个繁殖期; 且组织切片的观察结果也显示, 在同一个视野中同时存在 3时相和 4时相卵母细胞, 说明半滑舌鳎雌鱼为分批产卵类型。
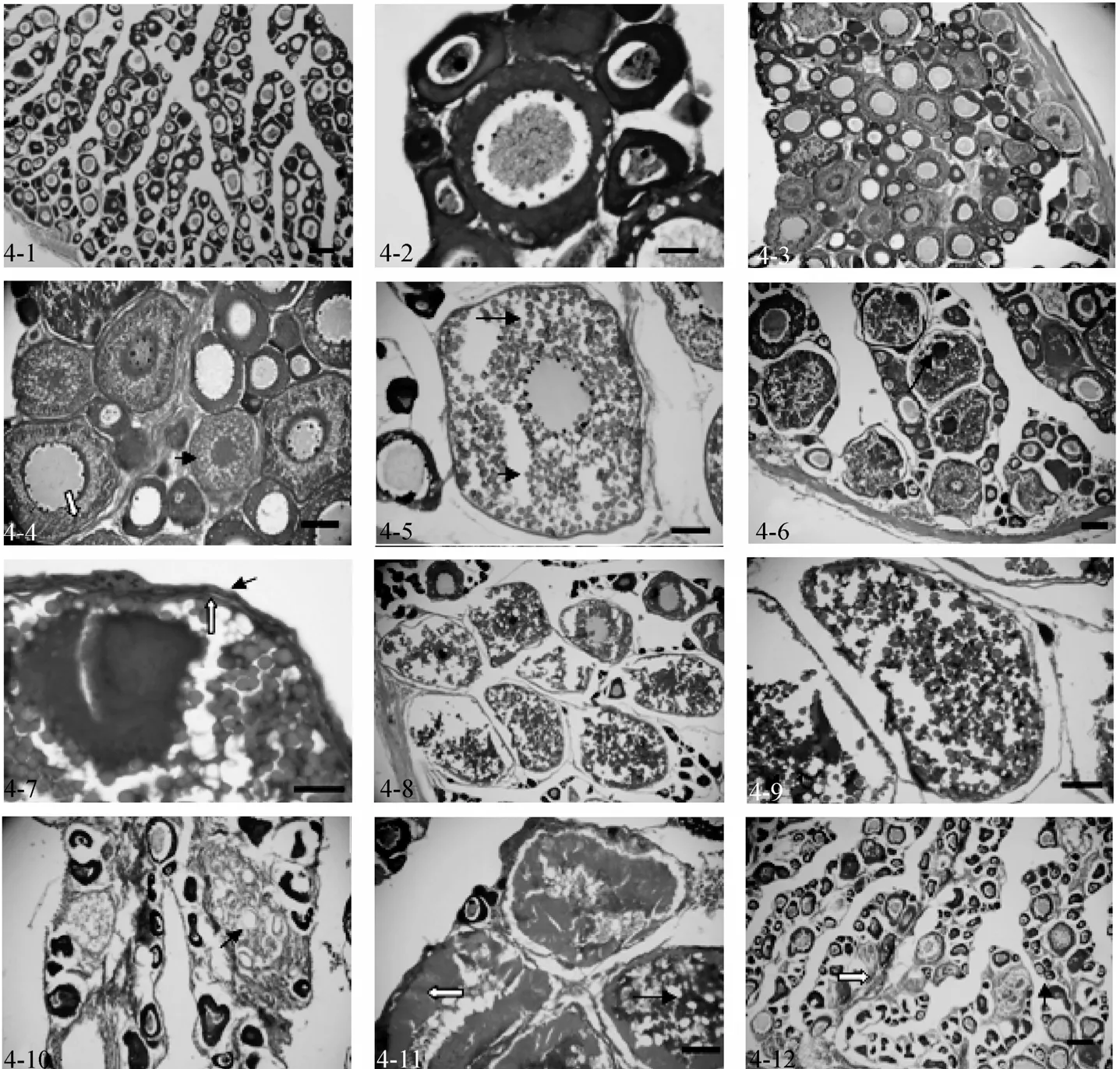
图4 半滑舌鳎卵巢组织学分期Fig. 4 Ovarian developmental phase of Cynoglossus semilaevis4-1.Ⅱ期卵巢, 比例尺为100 µm; 4-2.Ⅱ时相卵母细胞, 比例尺为70 µm; 4-3. Ⅲ期卵巢, 比例尺为100 µm; 4-4. III时相卵母细胞, 比例尺为70 µm, 白箭头为卵周的卵黄颗粒, 黑箭头为液泡; 4-5. Ⅳ时相早期卵母细胞, 比例尺为70 µm, 长箭头为大卵黄颗粒, 小箭头为小卵黄颗粒; 4-6. Ⅳ期卵巢, 比例尺为100 µm, 箭头为核偏位; 4-7. Ⅳ时相晚期卵母细胞, 比例尺为24 µm, 黑箭头为双层滤泡细胞, 白箭头为增厚的放射膜; 4-8. Ⅴ期卵巢, 比例尺为100 µm; 4-9. Ⅴ时相卵母细胞, 比例尺为70 µm; 4-10. Ⅵ期卵巢, 比例尺为100 µm, 箭头为排空的滤泡细胞层; 4-11. 正在退化吸收的Ⅵ时相卵母细胞, 比例尺为 70 µm, 白箭头为显著增厚的放射膜, 黑箭头为崩解的卵黄颗粒; 4-12.重复发育二期卵巢, 比例尺为100 µm4-1.the ovary in the stageⅡ, bar=100 µm;4-2.the phase 2 oocyte, bar=70 µm; 4-3.the ovary in the stageⅢ, bar=100 µm; 4-4.the phase 3 oocyte,bar=70 µm, the white arrow shows vitellin granule, the black arrow shows vacuole; 4-5. the phase 4 oocyte, bar=70 µm, the long arrow shows big vitellin granule ,the short arrow shows small vitellin granule; 4-6.the ovary in the stageⅣ, bar=100µm,the arrow shows nuclear deflexion;4-7.the phase 4 oocyte, bar=24 µm, the black arrow shows two layer of follicular cells, the white arrow shows incrassated zona radiate; 4-8. the ovary in the stageⅤ, bar=100 µm; 4-9. the phase 5 oocyte, bar=70 µm; 4-10.the ovary in the stageⅥ, bar=100 µm, the arrow shows follicular cells after spawning; 4-11. assimilative phase-6 oocyte, bar=70 µm, the white arrow shows largely incrassated zona radiate, the black arrow shows collapsed vitellin granules; 4-12.the convalescence of ovary in the stageⅡ, bar=100 µm
3 讨论
鱼类的繁殖周期性活动中, 对于产卵类型通常有两种划分方法: 一种是根据卵巢组织学特征和产卵习性把硬骨鱼类的产卵类型划分为一次性产卵鱼类和多次性产卵鱼类; 另一种是根据卵母细胞的发育情况, 把鱼类的卵巢分为3种类型: 完全同步型、分次同步型(或称分批同步型)和分批非同步型[15]。由本研究结果可知, 半滑舌鳎各时期的卵巢中卵母细胞发育不同步, 在同一发育期的卵巢中存在不同发育时期的卵母细胞, 属于卵母细胞发育不同步、分批产卵类型。进入繁殖期9 ~11月, 卵巢基本处于Ⅳ期或者Ⅴ期。在Ⅳ期卵巢中, 除了Ⅳ时相卵母细胞占主导地位外, 还有2、3时相卵母细胞; 在Ⅴ期卵巢中,除了占据多数的5时相卵母细胞, 还有4、3、2时相卵母细胞。由此可见, 半滑舌鳎的产卵类型与丁鱼岁(Tinca tinc)[16]、黄鲷 (Dentex tumifron)[17]等鱼类的产卵类型相似, 能进行多次产卵。
在发育成熟的半滑舌鳎卵巢中, 发现了大小两种卵黄颗粒。关于鱼类卵黄发生的机制可以分为两种来源: 内源性卵黄发生和外源性卵黄发生[18]。方展强等[19]曾提出鲇鱼(Silurus asotus)为外源性卵黄发生机制, 指出卵黄蛋白原首先在肝脏内合成, 然后通过血液循环进入颗粒细胞, 再经过微绒毛运送到卵母细胞内, 最后被线粒体包装形成卵黄颗粒。在半滑舌鳎的Ⅲ期卵巢中, 卵黄颗粒首先出现在初级卵母细胞的细胞膜附近, 然后慢慢向胞核方向扩散,最终充盈整个细胞质。因此推断, 半滑舌鳎的卵黄发生机制是外源性卵黄发生机制。这个现象在鳜鱼(Siniperca chuatsi)[20]、白鲢(Hypophthal michthys molitrix)和鳙鱼(Aristichthys nobilis)[21]内也有发现。但关于半滑舌鳎卵巢内是否存在内源性的卵黄形成,还有待于进一步研究。
近几年来, 国内外对鱼类卵巢发育周年变化的研究报道较多, 如旗鱼(Xiphias gladius)[22]、黄鲷[17]、丁[16]、牙鲆(Paralichthys olivaceus)[14]等。但是关于半滑舌鳎卵巢发育的周年变化还未见报道。半滑舌鳎人工养殖的繁殖期是 9~11月份, 此时卵巢发育基本处于Ⅳ期或Ⅴ期, 且 GSI达到了一年中的最高峰, 两者是相互吻合的, 这与柳学周等[2]的观点是一致的。繁殖期过后, 产卵后或没能及时催产排卵的舌鳎卵巢进入Ⅵ期退化吸收阶段或重复发育Ⅱ期。进入 12月份后, 卵巢处于休整期, 并以Ⅱ期卵巢过冬, 此时GSI显著下降, HSI显著升高至全年最高峰。这与以前的普遍观点相一致, 即性腺指数越大, 肝质量指数越小, 反之亦然。本研究的结果也表明了这一点, 这与繁殖期过后鱼类体内能量合成主要不是用于性腺发育而是转为能量储存相关。从翌年 3月份开始, 人工投喂各种营养饲料, 使得卵巢发育慢慢复苏, 进入了卵母细胞生长期的小生长阶段, 此时GSI较越冬期下降, HSI则呈显著下降趋势, 这与经过一个越冬期能量的大量损耗而摄入量少有关。到6月份后, 开始进行人工养殖的营养强化阶段, 进一步促进性腺的发育。此时卵巢内卵母细胞开始大量沉积卵黄颗粒, 为后面的繁殖期储备营养物质。经过这些营养强化, GSI呈现升高趋势, 而HSI则显著下降至全年最低点。这与前文所述相吻合, 即鱼类体内能量合成现主要转向性腺发育。这些都说明半滑舌鳎性腺发育、性腺成熟系数、肝质量指数之间有着密切的关系, 且呈现了明显的季节性规律变化。
本研究在国内外首次对半滑舌鳎卵巢发育周期进行了较系统研究, 为进一步阐明半滑舌鳎繁殖生理奠定基础, 同时也为优化半滑舌鳎人工繁殖技术和单性育种提供科学依据。
[1] 姜言伟, 万瑞景. 渤海半滑舌鳎的生殖习性及产卵生态的研究[J]. 海洋水产研究, 1988, 9: 185-192.
[2] 柳学周, 庄志猛, 马爱军, 等. 半滑舌鳎繁殖生物学及繁育技术研究[J]. 海洋水产研究, 2005, 26(5):7-14.
[3] 柳学周, 孙中之, 马爱军, 等. 半滑舌鳎亲鱼培育及采卵技术研究[J]. 海洋水产研究. 2006, 27(2): 25-32.[4] 孙中之, 柳学周, 徐永江, 等. 半滑舌鳎工厂化人工育苗工艺技术研究[J]. 中国水产科学, 2007, 14(2):244-248.
[5] 马学坤, 柳学周, 温海深, 等. 半滑舌鳎性腺分化的组织学观察[J]. 海洋水产研究, 2006, 27(2): 55-60.
[6] 邓思平, 陈松林, 刘本伟. 半滑舌鳎 FTZ-F1 cDNA克隆及表达分析[J]. 动物学研究, 2008, 29(6):592-598.
[7] Chen S L, Deng S P, Ma H Y, et al. Molecular marker-assisted sex control in half-smooth tongue sole(Cynoglossus semilaevis) [J]. Aquaculture,2008, 283:7-12.
[8] Deng S P, Chen S L, Xu J Y, et al. Molecular cloning,characterization and expression analysis of gonadal P450 aromatase in the half-smooth tongue-sole, Cynoglossus semilaevis[J]. Aquaculture, 2009, 287:211-218.
[9] 温海深, 张葭人, 何峰, 等. 半滑舌鳎雄激素受体(AR)基因的克隆与表达分析[J]. 中国海洋大学学报(自然科学版), 2009, 39(3): 387-391.
[10] Yan Y, Zhong Q W, Li C M, et al. Isolation and characterization of Toll-like receptor 9 in half-smooth tongue sole Cynoglossus semilaevis[J]. Fish & Shellfish Immunology, 2009, 26: 492-499.
[11] 康现江, 梁春光, 郭明申, 等. 半滑舌鳎精子发生和精子形成的超微结构[J]. 动物学报, 2008, 54(2):356-365.
[12] 宋海霞, 翁幼竹, 刘志刚, 等. 半滑舌鳎精子发生的组织学研究[J]. 台湾海峡, 2009, 28(1): 19-24.
[13] 梁春光, 康现江, 李凤超, 等. 半滑舌鳎性腺的组织学研究[J]. 河北渔业. 2007, 11: 22-28.
[14] 宋海霞, 温海深. 养殖牙鲆卵巢发育及其调控的组织学研究[J]. 海洋湖沼通报, 2005, 4: 75-83.
[15] 施 芳. 鱼类生理学[M]. 北京: 农业出版社, 1991.300-319.
[16] 凌去非, 李思发, 梁新华, 等. 丁卵巢周年变化的组织学观察[J]. 上海水产大学学报, 2006, 1(15):36-40.
[17] 施兆鸿, 王建钢, 高露姣, 等. 南海黄鲷性腺发育的初步研究[J], 台湾海峡, 2006, 25(3): 353-359.
[18] 刘筠. 中国养殖鱼类繁殖生理学[M]. 北京: 农业出版社, 1993, 29-42, 42-46, 53-55.
[19] 方展强, 郑文彪, 马广智, 等. 鲇卵膜形成和卵黄发生地超微结构观察[J]. 华南师范大学学报(自然科学版), 2002, 2: 25-31.
[20] 林国辉, 方展强. 鳜鱼卵母细胞发育的组织学和超微结构观察[J]. 华南师范大学学报(自然科学版), 2007,1: 98-103.
[21] 楼允东. 组织胚胎学[M]. 北京: 中国农业出版社,1999. 126-136.
[22] Arocha F. Oocyte development and maturity classification of swordfish from the north-western Atlantic[J].Journal of Fish Biology, 2002, 60, 13-27.
Studies on ovarian development and spawn type of cultured half-smooth tongue sole, Cynoglossus semilaevis
CHEN Cai-fang, WEN Hai-shen, CHEN Xiao-yan, ZHANG Jia-ren, JIN Guo-xiong,SHI Bao, SHI Dan, YANG Yan-ping, HE Feng, LI Ji-fang
(Fisheries College, Ocean University of China, Qingdao 266003, China)
Sep., 16, 2009
Cynoglossus semilaevis; ovarian; spawn type
Seasonal variations of ovarian development and the relationship with Gonadosomatic index (GSI)、hepatosomatic index (HSI) was studied in the cultured half-smooth tongue sole Cynoglossue semilaevis. The results show that ovarian development consists of phaseⅡ,Ⅲ,Ⅳ,Ⅴ,Ⅵ, then cycles to recrudescent phase II; under artificial culture, most fish has phaseⅡovarium from March to May, and the oocytes begin to accumulate vitellin granule from June, then the whole cytoplasm is stuffed with vitellin granule ranging from September to November, suggesting the oocytes growth to mature, after spawning, the ovarium come to assimilative phase Ⅵ or recrudescent phaseⅡ; GSI reaches to an peak during reproduction, then dramatically drop after spawning or recrudescent phaseⅡ while HSI significantly increases to maximum; there is only one breeding season in the half-smooth tongue sole,and it belongs to batch-spawning fish. This study enriches reproductive physiology of fish, and offers the scientific foundation for optimizing the technology of the half-smooth tongue sole artificial reproduction.
Q133
A
1000-3096(2010)08-0029-06
2009-09-16;
2009-11-17
国家“十一五”科技支撑计划资助项目(2006BAD09A01)
陈彩芳(1982-), 女, 浙江人, 博士研究生, 主要从事鱼类繁殖生理学研究, E-mail: chencaifang@ouc.edu.cn; 温海深, 通信作者,教授, 博士生导师, E-mail: wenhaishen@ouc.edu.cn
(本文编辑: 谭雪静)

