副溶血弧菌tdh基因在毕赤酵母中的表达及溶血活性检测
赵永刚, 战文斌, 萨仁高娃, 王君玮, 王志亮
(1.中国海洋大学教育部 海水养殖重点实验室, 山东 青岛 266003; 2.中国动物卫生与流行病学中心, 山东青岛 266032; 3.中国科学院海洋研究所 海洋地质与环境重点实验室, 山东 青岛 266071)
副溶血弧菌tdh基因在毕赤酵母中的表达及溶血活性检测
赵永刚1,2, 战文斌1, 萨仁高娃3, 王君玮2, 王志亮2
(1.中国海洋大学教育部 海水养殖重点实验室, 山东 青岛 266003; 2.中国动物卫生与流行病学中心, 山东青岛 266032; 3.中国科学院海洋研究所 海洋地质与环境重点实验室, 山东 青岛 266071)
通过PCR技术从副溶血弧菌(Vibrio Parahaemolyticus, VP)基因组DNA上扩增耐热溶血素基因tdh, 双酶切后定向插入到酵母表达载体 pPICZaA中, 构建重组表达质粒 pPICZaA-tdh, 经限制性内切酶SacI线性化后电转化毕赤酵母(Pichia pastoris, P. pastoris)GS115, 经PCR和测序鉴定耐热溶血素基因成功整合到毕赤酵母的基因组中。在甲醇诱导下进行 tdh 的表达, SDS-PAGE分析证明重组 TDH(thermostable direct hemolysin, TDH) 的分子质量约为23 ku, 经 Western blotting 鉴定VP抗体能与表达的 TDH 发生特异反应, 说明 tdh 基因在毕赤酵母中的表达是准确的。溶血实验证明了表达的TDH 具有溶血活性。本研究首次应用毕赤酵母表达耐热溶血素基因 tdh, 在培养基中获得分泌表达的耐热溶血素, 为研究tdh基因的功能奠定了基础。
耐热溶血素; 分泌表达; 毕赤酵母; 溶血活性
VP 是中国对虾(Fenneropenaeus chinensis)的病原菌, 引起对虾红腿病; 该菌也能感染养殖蟹类与贝类, 导致养殖蟹类及贝类的大量死亡; 此外, VP对网箱养殖大黄鱼(Pseudosciaena crocea), 的致病性己有较多的报道, 主要引起体表充血及肠炎的症状,在高温季节造成大量的死亡; 因此, 该菌是养殖水产动物的重要条件性病原。具有致病性的菌株还能导致: (1) 食物中毒: 尤以日本、东南亚、美国等国家多见, 也是我国沿海地区及台湾省食物中毒最常见的一种病原菌; (2) 急性腹泻病: 是发展中国家急性腹泻病的主要病原体之一, 占分离菌株的 20%以上[1]; (3) 旅游者腹泻: 日本学者在 Osaka和 Kansai飞机场卫生检疫站从出国旅游的36 780 440名旅客中共发现84 777名腹泻患者, 其中由副溶血性弧菌所致者为1 959人[2]; (4)其他: 如反应性关节炎(该菌能产生 HSP60)[3]和心脏疾病等[4]。目前研究认为副溶血性弧菌的致病因子包括细菌产生的毒素(溶血素、尿素酶)和侵袭因子[5]。迄今已发现副溶血性弧菌主要有三种类型的溶血素, 即耐热的TDH和两种不耐热的 TRH(TDH related hemolysin, TRH),TLH(thermolabile hermolysin.TLH)[6]。但是, 对其致泻和溶血的机制、毒素的功能结构域等尚不十分清楚。为研究 VP 溶血毒素的功能结构域、阐明其致病机理, 本研究从实验室保存的 VP 临床分离株的基因组 DNA 中扩增出 tdh 基因, 并实现其在酵母表达系统中的高效、可溶性、分泌型表达, 获得了高效表达抗原, 并对其溶血活性进行了初步研究,并为制备抗TDH的多克隆抗体或单克隆抗体及基因功能的研究打下基础。
1 材料与方法
1.1 菌株与质粒
副溶血弧菌(Vibrio Parahaemolyticus, VP)、大肠杆菌(Escherichia coli) JM109由本实验室保存, EasySelect Pichia Expression Kit 购自Invitrogen 公司。
1.2 试剂与工程酶
Ex Taq聚合酶、pMD18-T 试剂盒、DNA Marker DL2000、DL15000、限制性内切酶Xho I、Xba I、Sac I, DNA回收试剂盒、T4DNA连接酶均购自大连宝生物工程公司; SDS、丙烯酰胺、叉丙烯酰胺、TEMED 等购自 BBI 公司; 其他试剂均为分析纯。
1.3 培养基
LLB、YPD、MDH、MMH、BMGY、BMMY培养基的组成和配制参见 Invitrogen 公司毕赤酵母(Pichia pastoris,P. pastoris)表达试剂盒操作手册。
1.4 PCR扩增目的基因
[12]将“多”误用为“少”,是将目的语过度的泛化,“多”“少”混用;[13]是目的语知识的负迁移,“越来越”与“消失”都表示逐渐减少,不能同时使用;[14]是母语的负迁移,“不多”与“少”在外语中可以用相同形式表示,汉语中是两个不同的词语。
根据对酵母表达载体 pPICZaA 的限制性酶切位点分析, 并参考副溶血弧菌tdh基因序列(GenBank
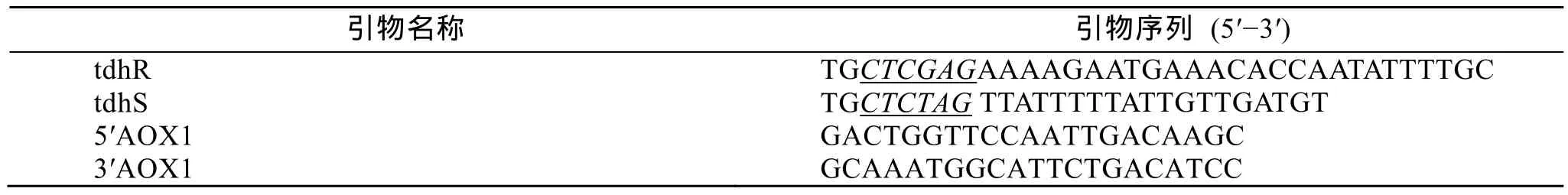
表1 本实验中使用的引物Tab. 1 Primers used in this study
以VP基因组DNA为模板, 通过PCR扩增得到直接耐热溶血素tdh基因片段。PCR反应条件: 95℃预变性5 min, 94℃变性45 s, 55℃退火45 s, 72℃延伸1 min, 35个循环, 72℃延伸10 min。产物用1%琼脂糖凝胶电泳进行检测。
1.5 酵母表达载体的构建
回收 PCR 产物, 用XhoI 和XbaI 对回收的PCR产物和质粒pPICZaA 分别进行双酶切。回收载体和目的基因, 用 T4DNA 连接酶在 16℃ 下连接,构建表达载体pPICZaA-tdh, 将连接产物转化大肠杆菌 JM109, 用 LLB 琼脂平板(含 Zeocin 25mg/L)筛选。选择阳性克隆, 提取质粒DNA, 用XhoI 和XbaI 双酶切鉴定后送上海生工生物工程有限公司测序。
1.6 电转化毕赤酵母GS115
用SacI 限制性内切酶将重组质粒pPICZαA-tdh线性化, 胶回收酶切产物。制备毕赤酵母 GS115 感受态细胞, 通过电转化法将线性化的质粒转化到毕赤酵母 GS115中。酵母转化株经 YPD (含 Zeocin 25mg/L)液体培养后提取酵母基因组 DNA, 用 PCR方法鉴定目的基因与染色体整合的情况。
1.7 重组酵母的诱导表达
将筛选得到的重组酵母 GS115/pPICZaA-tdh接种于含25 mLBMGY 培养基的三角瓶中, 28~30℃、300 r/min培养 16~18 h, 当光吸收值A600达到2.0~6.0。室温下3 000g离心5 min, 收集菌体, 用约200 mL BMMY重悬菌体, 使A600为1.0左右。将菌液置于 1 L的摇瓶中, 用双层纱布或粗棉布封口,放置于28~30℃、300 r/min的摇床上进行诱导表达。每12 h 取菌液1 mL并向培养基中添加100%甲醇至M 10069), 在基因上下游设计特异引物tdhR 和tdhS,序列见表1, 由大连宝生物工程有限公司合成。下划线部分分别是XhoI 和XbaI 酶切位点, 上游引物中AAAAGA为 pPICZα 系列载体 α 分泌因子的KEX 2 切割位点。终浓度为0.5%, 取的菌液12 000g离心10 min, 分离的上清和菌体分别进行SDS-PAGE(12%)分析。
1.8 兔抗VP血清的制备
在无菌条件下取培养过夜的 VP, 接种于含 5%血清的LB平板培养基上, 放置37℃ 孵育24 h; 挑取单菌落接种于含5% 血清5 mL LB液体培养基中37℃ 剧烈振荡 12~16 h; 然后按 1: 1 000转接于1 000 mL含5%血清LB液体培养基中37℃ 摇12~16 h, 5000 r/min收集菌体; 置于100 mL灭菌生理盐水的三角烧瓶中, 摇动混匀菌体; 用灭菌生理盐水配制成 6×1010/mL(通过活菌计数法)的菌悬液, 用终浓度为0.5% 的甲醛灭活48 h; 5000 r/min离心10 min,收集菌体; 用灭菌生理盐水洗涤1次, 5 000 r/min离心, 弃上清, 无菌试验合格后, 4℃ 12 000 r/min离心弃上清。
采用腹腔注射法免疫新西兰大白兔, 免疫程序为第 1、第 5、第9、第 11和第 13天, 注射剂量分别为 12×1010、12×1010、18×1010、18×1010和 18×1010个, 末次免疫后第7天从耳缘静脉取少量血液, 室温静置30 min后, 4℃以3000 r/min离心5 min, 取血清置-20℃保存备用。
1.9 表达蛋白的Western blotting鉴定
将表达的TDH进行SDS-PAGE电泳, SDS-PAGE电泳后的蛋白胶通过半干转印方法, 将胶上的蛋白转印到PVDF膜上, 利用Western blotting方法鉴定表达产物的特异性, Western blotting所用的一抗为上述制备的的VP抗体, 二抗为anti-rabbit IgG(Fab)- HRP。
1.10 表达蛋白溶血性检测
将重组酵母培养液以 3 000 r/min 离心 5 min,取上清液加入终浓度为5 mmol/L的DTT室温作用30 min; 然后在兔血平板上打两个孔, 分别加入 50µLDTT作用的蛋白及5 mmol/L的DTT, 37℃ 培养12~24 h后观察结果。
2 结果与分析
2.1 PCR扩增目的基因
以VP基因组 DNA 为模板, 经PCR 扩增得到576 bp 左右的片段, PCR 产物回收电泳结果见图1。

图1 tdh基因 PCR扩增结果Fig. 1 PCR amplification products of tdh gene1. DL2000 Marker; 2. tdh PCR扩增产物1. DL2000 Marker; 2. tdh PCR products
2.2 酵母表达载体的构建及电转化毕赤酵母GS115
将胶回收的 PCR产物及表达载体 pPICZaA经XhoI和XbaI双酶切, 连接、转化大肠杆菌JM109感受态细胞。提取质粒, 质粒经XhoI和XbaI双酶切鉴定后出现2条带, 一条带为载体约 3 600 bp, 另一条带约为 576 bp, 电泳结果如图2所示。重组质粒测序结果表明该质粒中含有目的基因片段, 且读码框正确, 获得重组表达质粒pPICZaA-tdh。用SacI 对重组质粒 pPICZaA-tdh进行线性化后, 电转化宿主菌 GS115, 利用酵母表达载体通用引物 5′AOX1、3′AOX1 和目的基因特异性引物 tdhR、tdhS对重组子进行PCR鉴定。从图2可以看出, 使用表达载体通用引物, 阳性重组菌扩增出1 100 bp 左右的片段,使用基因特异性引物, 扩增出576 bp 左右的片段。电泳结果显示条带大小与理论值相符, 证明线性化的 pPICZaA-tdh 与酵母菌 GS115 染色体基因组成功重组。
2.3 重组蛋白在毕赤酵母中的诱导表达
重组毕赤酵母 GS115/pPICZaA-tdh的诱导, 每12 h 取菌液1 mL并向培养基中添加100%甲醇至终浓度为0.5%, 取的菌液12 000g离心10 min, 分离的上清和菌体分别进行SDS-PAGE(12%)分析。结果在96 h出现表达条带, SDS-PAGE 电泳结果如图 3所示, 从图中可以看出, 在分子质量 23 ku 处有明显的特异条带。

图2 阳性转化子的PCR鉴定和重组表达质粒pPICZaA-tdh酶切鉴定结果Fig. 2 Identification of transformants by PCR and pPICZaA-tdh after digestion by Xho I and Xba I1. 通用引物扩增产物; 2. 特异引物扩增产物; 3. DNA marker DL2000; 4. pPICZaA-tdh双酶切结果; 5. DNA marker DL2000;6. DNA marker DL150001. DNA marker DL2000; 2. PCR products with universal primers;3. PCR products with specific primers;4. pPICZaA-tdh after digestion by Xho I and Xba I;5. DNA marker DL2000; 6. DNA marker DL15000
2.4 表达蛋白的Western blotting鉴定
将表达的 TDH与上述制备的 VP抗体进行Western blotting分析, 结果制备的VP抗体能与表达的蛋白发生特异性反应, 如图 3 所示, 表明表达的蛋白是正确的。
2.5 溶血活性检测
将50µL DTT作用后的蛋白和5 mmol/L DTT分别加入兔血平板, 37℃培养2~3 h后, 可见与 DTT作用后的蛋白周围出现溶血现象, 而5 mmol/L DTT对照孔周围无溶血现象, 如图4所示。
3 讨论
与大肠杆菌相比, 酵母是低等真核生物, 具有细胞生长快, 易于培养, 遗传操作简单等原核生物的特点, 又具有真核生物对表达的蛋白质进行正确加工, 修饰, 合理的空间折叠等功能, 非常有利于真核基因的表达, 因此酵母表达系统受到越来越多的重视和利用, 其中毕赤酵母(P. pastoris)因具备良好的发酵与分泌性能, 尤引人注目[7~9]。目前利用P. pastoris已成功地表达了多种极有价值的蛋白, 如破伤风毒素的C 片段[10]、HIV gp120[11]及乙型脑炎病毒E 蛋白[12]、家蚕抗菌肽及HPV 16E6 蛋白[13,14]等, 在基因工程疫苗的开发研制中已显示出强大的应用潜力。

图3 重组蛋白在毕赤酵母中表达和Western blotting分析Fig. 3 SDS-PAGE and Western blotting analysis of recombinant TDH protein in P. pastoris1. 经过5天培养的转染了空质粒pPICZαA GS115细胞; 2.4. 经过5天培养的转染了pPICZaA-tdh GS115细胞培养上清; 3. 经过5天培养的转染了 pPICZaA-tdh GS115细胞; 5. 表达蛋白的Western blotting鉴定. M. 低分子质量蛋白Marker1. P. pastoris GS115 cells transformed with plasmid pPICZαA after five days of cultivation; 2, 4 cells culture supernatants after five days of cultivation of P. pastoris GS115 cells transformed with expression plasmid pPICZaA-tdh; 3. P. pastoris GS115 cells transformed with plasmid pPICZaA-tdh after five days of cultivation;5. Western blotting analysis of recombinant TDH protein; M. a low molecular mass SDS calibration standard

图4 TDH的溶血活性检测Fig. 4 Hemolysis by TDH1.TDH; 2. 5 mmol/L DTT1. TDH; 2. 5 mmol/L DTT
Vp的TDH是一种肠毒素, 是Vp的主要致病因子, 能引起小肠绒毛刷状缘脱落。对肠道毒素源性微生物而言, 抗毒素的免疫应答起着非常重要的免疫保护作用[15~19], 随着分子生物学技术的发展以及人们对各种类型疫苗优劣比较的进一步深化, 应用重组DNA技术构建基因工程疫苗已成为大势所趋。
本实验利用PCR技术从实验室保存的VP临床分离株的基因组 DNA中成功地扩增出tdh基因;经序列测定和比对, 这个基因的核苷酸序列与Genbank上已发表的序列的同源性为99.9%, 因此可以确定副溶血弧菌的基因组含有这个基因, 并成功将tdh基因克隆到毕赤酵母表达载体 pPICZaA 上,构建了重组表达载体; 经甲醇诱导, SDS-PAGE电泳证明了tdh基因发生了表达, 表达产物约为 23 ku,与推测的理论产物大小一致。本研究在毕赤酵母中成功表达了编码 TDH 的基因在国内外尚属首次,经溶血活性检测表达蛋白具有溶血活性, 为制备抗TDH的多克隆抗体或单克隆抗体及基因功能和致病性的研究打下基础。
[1] Jin-Hua D, Yeong-Sheng L, Hin-Chung W. Effect of iron limitation on production of a siderophore, outer membrane proteins, and hemolysin and on hydrophobicity, cell adherence, and lethality for mice ofVibrio parahaemolyticus[J]. Infection and Immunity, 1992,60(7): 2 952-2 956.
[2] Ueda Y, Suzuki N, Mori H,et a1. Bacteriological studies of travelers diarrhoea.5) Analysis of enteropathogenic bacteria at Osaka Airport Quarantine Station from January 1992 through September 3rd,1994 [J].Kansenshogaku Zasshi, 1996, 70(1): 29-41.
[3] Yamamoto S, Funahashi T, Ikai H,et al. Cloning and sequencing of theVibrio parahaemolyticusfur gene [J].Microbiol Immuno1, 1997, 41(9): 737-741.
[4] Wong H C, Lee Y S. Regulation of iron on bacterial growth and production of thermostable direct hemolysin byVibrio parahaemolyticusin intraperitoneal infected mice [J]. Micriobiol Immuno1, 1994, 38(5): 367-371.
[5] Wong H C, Lee Y S. Effect of iron on the recovery of viable bacteria from the cardiac blood in an experimental mouse model and on the serum resistance and macrophage phagocytosis ofVibrio parahaemolyticus[J]. J Diarrhoeal Dis Res, 1995, 13(4): 219-223.
[6] Nozaki K, Kuroda T, Mizushima T,et a1. A new Na+/H+antipoeter, NhaD, ofVibrio parahaemolyticus[J]. Biochim Biophys Acta, 1998, 1 369(2): 213-220.
[7] 刘峰, 霍克克, 李育阳. 非常规酵母基因工程表达系统 [J]. 生物工程学报, 1996, 12(1): 1-5.
[8] Romanos M. Advances in the use ofPichia pastorisfor high-level gene expression [J]. Curr Opin Biotechnol,1995, 6 (5): 527-533.
[9] Faber K N, Hader W, Ab G, et al. Methylotrophic yeasts as factories for the production of foreign proteins [J]. Yeast, 1995, 11(14): 1 331-1 334.
[10] Clare J J, Rayment F B, Ballantine S P, et al. High level expression ioftetanus toxin fragment C in Pichia pastoris strains containing multiple tandem integrations of the genes [J]. Bio Technol, 1991, 9: 455-460.
[11] Scorcer C A, Buckholz R G, Clare J J, et al. The intracellular production and secretion of HIV-1 envelope protein in the methyltrophic yeast Pichia pastoris [J].Gene, 1993, 136: 111- 119.
[12] 吴玉水, 任君萍, 黄庆生, 等. 乙型脑炎病毒 E 蛋白在巴斯德毕赤酵母中的表达 [J]. 细胞与分子免疫学杂志, 2003, 19 (2): 130-135.
[13] 刘忠渊, 张富春, 蔡伦, 等. 酵母菌中表达的新疆家蚕抗菌肽(Cecropin-XJ)的特性研究 [J]. 微生物学报,2003, 5 (43): 635-641.
[14] 刘忠渊, 张富春, 赵干, 等. HPV16(新疆株)E6 在Pichia pastoris酵母中的分泌表达[J]. 生物技术,2003, 1 (13): 4-6.
[15] Clemens J D, Sack J R, Harris J, et a1. Field trial of oral cholera vaccines in Bangladesh [J]. Lancet, 1986,21(1): 124-127.
[16] Christiane R, Claudia R, Nikolaus K. Humoral and cellular immune responses in the marine respiratory tract following oral immunization with cholera toxin or Escherichia coli heat-labile enterotoxin [J]. Vaccine,1996, 14(3): 792-798.
[17] Robinson H L. Nucleic acid vaccine: an overview [J].Vaccine, 1997, 15(8): 785-787.
[18] Luz M, Guzmar V, Yankel M K. Fusion of Escherichia coli heat-stable enterotoxin and heat-labil enterotoxin B subunit [J]. J Bacteriol, 1987, 169(7): 5 201-5 208.
[19] Rejesh K G. New advances in vaccine technologies and applications [J]. Vaccine, 1995, 13(10): 1 623-1 625.
Expressing the tdh gene of Vibrio parahaemolyticus in Pichia pastoris and its hemolysis activity
ZHAO Yong-gang1,2, ZHAN Wen-bin1, SAREN Gao-wa3, WANG Jun-wei2, WANG Zhi-liang2
(1. Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China;2. China Animal Health and Epidemiology Center, Qingdao 266032, China; 3. Key Laboratory of Marine Geology and Environment, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China)
Apr., 22, 2010
Thenmostable direct hemolysin; Secretory expression; Pichia pastoris; Hemolysis
We cloned thenmostable direct hemolysin gene (tdh) from the genome DNA of Vibrio parahaemolyticus polymerase chain reaction (PCR). The gene was ligated into eukaryotic expression vector pPICZaA. The recombinant plasmids pPICZaA-tdh was transformed into P. pastoris GS115 cells by electroporation after SacI digestion.After the transformed cell was induced with methanol, one protein of 23 kDa appeared in the medium as detected by SDS PAGE. Western blotting showed that recombinant TDH would react with rabbit antiserum immunitied by VP antigen. The recombinant protein also showed hemolytic activity. This is the first report describing successful expression of the tdh gene in P. pastoris and consequent production of secretory recombinant TDH, providing a framework for further structural and functional studies.
P714+.5
A
1000-3096(2010)09-0010-05
2010-04-22;
2010-06-25
国家863计划项目(2006AA100306; 2006AA100307)
赵永刚 (1974-), 男, 博士研究生, 主要从事水生生物学研究, 电话: 053287839922, E-mail: zhyg929@163.com; 战文斌, 通信作者, 电话: 0532-82032284, E-mail: wbzhan@ouc.edu.cn
(本文编辑: 康亦兼)

