缢蛏YC-2蛋白的提取及抗氧化作用研究
赵艳景, 裴 波, 胡 虹, 王 颖
(1. 淮海工学院 江苏省海洋生物技术重点建设实验室, 江苏 连云港 222005; 2. 连云港中医药高等职业技术学校, 江苏 连云港 222006; 3. 中国药科大学, 江苏 南京 210009)
缢蛏YC-2蛋白的提取及抗氧化作用研究
赵艳景1, 裴 波1, 胡 虹2, 王 颖3
(1. 淮海工学院 江苏省海洋生物技术重点建设实验室, 江苏 连云港 222005; 2. 连云港中医药高等职业技术学校, 江苏 连云港 222006; 3. 中国药科大学, 江苏 南京 210009)
以新鲜缢蛏(Sinonovacula constricta)为材料, 经水萃取、(NH4)2SO4盐析、DEAE离子交换层析、Sepharose CL-6B凝胶层析、冻干浓缩。结合SDS-PAGE电泳技术, 硫代巴比妥酸(TBA)法初步鉴定各个组分的抗氧化活性, 并用Bradford法进行蛋白的定量。结果表明, 80%饱和度(NH4)2SO4盐析得到的组分经离子交换层析以及凝胶层析得到一个蛋白纯品YC-2, 具有2个亚基, 大亚基的分子质量为61.23 ku, 小亚基的分子质量为45.39 ku, YC-2蛋白的分子质量为106.62 ku, 而且其具有较高的抗氧化活性,在0.627 g/L时对·OH清除率达99.7 %。
缢蛏(Sinonovacula constricta); 蛋白质; 分离纯化; 抗氧化活性
缢蛏(Sinonovacula constricta)隶属软体动物门、瓣鳃纲、异齿亚纲、帘蛤目、竹蛏科, 广泛分布于中国、日本和朝鲜等国的沿海地区, 中国北自辽宁、山东南至广东、福建都有分布。其肉丰腴脆嫩, 鲜美清甜, 药物功效显著。随着“蓝色革命”时代的迅速发展,海水贝类养殖等相关研究日益兴起, 缢蛏成为我国四大养殖贝类之一, 对它的研究和开发利用受到越来越多的科研工作者的重视[1]。已经有一些报道指出了缢蛏的药物活性, 如抗氧化和抗肿瘤活性等[2,3]。目前国内对缢蛏蛋白的药物活性研究的比较少。
在正常的生命过程中自由基为维持生命所必需,但自由基也是生物大分子、细胞和生物组织的危险的杀手。一般来说, 自由基具有很高的反应活性, 可造成对机体的损伤。多年来, 大量的实验证明, 生命过程中的许多重要反应, 如多种酶催化的氧化还原反应、光合作用、生物发光等多与自由基有关; 多种疾病、生命的衰老亦涉及自由基反应学作用, 羟自由基(·OH)是目前所知活性氧中对生物体毒性最强、危害最大的一种自由基。·OH几乎可以和生物细胞内存在的所有类型的分子反应, 而且具有很高的速率常数。在活性氧中, 它的危害性最大。水的脉冲射解、Haber-Weiss反应和Fenton反应, 甚至在超声破碎和冷冻干燥的过程中都会产生·OH[4]。目前对羟自由基的研究已涉及不同的学科。寻找对羟自由基具有良好清除能力的清除剂, 特别是从常见的食品资源中进行筛选, 就是一个非常有必要的课题, 如此可以保证体内自由基的有效清除, 维护机体的正常机能, 也可预防一些疾病的发生[5~7]。现在虽然有很多人研究自由基, 但从海洋蛋白资源中获取具有抗氧化活性蛋白质的研究报道很少, 只有Yu等[8]对海蜇蛋白抗氧化活性和李翠萍等[9]对白色霞水母蛋白抗氧化活性的初步研究的报道, 其他海洋生物蛋白质的抗氧化活性报道很少。赵艳景等[10]发现在缢蛏粗提物中存在活性比较强的物质。本研究旨在从中提取纯化到比较纯的活性物质, 为将缢蛏开发成为新的具有抗氧化作用的功能食品或新的抗氧化药物先导化合物。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
缢蛏(Sinonovacula constricta)购于连云港通灌蔬菜活禽直销市场。
1.1.2 试剂
2-脱氧-D-核糖, 美国 INALCO 公司; 硫代巴比妥酸(TBA) , 国药集团化学试剂有限公司; Tris-Base,北京夏斯生物技术有限公司; 丙烯酰胺考马斯亮蓝G-250溴酚兰考马斯亮蓝R-250, 加拿大BBI公司。其余试剂均为国产分析纯。
1.2 实验方法
1.2.1 缢蛏蛋白的粗提及分级盐析
称取50 g新鲜缢蛏肌肉组织, 放入组织匀浆机中搅成匀浆, 用大约 450 mL萃取缓冲液洗出匀浆,在4℃冰箱中充分浸取6 h。将萃取液于冷冻离心机中, 4℃下, 12 000 r/min离心30 min, 倒出上清并加水补充至500 mL。对提取到的蛋白水溶液进行分级盐析, 硫酸铵的饱和度比分别为30%、40%、50%、60%、70%、80%、90%、100%。 将分级盐析得到的各个组分的沉淀再次溶解后装入透析袋中, 加入适量的透析缓冲液于4℃透析24 h, 每4 h换1次透析液。将盐析得到的各个组分的蛋白质离心去除变性的蛋白质后, 测量各组分蛋白溶液的体积。将离心后的上清冷冻或冷藏, 以备下一步纯化。检测分级盐析各组分的蛋白含量以及蛋白的抗氧化活性, 制作出蛋白质盐析曲线。
1.2.2 DEAE Sepharose Fast Flow离子交换层析
取上清液上样DEAE Sepharose Fast Flow离子交换柱, 层析柱用10 mmol/L Tris-HCl, pH7.0 缓冲液平衡, 用10 mmol/LTris-HCl+1mol/NaCl, pH7.0进行离子强度线性梯度洗脱, 洗脱处理温度 25℃, 流速为1.5 mL/ min , 组分在280 nm波长的吸光度大于0.03时开始收集, 每管收集3 mL。对收集到的不同组分进行蛋白质定量、定性分析, 并测量各个组分的活性, 将相对活性较大的组分透析除盐后冷冻干燥。
1.2.3 Sepharose CL-6B凝胶层析
将DEAE层析得到的活性较强组分冻干粉用25 mmol/L Tris-HCl, pH7.5溶解, 4℃下10 000 r/min离心 5 min, 上 Sepharose CL-6B柱。用 25mmol/L Tris-HCl, pH7.5, 0.5 mL/min流速平衡柱, 上样2mL,用上述缓冲液以 0.4 mL/min流速洗脱, 组分在 280 nm波长的吸光度值大于0.03时开始收集, 每管收集2 mL。对收集到的不同组分进行蛋白质定量、定性分析, 并测量各个组分的活性。选择相对活性较大的组分做进一步分析。
1.2.4 纯度测定[11,12]
采用 SDS-聚丙烯酰胺凝胶(7.5%)电泳检测分离得到的缢蛏蛋白质的纯度。
常规聚丙烯酰胺凝胶电泳(native-PAGE) 电泳检测分离得到的缢蛏蛋白质的纯度。
1.2.5 抗氧化活性测定
采用硫代巴比妥酸(TBA)法[13,14]测定: 取 0.2 mL的FeSO4-EDTA混合液(10.0 mmol/L)于5 mL刻度试管中, 加入 0.5 mL的 2-脱氧核糖溶液(10.0 mmol/L)和0.6mL样品, 用磷酸缓冲液(pH为7.4, 0.l mol/L)定容至 1.8 mL, 再加入 0.2 mLH2O2(10.0 mmol/L), 空白样加入蒸馏水 0.2mL, 混匀后置于 37℃恒温水浴中反应l h。然后加入质量分数为2.8%三氯乙酸(TCA)溶液1.0 mL, 在4 000 r/ min下离心20 min, 取上清液2.0 mL于另一支试管中, 加入质量分数为 1.0%硫代巴比妥酸(TBA)溶液 1.0 mL, 混匀后置沸水浴反应15 min, 冷却后稀释5倍, 在波长532 nm处测其吸光度值。提取物对羟自由基的清除效果用清除率(SA%)表示, 按下式计算:
SA(%)=[(Ac-As)/(Ac-A0)]×100%
式中:Ac为不加清除剂的吸光度;As为加入峰样品后的吸光度;A0为试剂空白的吸光度。
1.2.6 蛋白含量测定
采用Bradford 检测法[15,16]对所得到的蛋白质进行含量测定。
2 结果与分析
2.1 分级盐析实验结果
本实验采用了30%~100%硫酸铵饱和度的分级盐析。得到不同饱和度盐析出来组分的蛋白含量和抗氧化活性, 如表1所示。
由表1可以看出, 70%盐析组分的比活力较大。因此采用70%盐析的组分进行下一步的分离纯化。

表1 不同饱和度盐析蛋白含量及活性Tab. 1 Protein content and antioxidant activity in samples prepared by (NH4) 2SO4 salting out
2.2 DEAE离子交换层析结果
用上述 70%硫酸铵饱和度盐析组分浓缩后上DEAE离子交换层析, 洗脱图谱见图1。
从图谱上可以看出, 在 280nm 检测波长下, 一共洗脱出3个峰, 分别为D1、D2、D3将这3个峰样品进行蛋白含量和抗氧化活性测定, 结果见表 2。其中D3的蛋白含量和活性最强, 作为进一步纯化的样品。
2.3 Sepharose CL-6B凝胶层析结果
将上述DEAE离子交换层析得到的组分D3进行Sepharose CL-6B凝胶层析。结果如图2所示, 共得到3个组分, 分别命名为S1, YC-2, S3。
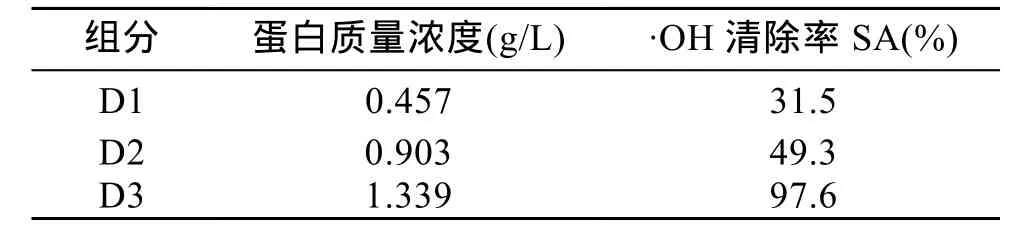
表2 DEAE分离的不同组分蛋白含量及活性Tab. 2 Protein content and antioxidant activity in proteins isolated by DEAE-cellulose chromatography
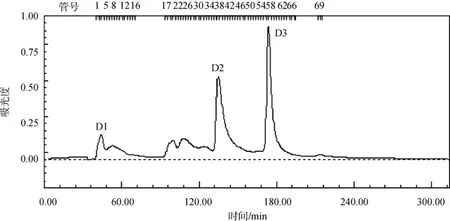
图1 DEAE离子交换图谱Fig. 1 DEAE Sepharose Fast Flow chromatography
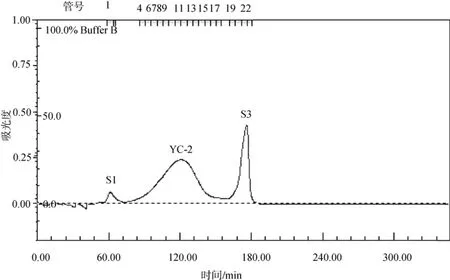
图2 Sepharose CL-6B凝胶层析图谱Fig. 2 Sepharose CL-6B chromatography
将上述 3个样品进行蛋白含量和抗氧化活性测定, 结果见表3。
由表3可见, YC-2抗氧化活性最强, 有待于进一步对其鉴定分析。
2.4 电泳结果
将上述得到的 YC-2蛋白进行 SDS-聚丙烯酰胺凝胶和常规聚丙烯酰胺凝胶电泳, 结果如图3、4所示, 图4中YC-2的常规电泳显示一条带, 而图3显示YC-2电泳出现两条带, 这说明此蛋白可能有两个亚基。由蛋白质 marker的标准曲线可计算出, YC-2大亚基的分子质量为61.23 ku, 小亚基的分子质量为45.39 ku。因此, YC-2蛋白的分子质量为106.62 ku。
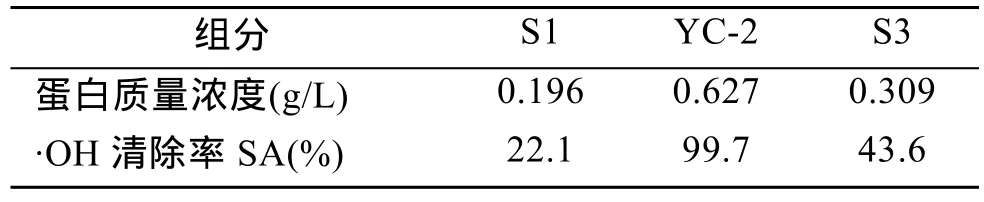
表3 Sepharose CL-6B分离的不同组分蛋白含量及活性Tab. 3 Protein content and antioxidant activity of proteins separated by Sepharose CL-6B chromatography
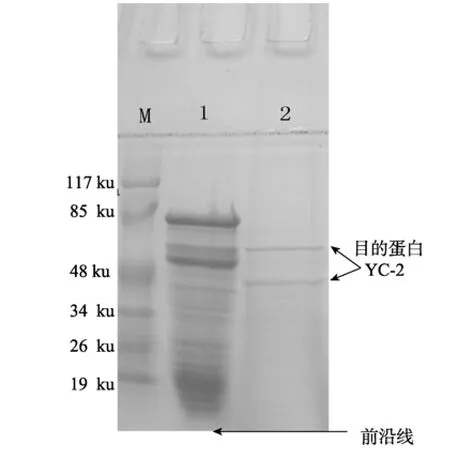
图3 YC-2蛋白的SDS-PAGE电泳Fig. 3 SDS-PAGE of YC-2M为蛋白marker; 1为D3组分; 2为YC-2组分M: Proteins markers; Lane 1:D3; Lane 2: YC-2

图4 YC-2蛋白的活性电泳 Fig. 4 Native-PAGE of YC-2
3 讨论
近年来, 研究发现自由基与许多疾病如心血管病、癌症及氧化胁迫的其他机能障碍密切相关[17,18]。人体细胞在氧化还原代谢过程中产生少量性质活泼的氧自由基(活性氧) ,主要有超氧阴离子自由基(O2-·)、羟自由基(·OH)等[19]。多项研究结果表明,肿瘤发生、辐射致癌、心脑血管疾病、器官的缺血再灌流、药物中毒、人体衰老等过程都涉及自由基和活性氧[20]。近年来, 随着海洋生物技术研究的发展, 不断从海洋生物中发现一些具有抗氧化活性的化合物, 如海藻多糖、壳聚糖及其衍生物等[21,22], 但从海洋蛋白资源中获取具有抗氧化活性蛋白质的研究报道很少。缢蛏是传统的药食两用海洋贝类, 属于软体动物门双壳纲真瓣鳃目平齿亚目, 在我国沿海地区普遍分布, 可入药。早在《本草纲目》和《药录》中就记载了蛏肉的功效: 去邪热、治烦闷、冷痢、热痢、妇人产后虚损、虚热[23], 赵艳景等[13]发现在缢蛏粗提物中存在抗氧化活性较强的物质。
本研究通过分级盐析实验, 发现在硫酸铵饱和度80%时, 缢蛏蛋白的比活力最强。用硫酸铵饱和度为80%时的样品进行DEAE离子交换层析, 共得到3个组分, 其中活性最高的是在盐浓度为 40%时洗脱下来的组分D3, 将D3透析冻干后, 进行凝胶层析共得到 3个组分 S1、YC-2、S3, 其中 YC-2组分的活性最高, 将 YC-2进行 SDS-PAGE和 native-PAGE,变性电泳结果为两条带, 非变性电泳结果为一条带。因此判断, YC-2有 2个亚基, 大亚基的分子质量为61.23 ku, 小亚基的分子量为45.39 ku, 所以YC-2蛋白的分子质量为106.62 ku。通过以上的分离纯化步骤得到了一个电泳纯的缢蛏蛋白, 并对其分子质量和活性做了初步的分析。但对于缢蛏蛋白YC-2作为一种新型的抗氧化物的分子机制及其结构、性质, 究竟是一种功能性蛋白还是一种新的酶, 还有待于进一步研究。
[1] 安贤惠, 李联泰. 缢蛏研究现状及发展前景[J]. 科学养鱼, 2005, 1: 4-5.
[2] 雷晓凌, 吴红棉, 范秀萍, 等. 缢蛏糖胺聚糖的提取分离及其体外抗肿瘤活性的初步研究[J]. 药物生物技术, 2004, 11 (3) : 146-149.
[3] 肖湘, 方明英, 张尔贤, 等. 缢蛏、织锦巴非蛤、二色裂江珧清除氧自由基作用研究[J]. 中国海洋药物,2002, 3: 5-7.
[4] 孙存普, 张建中, 段绍瑾. 自由基生物学导论[M].北京: 中国科学技术出版社, 1999. 25-27.
[5] 陈瑗, 周玫. 自由基医学[M]. 北京: 人民军医出版社, 1991.45-47.
[6] 赵保路. 氧自由基和天然抗氧化基[M]. 北京: 科学出版社, 1997.85-89.
[7] 祁克宗, 王林安. 自由基和生物抗氧化系统理论与外科学的关系[J]. 安徽学报, 1966, 23(2): 171-174.
[8] Yu H H, Liu X G, Xing R E, et al. In vitro determination of antioxidant activity of proteins from jellyfish Rhopilema esculentum [J]. Food Chem, 2006, 95:123-130.
[9] 李翠萍, 于华华, 陈晓琳, 等. 白色霞水母蛋白抗氧化活性的初步研究[J]. 海洋科学, 2008, 32 (7) :65-70.
[10] 赵艳景, 胡虹, 王颖. 3种蛏类水提液的抗氧化作用研究[J]. 安徽农业科学, 2008, 36(31): 13 660-13 661.
[11] 郭尧君. 蛋白质电泳手册[M]. 北京: 科学出版社,2000. 54-157.
[12] Diano M, Bivic Le. Production of highly specific polyclonal antibodies using a combination of 2-electrophoresis and nitrocellulose-bound antigen[M]. NJ: Protein Protocols Handbook Humana Totowa, 1996. 703-710.
[13] Andrews A T. Electrophoresis: Theory, Techniques and Biochemical and Clinical Applications[M]. 2nd., Clarendon, Oxford. 1986. 53-75.
[14] 韩鹤友, 何治柯, 曾云鹗. 羟自由基的分析研究进展[J]. 分析科学学报, 2001, 17: 45-47.
[15] Bradford M M A. Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein of protein-dye binding [J].Anal Biochem, 1976, 72: 248-254.
[16] Red S M, Northcote D H. Minimization of variation in the response to different proteins of the Coomassie Blue G dye-binding assay for protei [J]. Anal Biochem,1981, (116): 53-64.
[17] 刘立明, 刘丽虹, 宋功武, 等. 分光光度法测定Fenton 反应产生的羟自由基[J]. 湖北大学学报,2002, (4): 326-328.
[18] 韩鹤友, 何治柯, 曾云鹗. 羟自由基的分析研究进展[J]. 分析科学学报, 2001, 17: 45-47.
[19] 范晓岚, 杨军, 糜漫天, 等. Βeta-胡萝卜素的抗氧化作用与疾病预防[J]. 中国公共卫生, 2003, 4: 479-480.
[20] Cuzzocrea S, Riley D, Caputi A P, et al. Antioxidant therapy: a new pharmacological approach in shock , in flammation, and ischemia/ reperfusion injury [J].Pharmacol Rev, 2001, 53: 135-139.
[21] 张全斌, 于鹏展, 周革非, 等. 海带褐藻多糖硫酸酯的抗氧化活性研究[J]. 中草药, 2003 , 34: 824-826.
[22] Xing R E, Yu H H, Liu S, et al. Antioxidant activity of differentl regioselective chitosan sulfates in vitro [J].Bioorg Med Chem, 2005, 13 (4): 1 387-1 392.
[23] 张金鼎. 海洋药物与效方[M]. 北京: 中医古籍出版社, 1998.
Extraction of YC-2 from Sinonovacula constricta and its antioxidant activity
ZHAO Yan-jing1, PEI Bo1, HU Hong2, WANG Ying3
(1. Jiangsu Key Laboratory of Marine Biotechnology, Huaihai Institute of Technology, Lianyungang 222005, China;2. LianYunGang Higher Vocational Technical College of Traditional Chinese Medicine, Lianyungang 222005,China; 3. China Pharmaceutical University, Nanjing 210009, China)
Jul., 30, 2009
Sinonovacula constricta; protein; separation and purification; antioxidant activity
Protein YC-2 was isolated from Sinonovacula constricta by water extraction, ammonia sulphate precipitation (80% saturation), ion exchange chromatography, and gel chromatography, and concentrated by freeze drying. SDS-PAGE and the thiobarbituric acid (TBA) method were used to identify various components and their antioxidant activities in Sinonovacula constricta extracxts. We found that YC-2, a dimeric proteins with a 61 ku large subunit and a 45 ku small subunit, had a high oxidation resistance, the removal rate on • OH being 99.7 % at 0.627 g/L.
S185
A
1000-3096(2010)06-0034-05
2009-07-30;
2009-11-20
江苏省海洋生物技术重点建设实验室开放基金项目(HS07014); 江苏省基础研究计划(自然科学基金)——企业博士创新项目(BK2009641); 淮海工学院引进人才科研启动基金( KQ07018)
赵艳景(1976-), 女, 河北保定人, 博士, 讲师, 研究方向: 海洋生物活性物质, 电话: 13851263305, E-mail: zhaoyanjing1976@163.com
(本文编辑: 康亦兼)

