混合无机酸消解-固相萃取-高效液相色谱-串联质谱法分析贝类壳体中的3种全氟磺酸化合物
杨 锦, 汪 磊, 陈 晨, 张 姣, 孙红文
(环境污染过程与基准教育部重点实验室(南开大学),天津300071)
混合无机酸消解-固相萃取-高效液相色谱-串联质谱法分析贝类壳体中的3种全氟磺酸化合物
杨 锦, 汪 磊*, 陈 晨, 张 姣, 孙红文
(环境污染过程与基准教育部重点实验室(南开大学),天津300071)
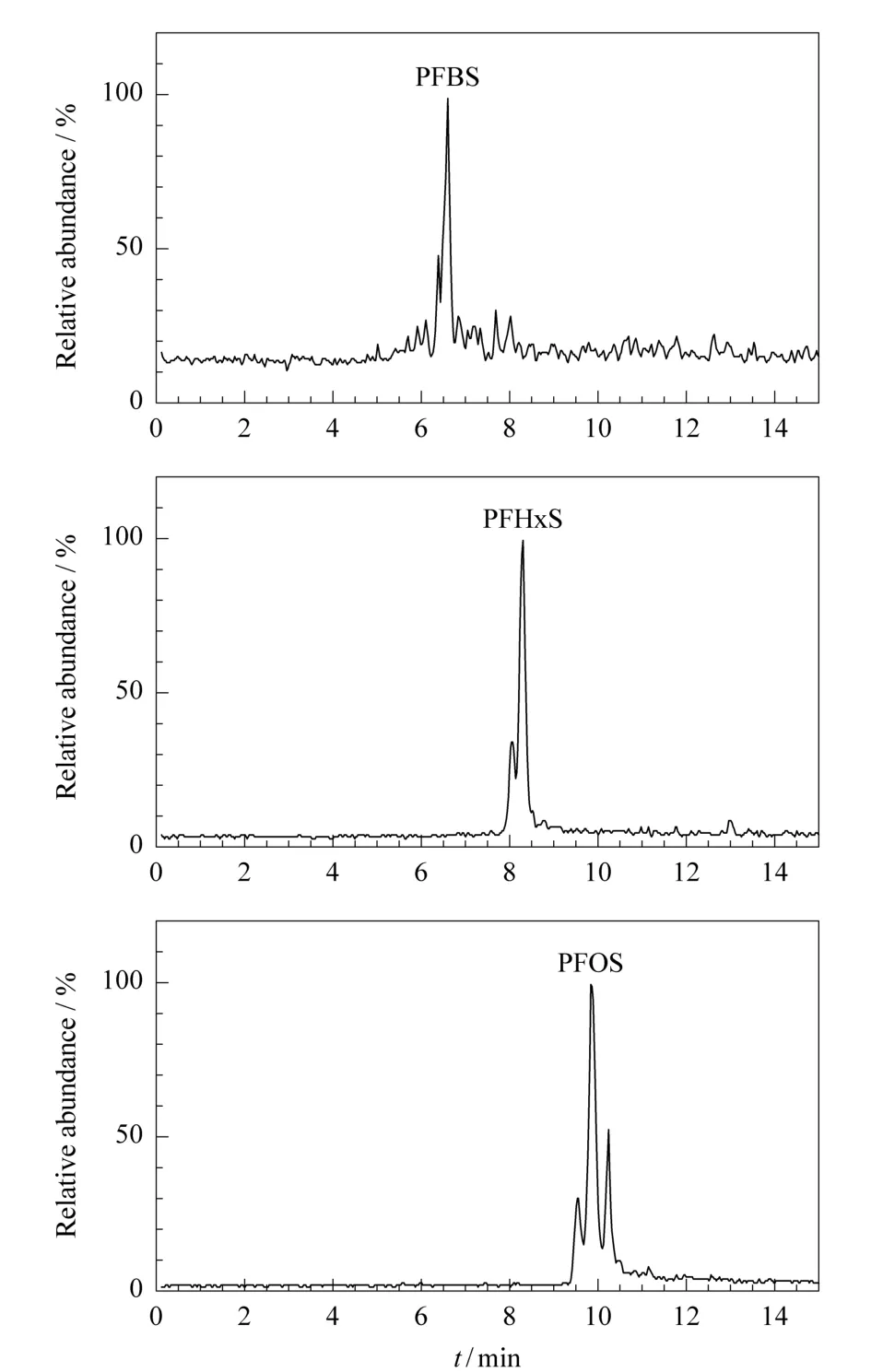
建立了采用混合无机酸消解-固相萃取(SPE)-高效液相色谱-电喷雾电离串联质谱(HPLC-ESI-MS/MS)分析贝类壳体中的3种全氟磺酸化合物的方法。将贝壳粉经硝酸/盐酸混合酸消解,用氢氧化钠调节消解液的pH值至6后采用Oasis WAX固相萃取柱富集净化,然后采用内标法通过HPLC-ESI-MS/MS在分时段选择反应监测模式下分析上述全氟磺酸化合物。结果表明,该方法对于贝壳中全氟丁烷磺酸、全氟己烷磺酸和全氟辛烷磺酸的检出限(LOD)分别为0.28,0.42和0.43ng/g,加标回收率为94.88%~96.24%。采用此方法对渤海湾两种双壳贝类壳体进行的采样分析也表明,贝壳中3种目标污染物的含量范围为 混合酸消解;固相萃取;高效液相色谱-串联质谱;全氟磺酸;贝类壳体 Abstract:For the analysis of perfluorobutane sulfonate(PFBS),perfluorohexane sulfonate(PFHxS)and perfluorooctane sulfonate(PFOS)in shells,an extraction method of mixed inorganic acid digestion coup led with solid phase extraction(SPE)was established.The target com pounds were determ ined by high performance liquid Chromatography-tandem mass spectrometry(HPLC-MS/MS).The shell pow derwas at first digested with the mixture of nitric acid and hydrochloric acid,then the digestion solution was adjusted to pH6with sodium hydroxide,and cleaned up with Oasis WAX SPE cartridge.The perfluoro sulfonated Chemicals were quantified with HPLC-MS/MS using electrospray ionization in negativeionmode with internal standard method.The limits of detection(LOD s)were of0.28ng/g for PFBS,0.42ng/g for PFHxS and0.43ng/g for PFOS,and matrix recoveries of the perfluoro sulfonated Chemicals were 94.88%-96.24%.The analytical results for the shells of two bivalves from Bohai Bay show ed this p retreatment method is suitable for the determination of perfluoro sulfonated acids(PFSAs)in shells.Concentrations of PFSAs in the shells ranged from Key words:mixed acid digestion;solid phase extraction(SPE);high performance liquid Chromatography-tandem mass spectrometry(HPLC-MS/MS);perfluoro sulfonated Chemicals;shells 以全氟辛烷磺酸(PFOS)为代表的全氟磺酸类化合物是全氟化合物中的一类重要物质,它们被广泛应用于纺织、造纸、包装、农药、地毯、皮革、装潢、聚合物添加剂、表面活性剂及灭火泡沫等民用和工业产品生产领域[1]。含全氟磺酸化合物产品的大量使用使其以各种途径进入全球范围内的各种环境介质,尤其是水体中[2]。该类物质由于具有表面活性剂性质,含有水溶性官能团,在水中的溶解度大(如PFOS为570m g/L),因此能在水体中大量长期存在,造成海水、地下水和饮用水水源污染[3]。PFOS等长碳链全氟磺酸化合物在环境和生物体内具有不分解性和高蓄积性,因此易于随食物链的传递在生物机体内富集和放大至相当高的浓度,OSPAR(Oslo-Paris Commission,保护东北大西洋海洋环境公约)指出PFOS在全鱼中的生物富集因子高达2 796[4]。目前在许多动物组织和人体中发现了PFOS的存在[5-7]。全氟磺酸类物质已经成为备受关注的一类重要的全球性污染物,PFOS甚至被列入《斯德哥尔摩公约》新一批持久性有机污染物(PO Ps)名单中[8]。贝类作为人类膳食的一个重要来源,其可食用部分主要是软组织部分。对于贝类等生物体的软组织中全氟化合物的分析方法已经有较多研究。作为一种典型的生物矿物质,贝类壳体作为动物饲料和宠物食品中的钙添加剂被广泛使用,甚至有时贝壳粉也被用作人类药物和保健品的生物钙源。因此贝壳中的污染物,也有很大机会进入人类食物链,甚至直接被人体摄入。然而,对于贝类壳体这类生物“硬组织”中全氟化合物分析方法的研究,目前尚未见报道。 本研究建立了混合无机酸消解-固相萃取(SPE)法提取贝类壳体中全氟磺酸类化合物的前处理方法,并采用高效液相色谱-串联质谱联用仪(HPLC-MS/MS)对海洋贝类壳体中的全氟磺酸类化合物进行了分析。 Waters2695Separations Module高效液相色谱仪及Quattro Micro API三重四极杆串联质谱仪(Waters Corporation,Milfor,MS,USA)。Oasis WAX SPE小柱(6mL/150m g,Waters Corporation,Milfor,MS,USA)。 全氟丁烷磺酸(perfluorobutane sulfonate,PFBS,98%(纯度)),全氟己烷磺酸(perfluorohexane sulfonate,PFHxS,98%(纯度))和全氟辛烷磺酸(perfluorooctane sulfonates,PFOS,99%(纯度))均购自Sigm a-Aldrich Chemical,St Louis,MO,USA。内标物13C4-标记的PFOS钠盐(sodium perfluoro-1-[1,2,3,4-13C4]octanesulfonate,13C4-PFOS,>98%)购自W ellington Laboratories,Guelph,Ontario,Canada)。实验中使用的甲基叔丁基醚(m ethyl tert-butyl ether,M TBE)、丙酮、甲醇、乙酸和醋酸铵均为色谱纯试剂。 提取方法的建立和优化使用从某贝壳粉加工厂购得的天然贝壳粉,该贝壳粉原料为产自渤海湾的牡蛎壳和蛤壳。 验证提取方法所采用2种实际贝类样品分别为采自渤海湾的花蛤(clam,Variegate venus)和缢蛏(razor clam,Solen strictus),其壳体和软组织分别经过清洗、冻干后,研磨成粉备用。 为了消除生物矿物结构对贝壳中全氟磺酸化合物提取效果的影响,实验中采用混合无机酸消解[9]结合SPE法作为贝壳粉的前处理方法。向5.0g贝壳粉中加入5mL50%(质量分数)HNO3和10mL 20%(质量分数)HC l,置于250mL聚丙烯烧杯中超声混合2h。此后用超纯水稀释至100mL,并用N aOH溶液调pH至6。提取液过0.45μm尼龙滤膜过滤,并采用2mL甲醇对滤膜上残留物进行冲洗,将洗液并入提取液中。在每份提取液中分别加入5ng内标物质13C4-PFOS。提取液用Oasis WAX SPE小柱进行富集处理。 SPE柱依次使用4mL含0.1%醋酸铵的甲醇溶液和4mL超纯水进行活化,之后使水样以1滴/s流速通过SPE柱,在此过程中避免SPE柱干燥,之后加入4mL25mmol/L醋酸缓冲溶液(pH 4)进行淋洗,并抽真空20m in以使SPE柱干燥。SPE柱用4mL含0.1%醋酸铵的甲醇溶液洗脱,洗脱液置于15mL聚丙烯(PP)离心管中,氮吹并采用甲醇定容到1mL,经0.22μm尼龙滤头过滤后转移至自动进样瓶中。 同时,实验中还采用有机溶剂甲醇、丙酮和M TBE对贝壳粉中的全氟磺酸化合物进行了直接提取,即用10和5mL有机溶剂分两次对5.0g贝壳粉进行12h提取,并将提取液合并浓缩,将其提取结果与酸消解-SPE的提取结果进行比较。 此外,研究还参照Taniyasu等[10]的提取方法,采用M TB E提取结合SPE的方法对贝类软组织中的全氟磺酸化合物的浓度进行了分析。向1.0g软组织样品中加入10mL M TBE(含5ng13C4-PFOS),在30℃下超声提取2h,离心移出上清液后再使用5mL M TB E重复提取过程,将合并的上清液氮吹至干后用2mL甲醇重新溶解,再用超纯水稀释至100mL,经0.45μm尼龙滤膜过滤后使用与贝壳粉相同的方法进行SPE富集。 上述提取实验中,所有样品均设置3组平行。 采用X-Terra MS C18色谱柱(150mm×2.1 mm,5μm,Waters Corporation,Milfor,MS,USA)对3种全氟磺酸化合物进行分离。流动相A为含2.5mmol/L醋酸铵的甲醇,B为2.5mmol/L醋酸铵水溶液,梯度洗脱,流速为0.25mL/m in,柱温40℃,进样量20μL。梯度洗脱条件为:流动相A的比例在0.8m in内由10%提高至60%,并在12.8m in时升到100%,在14.3m in时重新回到起始条件,并在此条件下重新平衡色谱柱8m in。 目标物离子化采用电喷雾离子化源(ESI)在负离子模式下进行。毛细管电压3.25kV,萃取锥孔电压3V,RF透镜电压0.5V,离子源温度100℃,去溶剂温度300℃;去溶剂气流速600L/h,锥孔气流速20L/h。采用多反应监测模式(MRM),目标物母离子/子离子质荷比分别选用299/80(PFBS)、399/80(PFHxS)、499/80(PFOS)和503/80(13C4-PFOS)。锥孔电压分别为40V(PFBS)、45V(PFHxS)、55V(PFOS)和55V(13C4-PFOS),碰撞能分别为30eV(PFBS)、39eV(PFHxS)、45eV(PFOS)和45eV(13C4-PFOS)。 全氟磺酸化合物的定量采用内标法进行,将混合标准溶液(13C4-PFOS内标和3种全氟磺酸化合物的浓度均为5ng/mL)20μL进样分析以确定校正因子,根据样品提取液中13C4-PFOS和目标化合物的响应值对3种目标全氟磺酸化合物定量。 实验所用器皿均为PP材质或石英材质容器。实验用到的15mL和50mL的螺口PP离心管(CNW Technologies Gm bH,Düsseldorf,Germ an)在使用前加入M TB E或甲醇,振荡24h以去除PP管中可能含有的可溶于目标溶剂的物质。250mL的石英烧杯使用前在硝酸溶液中浸泡8h。 对于生物样品(血浆和生物软组织等)和环境样品(水和沉积物等)中的全氟化合物,通常采用有机溶剂进行提取[11-13]。然而作为生物“硬组织”的贝壳在生长过程中,生物矿化作用不断发生,新生的矿物质(主要为碳酸钙)可能使已附着或沉积在壳体上的污染物被“锁定”在其微小矿化结构内,使之难以释放。因此单纯采用有机溶剂提取可能无法充分提取贝壳矿物结构中存在的污染物。本研究采用混合无机酸对贝壳粉进行消解,并通过SPE对消解液中的目标物进行净化富集,此方法能够对商品贝壳粉中3种目标物质进行有效的提取(见图1),其含量分别为0.71ng/g(PFBS)、0.92ng/g(PFHxS)和1.71ng/g(PFOS)。而在采用M TBE、丙酮、甲醇3种有机溶剂对贝壳粉直接提取时,浓缩提取液中目标物浓度均低于仪器检出限。采用有机溶剂提取后,5g贝壳粉的残留物质量为4.76~4.95 g,贝壳中的碳酸盐晶体并未消解,这可能令“锁定”于贝壳矿物结构中的目标污染物无法被有效提取;而采用混合无机酸消解可以破坏贝壳的矿物结构,因此无机酸消解结合SPE的方法是提取贝壳粉中全氟磺酸化合物的更有效方法。 图1 酸消解-SPE法提取贝壳粉中3种全氟磺酸化合物的HPLC-M S/M S色谱图Fig.1 HPLC-M S/M Schromatograms of3perfluoro sulfonated chemicals in she ll powde rextracted by mixed inorganic acid digestion coup led with solid phase ex traction(SPE) 为检验混合无机酸消解结合SPE的方法对3种全氟磺酸类物质提取的回收率,在贝壳粉样品中加入了PFBS、PFHxS、PFOS以及13C4-PFOS标准物质以进行加标回收实验,各物质的加标量均为2 ng/g。结果表明,该提取方法对3种全氟磺酸类物质的加标回收率分别为PFBS(94.88±2.88)%、PFHxS(96.24±6.30)%和PFOS(95.21±3.42)%(n=3)。 分别配制不同浓度的3种全氟磺酸化合物的标准溶液,加入贝壳粉中,按实验部分所述方法进行前处理、分析,以信噪比为3时所对应的全氟磺酸含量为检出限。混合酸消解-SPE-LC-MS/MS分析方法对贝壳中3种全氟磺酸化合物的检出限分别为0.28(PFBS)、0.42(PFHxS)和0.43ng/g(PFOS)。 采用酸消解与SPE结合的提取方法,分别对两种实际贝类样品(采集自渤海湾的缢蛏和花蛤)壳体中的3种全氟磺酸化合物进行了分析。在两种样品中,均检出了PFOS;同时,在缢蛏壳与花蛤壳中,还分别检出了PFHxS和PFBS(见表1)。同时,对两种贝类软组织中的目标污染物的检测结果表明,软组织中全氟磺酸化合物的含量分别为1.13~9.02ng/g(缢蛏)和2.16~12.24ng/g(花蛤)。全氟磺酸化合物在贝类壳体中的含量水平比其在软组织中低约1个数量级。然而,研究中并未观察到污染物在贝类壳体与软组织中的含量之间存在显著的相关关系。例如,在花蛤软组织中PFHxS的浓度高达12.24ng/g,但在花蛤壳体中PFHxS的浓度则低于检出限。这种差异可能是由贝类软组织和壳体对环境污染物的富集行为差异所导致的。由于贝类壳体中的污染物是伴随着壳体生物矿化而进入贝壳中,因此壳体中的污染物浓度可能反映了贝类生长周期内环境中的平均污染水平。 表1 渤海湾2种贝类壳体及软组织中全氟磺酸化合物的含量*Table1 Contents of perfluo rosulfonated chemicals in shells and soft tissues of Solens trictus and Variegatevenus from Bohai Bay*ng/g 本文建立了贝类壳体中全氟磺酸类物质的混合无机酸消解-SPE提取的前处理方法,并将其成功应用于渤海湾实际贝类壳体样品的检测。研究结果表明,渤海湾贝壳中存在一定浓度的全氟磺酸化合物,混合酸消解-SPE提取是检测贝类壳体中此类污染物的有效前处理方法。 致谢 参加南开大学“国家大学生创新性实验计划”项目的杨璐榕、何川等同学为本研究的样品采集工作作出了贡献,在此对他们的工作表示感谢。 [1] Ran X R,Zhang Z X,Zhang Z X.Environmental Chemistry(冉小蓉,张政祥,张之旭.环境化学),2009,28(3):459 [2] Ahrens L,Xie Z Y,Ebinghaus R,et al.Chem osphere,2010,78(8):1011 [3] M ak Y L,Taniyasu S,Yeung L W Y,et al.Environ Sci Technol,2009,43(13):4824 [4] Zhou Q,Zhang M C,Lu Y F,et al.Environmental Science and Technology(周庆,张满成,卢宇飞,等.环境科学与技术),2008,31(7):44 [5] Kannan K,Corsolini S,Falandysz J,et al.Environ Sci Technol,2002,36(15):3210 [6] O lsen G W,Church T R,M iller J P,et al.Environ Health Persp,2003,111(16):1892 [7] Kannan K,Corsolini S,Falandysz J,et al.Environ Sci Technol,2004,38(17):4489 [8] Shi YL,Pan Y Y,Wang J M,et al.Progress in Chemistry(史亚利,潘媛媛,王杰明,等.化学进展),2009,21(2/3):369 [9] Díaz J,Higuera-Ruiz R,Elorza J,et al.Chem osphere,2007,67(3):623 [10] Taniyasu S,Kannan K,So M K,et al.J Chromatogr A,2005,1093(1/2):89 [11] Dai J Y,LiM,J in Y H,et al.Environ Sci Technol,2006,40(18):5647 [12] D reyer A,Weinberg I,Temm e C,et al.Environ Sci Technol,2009,43(17):6507 [13] Verreault J,Houde M,Gabrielsen G W,et al.Environ Sci Technol,2005,39(19):7439 Determination of three perfluoro sulfonated chemicals in bivalve shells using high perform anceliquid chromatography-tandem mass spectrometry with the pretreatment of mixed inorganic Y ANG J in,WANG Lei*,CHEN Chen,ZHANG Jiao,SUN Hongwen O658 A 1000-8713(2010)05-0503-04 *通讯联系人:汪 磊,博士,副教授,主要研究方向为环境化学.Tel:(022)23504821,E-m ail:w ang2007@nankai.edu.cn. 国家自然科学基金项目(Nos.20807024,20877043)和教育部博士点新教师基金项目(No.200800551051). 2010-01-14 DO I:10.3724/SP.J.1123.2010.005031 实验部分
1.1 仪器与试剂
1.2 实验样品
1.3 提取方法
1.4 色谱与质谱条件
1.5 实验室污染消除
2 结果和讨论
2.1 商品贝壳粉样品的酸消解-SPE提取
2.2 回收率和检出限
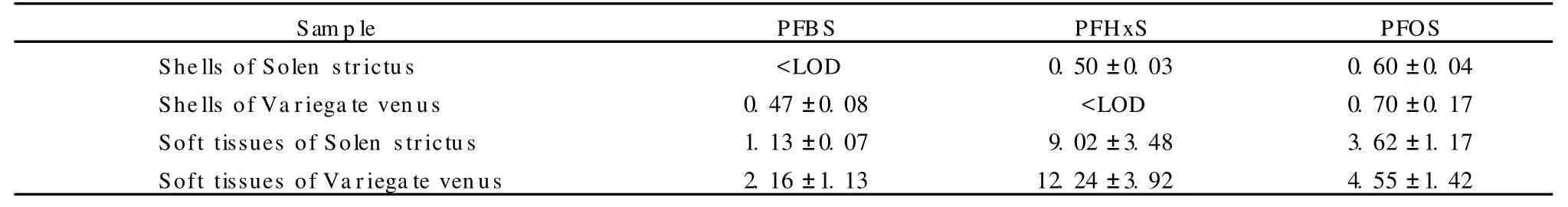
2.3 2种贝类壳体中的全氟磺酸类物质检测
3 结论
acid digestion coupled with solid-phaseex traction
(Key Laboratory of Pollution Processes and Environmental Criteria(Nanka i University),Ministry of Education,Tian jin 300071,China)

