白藜芦醇固体脂质体制备工艺研究
乐文慧,黄早成,肖苏尧,曹 庸*
(华南农业大学食品学院,广东 广州 510640)
白藜芦醇固体脂质体制备工艺研究
乐文慧,黄早成,肖苏尧,曹 庸*
(华南农业大学食品学院,广东 广州 510640)
采用乙醇注入法制备白藜芦醇脂质体,用冷冻干燥技术制备固体脂质体。以包封率为考察指标,对芯材与壁材的配比、乳化剂的种类和用量、冻干保护剂甘露醇使用量、油水相之比分别进行单因素考察。结果表明:最优制备工艺条件为m(卵磷脂):m(胆固醇):m(白藜芦醇)=10:2:1、乳化剂Tween 80、乳化剂用量0.2%(m/m)、冻干保护剂甘露醇使用量2%(m/m)、油水相体积比为1:10。最优工艺制得的白藜芦醇固体脂质体的包封率为84.68%,采用乙醇注入法可制得包封率高的白藜芦醇固体脂质体,且方法简便易行。
白藜芦醇;固体脂质体;制备工艺;乙醇注入法
Abstract:Resveratrol liposomes were prepared using ethanol injection method and solid resveratrol liposomes were obtained after lyophilization. The effects of core material-to-wall material ratio, emulsifier type and amount, amount of mannitol as a cryoprotectant, oil phase-to-water phase ratio on entrapment efficiency were investigated in single factor experiments. The optimal preparation conditions of resveratrol liposome were as follows:lecithin-to-cholesterol-to-resveratrol ratio 10:2:1,amount of Tween-80 used as emulsifier 0.2%, amount of mannitol 2%, and oil phase-to-water phase ratio 1:10.The entrapment efficiency of solid resveratrol liposomes prepared under these optimum conditions was 84.68%. Therefore, ethanol injection method for preparing resveratrol liposome can provide higher entrapment efficiency and feasibility.
Key words:esveratrol;solid liposome;preparation condition;ethanol injection method
近年来,国外学者对白藜芦醇的生物学功能进行了深入研究,研究结果均表明白藜芦醇活性显著,高效低毒,是一类很有前景的抗氧化类药物,对心血管具有双向调节作用,能改善微循环,具有显著的抗炎、抗突变、抗氧化、抗自由基以及抑制血小板聚集的作用,具有预防动脉硬化、防止冠心病、降低血清和肝脏的脂质、保护肝脏以及抗癌等多方面的活性[1-4]。
白藜芦醇在光、热和氧化剂的作用下容易被氧化降解[5],在一定程度上限制了其在医药和食品等行业的应用。脂质体作为药物和功能性成分的载体,是一种较新的微胶囊化技术,具有有效保护被包裹药物和功能性成分、防止被包裹药物和功能性成分被氧化、提高其稳定性和生物利用度、并具有靶向性、生物可降解、无免疫抑制作用等优点[6-8]。脂质体大都应用于化妆品和医药领域中,而近年来脂质体在食品中应用已经成为研究热点[9-12],并且显示出巨大的应用潜力[13]。
白藜芦醇脂质体的研究报道较少,主要集中于医药领域的应用研究[14],关于制备工艺的研究较少。本实验为增加白藜芦醇的水溶性和稳定性,采用乙醇注入法制备白藜芦醇固体脂质体,以白藜芦醇的包封率为考察指标,对影响固体脂质体包封率的主要工艺参数进行优化。
1 材料与方法
1.1 材料与试剂
白藜芦醇(纯度为98%) 湖南省林产化工工程重点实验室;大豆卵磷脂 广州威佳科技有限公司;胆固醇上海聚源生物科技有限公司。
无水乙醇、乙酸乙酯、甲醇、乙醚、β-环糊精、甘露醇、Tween 60、Tween 80、三氯甲烷、磷酸二氢钠、磷酸氢二钠、蔗糖、葡萄糖、正己烷、环己烷等(均为分析纯);乙腈(色谱纯)。
1.2 仪器与设备
LC-10ATVP plus高效液相色谱仪 日本岛津公司;Diamonsil C18色谱柱(200mm×4.6mm,5μm) 迪马公司;HJ-6磁力搅拌器 巩义市予华仪器有限责任公司;KQ-500B型超声波清洗器 昆山市超声仪器有限公司;FD-1PF冷冻干燥机 北京德天佑科技发展有限公司;5417R高速离心机 德国Eppendorf公司。
1.3 脂质体白藜芦醇含量测定方法
采用色谱柱为C18柱,流动相为V(乙腈):V(水)=43:57,流速为lmL/min,柱温为室温(25℃),检测波长为306nm,进样量为20μL。精确称取白藜芦醇5.0mg,用甲醇溶解为0.5mg/mL的储备液,移取储备液,分别用甲醇稀释成质量浓度为20、40、60、80、100μg/mL的白藜芦醇甲醇溶液,进样20μL,以峰面积x对质量浓度y作线性回归方程为y=0.1383x+0.158(R2=0.9985),在白藜芦醇质量浓度为20~100μg/mL之间具有良好的线性关系,平均回收率为97.68%,RSD为1.05%(n=5)。
1.4 包封率测定方法
白藜芦醇总量(m总/mg)测定:精密称取制备好的白藜芦醇固体脂质体100mg,用乙醚及乙醇混合液(2:1,V/V)通过加热、超声破壁使白藜芦醇游离出来,50℃挥发乙醚,甲醇定容至10mL,静置取清液1mL再用甲醇定容至10mL。按1.3节方法检测白藜芦醇总量。
游离白藜芦醇量(m游离/mg)测定:精密称取制备好的白藜芦醇固体脂质体50mg,加入5mL丙酮,12000r/min离心30min,将脂质体中游离白藜芦醇分离出来,取1mL清液用甲醇定容至10mL。按1.3节方法检测游离白藜芦醇量。按下式计算包封率:

1.5 固体脂质体制备方法优化
白藜芦醇固体脂质体的制备工艺流程:称取一定量的磷脂、胆固醇及白藜芦醇→加入适量的无水乙醇与乙醚(1:2,V/V)中→水浴至溶液澄清(40~50℃)→用注射器快速将其注入含有甘露醇及乳化剂的30mL水相中→300~400r/min搅拌5min→减压挥发除去有机溶剂→避光冷冻干燥→白藜芦醇固体脂质体。
1.5.1 壁材的优化
以白藜芦醇:卵磷脂质量比为1:6为条件制备白藜芦醇固体脂质体,考察壁材比[m(卵磷脂):m(胆固醇)]分别为4:1、5:1、6:1、8:1和10:1,考察芯材与壁材比[m(白藜芦醇):m(卵磷脂):m(胆固醇)]分别为1:10:1.25、1:10:1.667、1:10:2、1:8:2、1:16:2和1:20:2。
1.5.2 乳化剂的选择
称取0.8mg卵磷脂、0.16mg胆固醇和0.1mg白藜芦醇溶解于2mL乙醇与4mL乙醚的混合溶剂中,分别快速注入含有Tween 60或Tween 80及含质量分数2%甘露醇的30mL水相中,300~400r/min搅拌5min,35℃条件下减压去除有机溶剂,冷冻干燥,其水相中Tween 60或Tween 80的质量分数分别为0.2%、0.4%、0.5%。
1.5.3 冻干保护剂甘露醇使用量
称取0.8mg卵磷脂、0.16mg胆固醇和0.1mg白藜芦醇溶解于2mL乙醇与4mL乙醚的混合溶剂中,分别快速注入含有甘露醇的水相中,300~400r/min搅拌5min,35℃条件下减压去除有机溶剂,冷冻干燥,其水相中甘露醇的质量分数分别为1%、2%、3%、4%。
1.5.4 油水相体积比对包封率的影响
采用0.8mg卵磷脂、0.16mg胆固醇和0.1mg白藜芦醇,质量分数为4%的甘露醇,质量分数为0.2%的Tween 60为条件制备白藜芦醇固体脂质体,考察油水相之比对包封率的影响,选择油水相体积比分别为1:5、1:10、1:30。
1.5.5 正交试验确定白藜芦醇脂质体配方
在单因素初步试验的基础上,进行正交试验设计确定白藜芦醇脂质体配方。
2 结果与分析
2.1 壁材的优化
胆固醇对于脂质体起着膜流动性调节作用,可使相变温度以下处于固态的磷脂转变为液晶态防止类脂链结晶化,提高包封率,对考察壁材比的样品进行包封率的测定,结果如图1所示。从图1可以看出,在m(卵磷脂):m(胆固醇)对包封率的影响较小,在5:1~10:1的范围内包封率较高。

图1 卵磷脂与胆固醇质量比对包封率的影响Fig.1 Effect of lecithin-to-cholesterol ratio on the entrapment efficiency of solid resveratrol liposomes
芯材与壁材的配比是决定脂质体的包封率的关键因素,芯材过多,超出磷脂的承载能力,则无法形成包封率较高的脂质体;磷脂过多,脂质体所包含的有效成分降低。对考察芯材与壁材比的样品进行包封率测定,结果如图2、3所示。由图2、3可以看出,m(白藜芦醇):m(卵磷脂):m(胆固醇)=1:10:2时包封率相对较高,故选定芯壁材比为m(白藜芦醇):m(卵磷脂):m(胆固醇)=1:10:2。
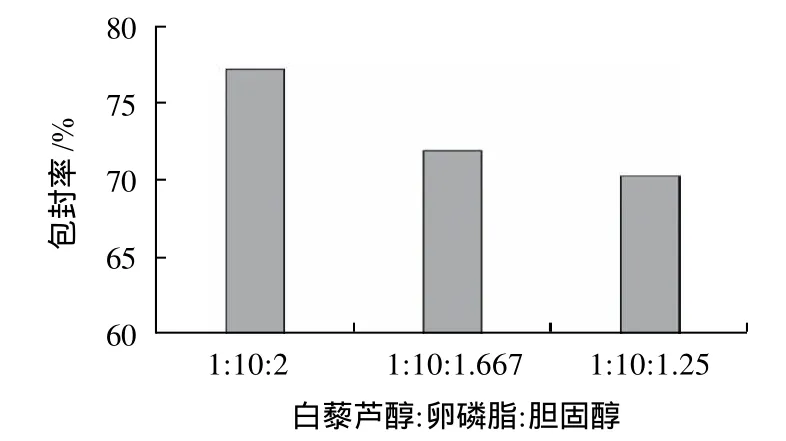
图2 胆固醇含量对包封率的影响Fig.2 Effect of cholesterol amount on the entrapment efficiency of solid resveratrol liposomes
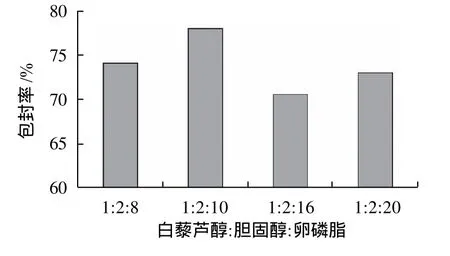
图3 卵磷脂含量对包封率的影响Fig.3 Effect of lecithin amount on the entrapment efficiency of solid resveratrol liposomes
2.2 乳化剂的选择
非离子型乳化剂是一种较为安全的乳化剂,在配方中加入适量比例的非离子型乳化剂,可以增加脂溶性成分的溶解度,提高脂质体的包封率。不同乳化剂实验结果如图4所示。从图4可以看出,用0.2% Tween 80作乳化剂的样品测得包封率最高,所以选用0.2%的Tween 80作乳化剂。
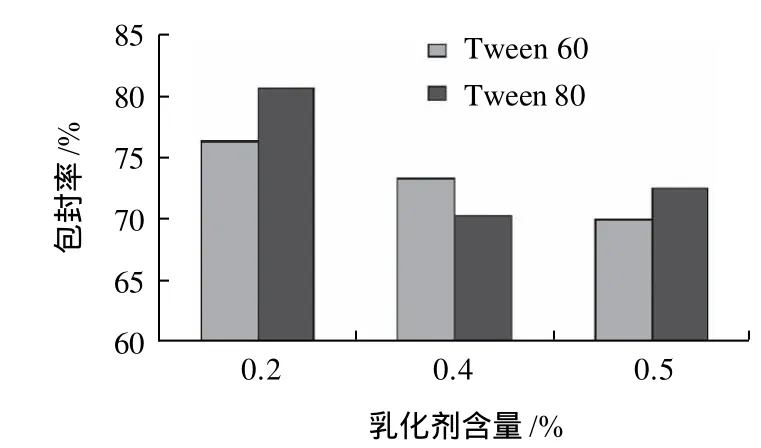
图4 乳化剂含量对包封率的影响Fig.4 Effects of emulsifier type and amount on the entrapment efficiency of solid resveratrol liposomes
2.3 冻干保护剂甘露醇使用量的考察结果
冻干保护剂可以防止脂质体在冷冻干燥过程中活性成分白藜芦醇的渗漏,保持脂质体的颗粒形态,防止脂质体表面在冻干过程中产生皱缩现象。通过预实验比较了甘露醇、蔗糖、葡萄糖、β-环糊精作为冻干保护剂的效果,结果显示用甘露醇作冻干保护剂外观效果较好,所以进一步考察甘露醇的用量。由图5可知,甘露醇用量为2%时包封率最高,所以选择2%的甘露醇作冻干保护剂。

图5 甘露醇用量对包封率的影响Fig.5 Effect of mannitol amount on the entrapment efficiency of solid resveratrol liposomes
2.4 考察油水相体积比

图6 油相和水相体积比对包封率的影响Fig.6 Effect of oil phase-to-water phase ratio on the entrapment efficiency of solid resveratrol liposomes
由图6可知,油水相体积比为1:10和1:30时包埋率均较高,分别为75.8%和76.4%,相差不大,从冻干的角度来考虑,水相用量过大冻干时间长、能耗高,因而选择1:10的油水相比。
2.5 正交试验设计确定白藜芦醇脂质体配方

表1 L16(45)正交试验因素和水平Table 1 Factors and levels in the orthogonal array design
根据制备白藜芦醇脂质体的单因素试验分析,影响白藜芦醇脂质体包封率主要因素有卵磷脂与白藜芦醇质量比、胆固醇与白藜芦醇质量比、乳化剂Tween 80的用量、冻干保护剂甘露醇的用量以及油水相体积比。在单因素试验基础上进行L16(45)正交试验以确定白藜芦醇脂质体最优制备条件。正交试验因素水平见表1。
以白藜芦醇脂质体包封率为指标的正交试验结果及分析见表2。
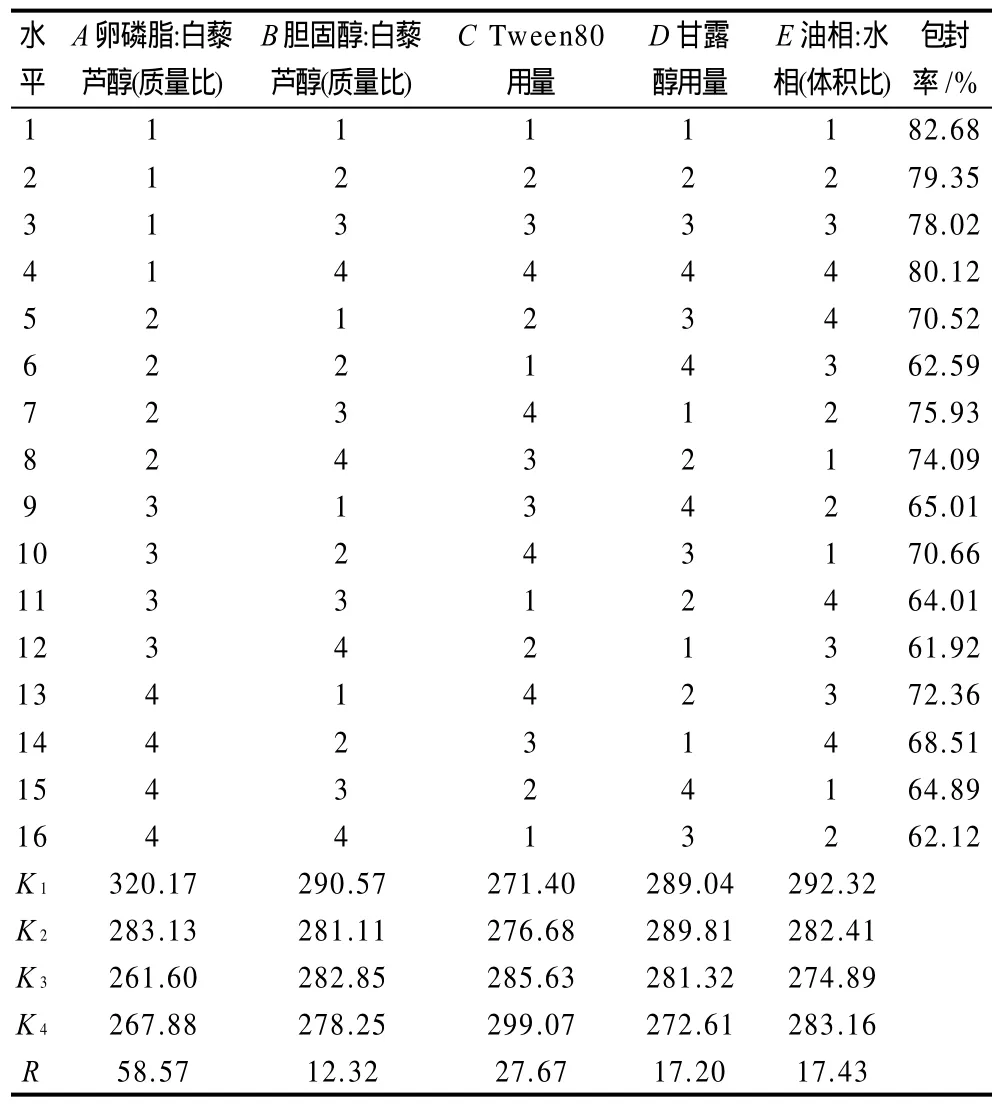
表2 L16(45)正交试验的因素和水平Table 2 Orthogonal array design matrix and experimental results
从表2可看出,采用乙醇注入法制备白藜芦醇脂质体的最优配比为A1B1C4D2E1,即卵磷脂:白藜芦醇(质量比)10:1、胆固醇:白藜芦醇(质量比)2:1、Tween 80用量0.2%、甘露醇用量2%、油相:水相(体积比)1:10。因素对包封率的影响由主到次依次为A>C>E>D>B。在A1B1C4D2E1条件下做验证实验,包封率均值为84.68%,证明正交试验结果可信。
3 结 论
脂质体的分离是测定包封率的关键步骤,目前常用的分离方法有透析法、离心法和凝胶过滤法。本实验采用离心法测包封率,测定方法更为简便,结果较准确。
白藜芦醇固体脂质体最优制备条件为1.0mg卵磷脂、0.2mg胆固醇和0.1mg白藜芦醇溶解于1mL乙醇与2mL乙醚混合溶剂中,加热溶解温度40℃。快速注入到含2%甘露醇和0.2% Tween 80的30mL蒸馏水水相中,300~400r/min搅拌5min,减压挥发除去溶剂,避光冷冻干燥得固体脂质体,包封率为84.68%。固体脂质体提高了白藜芦醇的稳定性和溶解度。
[1] 赵霞, 陆阳, 陈泽乃. 白藜芦醇的化学药理研究进展[J]. 中草药, 1998,29(12):837-839.
[2] 张兰胜, 刘光明. 白藜芦醇的研究概述[J]. 大理学院学报, 2007, 6(4):72-74.
[3] 冯永红, 许实波. 白藜芦醇药理作用研究进展[J]. 国外医药:植物药分册, 1996, 11(4):155-157.
[4] 黎永胜, 文军. 白藜芦醇的药理作用研究进展[J]. 医学综述, 2008,14(3):469-471.
[5] 陈易彬, 陈奎. 白藜芦醇提取工艺的研究[J]. 食品科学, 2007, 28(12):197-199.
[6] 姜殿君, 王俊平, 赵丽妮. 抗癌药物脂质体及其研究进展[J]. 中国现代医药杂志, 2007, 9(4):152-154.
[8] WESTHAUS E, MESSERSMITH P B. Triggered release of calcium from lipid vesicles:a bioinspired strategy for rapid gelation of polysaccharide and protein hydrogels[J]. Biomaterials, 2001, 22:453-462.
[9] CHANG Hungmin, LEE Yangchun, CHEN Chaocheng, et al. Microencapsulation protects immunoglobulin in Yolk (IgY) specific againstHelicobacter pylori urease[J]. Journal of Food Science, 2002, 67(1):15-20.
[10] 范远景, 张必芳, 刘艳. 番茄红素纳米脂质体的制备研究[J]. 食品科学, 2008, 29(12):238-241.
[11] 任文霞, 李建科. 茶多酚脂质体的制备[J]. 食品工业科技, 2008, 29(11):186-191.
[12] 夏书芹, 许时婴, 张晓鸣. 辅酶Q10纳米脂质体配方与工艺优化研究[J]. 食品科学, 2007, 28(3):112-117.
[13] 王瑞莲, 刘成梅, 刘伟脂. 质体在食品工业中的应用前景[J]. 江西食品工业, 2007(2):44-45.
[14] 王新春, 侯世祥, 李文, 等. 白藜芦醇脂质体体外释药和大鼠小肠吸收特性的研究[J]. 中国中药杂志, 2007, 32(11):1084-1088.
Preparation of Solid Resveratrol Liposomes
YUE Wen-hui,HUANG Zao-cheng,XIAO Su-yao,CAO Yong*
(College of Food Science, South China Agricultural University, Guangzhou 510640, China)
TS202.3
A
1002-6630(2010)18-0059-04
2009-10-08
乐文慧(1984—),女,硕士研究生,主要从事食品工程研究。E-mail:973966526@qq.com
*通信作者:曹庸(1966—),男,教授,博士,主要从事天然活性物分离及活性研究。E-mail:caoyong2181@scau.edu.cn

