外界因素对重组Enterocin A抗菌活性的影响
赵爱珍,徐兴然,韩文瑜
(1.西南大学药学院,重庆 400715;2.吉林大学畜牧兽医学院,吉林 长春 130062)
外界因素对重组Enterocin A抗菌活性的影响
赵爱珍1,徐兴然1,韩文瑜2
(1.西南大学药学院,重庆 400715;2.吉林大学畜牧兽医学院,吉林 长春 130062)
探讨蛋白酶、还原剂、温度、pH值4个外界因素对Enterocin A抗菌活性的影响。对重组Enterocin A进行不同处理后,采用琼脂孔扩散实验、琼脂点种实验或者平板菌落计数法检测样品的抗李斯特菌活性。结果表明:重组Enterocin A的蛋白酶消化产物的抗菌活性丧失,其β-巯基乙醇还原产物的抗菌活性也丧失;重组Enterocin A表现较高的热稳定性,100℃处理10min后仍可以检测到抗菌活性;该重组细菌素在pH2.0~8.0条件下均保持抗菌活性。
重组Enterocin A;抗李斯特菌活性;外界因素
Abstract:With and without sole exposures to proteases (trypsin and protease K), reductant (2-mercaptoethanol), temperature and pH, recombinant Enterocin A was tested for its anti-ListeriaLIN 3 activity by agar diffusion, agar spot or plate count methods in order to figure out the effects of these external factors on this biological activity. Due to protease hydrolysis, recombinant Enterocin A thoroughly lost its anti-ListeriaLIN 3 activity. The presence ofβ-mercaptoethanol also resulted in a near-complete loss of its anti-ListeriaLIN 3 activity. Recombinant Enterocin A presented high thermal stability. In spite of heating for 10 min at 100 ℃, its anti-ListeriaLIN 3 activity could still be detected. Recombinant Enterocin A could maintain anti-ListeriaLIN 3 activity in the pH range from 2.0 to 8.0.
Key words:recombinant Enterocin A;anti-ListeriaLIN 3 activity;external factors
Enterocin A是屎肠球菌产生的细菌素之一,表现抗单核细胞增生李斯特菌等多种李斯特菌及一些乳酸菌的活性,具有作为食品添加剂的内在条件[1-3]。除抗菌活性,稳定性也是细菌素作为食品添加剂所需要的条件之一。天然细菌素产生量少且获得过程比较复杂,不利于对其进行广泛而深入的研究。利用细菌素的多肽特性,研究人员已通过大肠杆菌表达系统获得了一些具有生物学活性的重组细菌素[4-5]。本课题组也成功利用大肠杆菌表达系统融合表达Enterocin A,而且所获得的重组Enterocin A具有抗李斯特菌活性[6]。该重组Enterocin A不仅比较容易获得,而且结构与抗菌活性均接近天然Enterocin A。本研究拟探讨蛋白酶、还原剂、温度、pH值4个外界因素对该重组Enterocin A抗菌活性的影响,为Enterocin A在食品中的合理应用提供参考。
1 材料与方法
1.1 材料、试剂、菌种与培养基
重组Enterocin A纯化样品(pH6.5) 本课题组制备[6];胰蛋白酶、蛋白酶K、β-巯基乙醇(β-ME) 上海生工生物工程技术服务有限公司。
无害李斯特菌LIN3(指示菌) 本实验室保存。
胰蛋白胨大豆肉汤培养基(TSB)、胰蛋白胨大豆琼脂培养基(TSA)按照常规方法配制。
1.2 仪器与设备
HH-6数控恒温水浴锅 常州国华电器有限公司;DHP-9052电热恒温培养箱 上海齐欣科学仪器有限公司;PHS-3C型pH计 上海精密科学仪器有限公司;CF16RX型高速冷冻离心机 日本日立公司。
1.3 样品处理
1.3.1 蛋白酶消化
用1mol/L NaOH溶液将重组Enterocin A样品由pH6.5调整为pH7.0,分别加入胰蛋白酶、蛋白酶K至终质量浓度为0.5mg/mL,37℃水浴2~4h,同时以未经酶处理的样品作为对照。
1.3.2 β-巯基乙醇处理
将重组Enterocin A样品分为两份,每份1mL:一份加入β-巯基乙醇至终浓度为50mmol/L,另一份不加β-巯基乙醇,37℃水浴10min。LB培养基作为阴性对照进行同样的处理。4份样品分别加入1mL无害李斯特氏菌LIN3悬浮液(约600CFU/mL),25℃培养1h后,6000r/min、4℃离心10min,将菌体重新悬浮于PBS缓冲液(pH7.0)中。每份样品设定3个重复实验。
1.3.3 热处理
将重组Enterocin A样品在不同的温度(60、80℃和100℃)分别水浴10、30min和60min,立即将热处理样品冰浴,同时以未处理的样品作为对照。
1.3.4 pH值调整
用1mol/L NaOH溶液或者1mol/L HCl溶液调整重组Enterocin A样品的pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0,同时以相同pH值的PBS缓冲液作为对照。
1.4 抗菌活性检测
通过琼脂孔扩散实验[7]检测蛋白酶消化样品的抗李斯特菌活性;通过琼脂点种实验[8]测定重组Enterocin A的细菌素活性、热处理样品或者不同pH值样品的抗菌活性;通过平板菌落计数法测定培养物中的活菌数[9]。
2 结果与分析
2.1 重组Enterocin A的活性定量

图1 重组Enterocin A的活性测定Fig.1 Anti-ListeriaLIN 3 activity of serial binary dilutions of recombinant Enterocin A
以无害李斯特氏菌LIN3作为指示菌,重组Enterocin A纯化样品的细菌素活性测定结果见图1。1个细菌素单位(BU)定义为点种10μL稀释样品后能够形成直径至少为2mm的明显抗菌圈的最高稀释度的倒数,样品的细菌素活性=(1/稀释度)×100,单位为BU/mL。由图1可知,稀释度为1/24的样品能够形成明显抗菌圈,则重组Enterocin A样品的细菌素活性为1600BU/mL。
2.2 蛋白酶对重组Enterocin A抗菌活性的影响
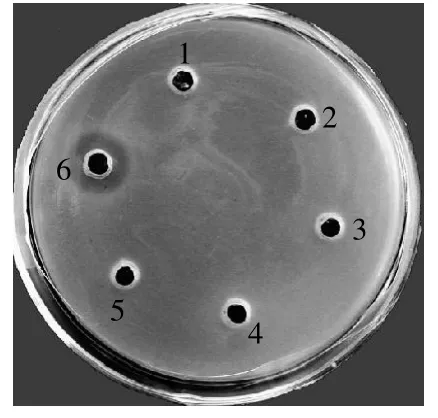
图2 蛋白酶对重组Enterocin A抗菌活性的影响Fig.2 Effects of proteases on anti-ListeriaLIN 3 activity of recombinant Enterocin A
经胰蛋白酶、蛋白酶K处理2h后,重组Enterocin A的抗菌活性丧失,而未处理样品的抗菌活性保持不变(图2)。多肽特性决定了细菌素的蛋白酶敏感性,天然Enterocin A表现对多种蛋白酶例如α-胰凝乳蛋白酶、胃蛋白酶和蛋白酶K敏感[10]。由图2可知,重组Enterocin A对胰蛋白酶、蛋白酶K敏感。
2.3 β-巯基乙醇对重组Enterocin A抗菌活性的影响

表1 β-巯基乙醇对重组Enterocin A抗菌活性的影响Table 1 Effect ofβ-ME on anti-ListeriaLIN 3 activity of recombinant Enterocin A
由表1可知,在对照组中,含有LB或者LB+β-ME的培养物中指示菌活菌数不变或者稍微升高,表明实验浓度的β-巯基乙醇对指示菌不表现抑制作用。在实验组中,含有重组Enterocin A的培养物中的活菌数明显降低;而含有重组Enterocin A+β-ME的培养物中的活菌数减少不明显。该重组Enterocin A为N-端带有融合标签His-tag的融合多肽,N-端的34个融合氨基酸中没有半胱氨酸,C-端Enterocin A部分含有的两个半胱氨酸会形成两个二硫键。二硫键为大多数细菌素所有,对抗菌活性起重要作用[11-12]。还原剂DTT、β-巯基乙醇等具有还原二硫键为半胱氨酸的能力。DTT处理的Pediocin PA-1和Enterocin A的抗菌活性明显降低[12]。Ray等[13]的研究结果显示还原剂DTT或者β-巯基乙醇处理的融合蛋白MBP-pediocin AcH的抗菌活性明显降低。本研究结果表明β-巯基乙醇能够还原重组Enterocin A中的二硫键,使其抗菌活性丧失。
2.4 温度对重组Enterocin A抗菌活性的影响

图3 温度对重组Enterocin A抗菌活性的影响Fig.3 Effect of temperature on anti-ListeriaLIN 3 activity of recombinant Enterocin A
重组Enterocin A具有较高的热稳定性。由图3可知,在相同的温度条件下,随着处理时间的延长,重组细菌素的抗菌活性呈下降趋势;相同的处理时间,随着温度的升高,其抗菌活性明显降低。结果还表明,4℃贮存7d对重组Enterocin A的活性几乎没有影响。由于分子质量小、二硫键等因素,热稳定性为一些细菌素的共同特点。细菌素Pediocin pK23-2经过121℃处理15min,其抗菌活性保持不变[14]。但是热稳定性受pH值等其他因素的影响。细菌素Piscicolin 126样品为pH2.0或pH3.0时,100℃处理120min不会影响其抗菌活性,而调整至pH4.0或pH5.0时,100℃处理15min即可导致50%的活性丧失[15]。
2.5 pH值对重组Enterocin A抗菌活性的影响
图4为pH2.0~9.0时的重组Enterocin A的抗菌结果。表明pH2.0~9.0的PBS缓冲液均不表现抗李斯特菌活性。依据阳性判定标准[8],该重组细菌素在pH2.0~8.0时均具有抗李斯特菌活性,在pH9.0时不表现抗菌活性。大多数细菌素通常在酸性环境中很稳定。Rodrí guez等[16]发现在pH4.0~6.0时,细菌素Pediocin PA-1于15℃贮存21d后仍非常稳定,但是调整溶液至pH7.0时,50%的细菌素活性丧失。
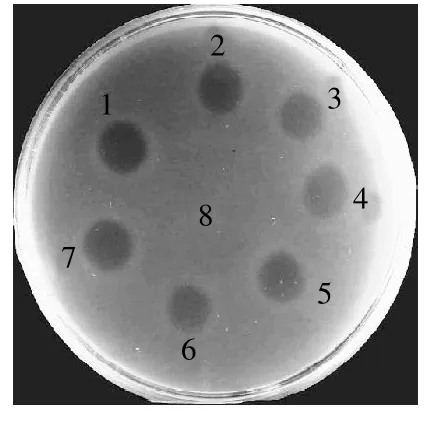
图4 pH值对重组Enterocin A抗菌活性的影响Fig.4 Effect of pH on anti-ListeriaLIN 3 activity of recombinant Enterocin A
3 结 论
重组Enterocin A表现蛋白酶敏感性,胰蛋白酶、蛋白酶K均可使其抗李斯特菌活性丧失。β-巯基乙醇能够还原重组细菌素中的二硫键,使其抗菌活性丧失,间接证明了二硫键为Enterocin A的内在活性因素。重组Enterocin A在pH6.5时具有较高的热稳定性,60℃处理60min、80℃处理30min、100℃处理10min后仍保持抗菌活性。因此,在进行Enterocin A分子设计时,可以考虑在其N-端增加适合长度的氨基酸序列,使其既具有一定程度的蛋白酶耐受水平,又可以保持较高的热稳定性。在选用的8种pH值条件下,重组Enterocin A在pH2.0~8.0时均表现抗菌活性,在pH9.0时不表现抗菌活性,这表明该重组细菌素在低pH值下具有稳定性。
[1] AYMERICH T, HOLO H, HAVARSTEIN L S, et al. Biochemical and genetic characterization of enterocin A fromEnterococcus faecium, a new antilisterial bacteriocin in the pediocin family of bacteriocins[J]. Appl Environ Microbiol, 1996, 62(5):1676-1682.
[2] AYMERICH T, GARRIGA M, YLLA J, et al. Application of enterocins as biopreservatives againstListeria innocuain meat products[J]. J Food Prot, 2000, 63(6):721-726.
[3] ENNAHAR S, DESCHAMPS N. Anti-Listeriaeffect of enterocin A,produced by cheese-isolatedEnterococcus faeciumEFM01, relative to other bacteriocins from lactic acid bacteria[J]. J Appl Microbiol, 2000,88(3):449-457.
[4] KLOCKE M, MUNDT K, IDLER F, et al. Heterologous expression of enterocin A, a bacteriocin fromEnterococcus faecium, fused to a cellulose-binding domain inEscherichia coliresults in a functionalprotein with inhibitory activity againstListeria[J]. Appl Microbiol Biotechnol, 2005, 67(4):532-538.
[5] BEAULIEU L, TOLKATCHEV D, JETTE J F, et al. Production of active pediocin PA-1 inEscherichia coliusing a thioredoxin gene fusion expression approach:cloning, expression, purification, and characterization[J]. Can J Microbiol, 2007, 53(11):1246-1258.
[6] 赵爱珍, 韩文瑜, 徐兴然, 等. Enterocin A在大肠杆菌中的表达及活性检测[J]. 吉林农业大学学报, 2008, 30(1):89-92.
[7] SCHILLINGER U, LCKE F K. Antibacterial activity ofLactobacillus sakeisolated from meat[J]. Appl Environ Microbiol, 1989, 55(8):1901-1906.
[8] CINTAS L M, CASAUS P, HAVARSTEIN L S, et al. Biochemical and genetic characterization of enterocin P, a novel sec-dependent bacteriocin fromEnterococcus faeciumP13 with a broad antimicrobial spectrum[J].Appl Environ Microbiol, 1997, 63(11):4321-4330.
[9] 沈萍, 范秀容, 李广武, 等. 微生物学实验[M]. 北京:高等教育出版社, 1999:93-94.
[10] ENNAHAR S, AOUDE-WERNER D, ASSOBHEI O, et al. Antilisterial activity of enterocin 81, a bacteriocin produced byEnterococcus faeciumWHE 81 isolated from cheese[J]. J Appl Microbiol, 1998, 85(3):521-526.
[11] FIMLAND G, JOHNSEN L, AXELSSON L, et al. A C-terminal disulfide bridge in pediocin-like bacteriocins renders bacteriocin activity less temperature dependent and is a major determinant of the antimicrobial spectrum[J]. J Bacteriol, 2000, 182(9):2643-2648.
[12] EIJSINK V G, SKEIE M, MIDDELHOVEN P H, et al. Comparative studies of class Ⅱa bacteriocins of lactic acid bacteria[J]. Appl Environ Microbiol, 1998, 64:3275-3281.
[13] RAY B, SCHAMBER R, MILLER K W. The pediocin AcH precursor is biologically active[J]. Appl Environ Microbiol, 1999, 65(6):2281-2286.
[14] SHIN M S, HAN S K, RYU J S, et al. Isolation and partial characterization of a bacteriocin produced byPediococcus pentosaceusK23-2 isolated from kimchi[J]. J Appl Microbiol, 2008, 105(2):331-339.
[15] JACK R W, WAN J, GORDON J, et al. Characterization of the chemical and antimicrobial properties of piscicolin 126, a bacteriocin produced byCarnobacterium piscicolaJG126[J]. Appl Environ Microbiol, 1996, 62(8):2897-2903.
[16] RODRIGUEZ J M, MARTINEZ M I, KOK J. Pediocin PA-1, a widespectrum bacteriocin from lactic acid bacteria[J]. Crit Rev Food Sci Nutr, 2002, 42(2):91-121.
Effects of External Factors on Anti-ListeriaLIN 3 Activity of Recombinant Enterocin A
ZHAO Ai-zhen1,XU Xing-ran1,HAN Wen-yu2
(1. College of Pharmaceutical Science, Southwest University, Chongqing 400715, China;2. College of Animal Science and Veterinary Medicine, Jilin University, Changchun 130062, China)
TS201.3
A
1002-6630(2010)17-0327-04
2010-06-04
赵爱珍(1972—),女,副教授,博士,研究方向为乳酸菌细菌素的抗菌活性。E-mail:zaoaizhen@yahoo.com.cn

