αCaM KII在前脑过量表达损伤小鼠灵活性学习能力
安述明, 曾庆文, 徐 浩, 刘汝清, 曹晓华
(华东师范大学脑功能基因组学教育部重点实验室上海市科学技术委员会重点实验室,上海 200062)
αCaM KII在前脑过量表达损伤小鼠灵活性学习能力
安述明, 曾庆文, 徐 浩, 刘汝清, 曹晓华
(华东师范大学脑功能基因组学教育部重点实验室上海市科学技术委员会重点实验室,上海 200062)
将3月龄实验小鼠分为αCaM KII-F89G转基因组和同窝野生对照组,进行疲劳转棒实验和Morris水迷宫实验测试.结果显示,转基因组小鼠的体力和运动协调能力与对照组相比无显著的差异;在Morris水迷宫实验的可视平台测试中,转基因鼠的视觉和求生的动机表现正常;在定位航行训练和第一次空间探索测试中,两组鼠在训练时逃避潜伏期及测试中在目标象限探索时间无统计学差异;但是在反向定位空间学习阶段,转基因组在第二、三天逃避潜伏期和距离明显长于同窝对照组(P<0.05).由此认为,αCaM KII在前脑过量表达对小鼠的灵活性学习有损伤作用,推测这种损伤有可能由前脑L TD的缺陷造成的.
钙/钙调蛋白依赖性蛋白激酶Ⅱ; 疲劳转棒实验; Mo rris水迷宫实验; L TD;空间再学习
Abstract:TheαCaM KII-F89G transgenic mice and their littermate controls were subjected to the rotarod test and Morriswatermaze test.There was no significant difference inmotor coordination and ability between these two groups in the rotarod test.In the visible platform test,transgenic mice showed the normal perception,motivation and motor ability.In addition,transgenic mice performed normally in learning and memory in both place navigation training and the 1st spatial probe test.However,compared with wild type mice,transgenic mice spent significantly more time and swam longer distance to reach hidden platform in the 2nd and 3 rd day of spatial reversal learning.These results indicate thatαCaM KII overexpression in the forebrain can impair spatial reversal learning.The mechanism of the performance deficit may be relevant to disrupted or abolished LTD in the forebrain.
Key words:CaM KII; rotarod test; Morris water maze; L TD; spatial reversal learning
0 引 言
钙/钙调蛋白依赖性蛋白激酶Ⅱ(CaM KII)在学习与记忆和突触可塑性中发挥着重要的作用[1-4].在大脑中CaM KII主要存在形式是α亚型[1].突触中富含这种激酶,它还是突触后致密蛋白(Postsynap tic density)的主要成份[1].大量的研究证明αCaM KII和多种类型的记忆有关.利用基因工程的方法,敲除小鼠海马中αCaM KII,将严重损伤其空间记忆[5,6].而αCaM KII的过量表达也会降低转基因鼠在Morris水迷宫[7-9]和Barnes迷宫[4,10]空间学习中的成绩.不管是敲除还是过量表达αCaM KII基因,小鼠的条件恐惧记忆(Fear conditioning memory)都会受损[7,8,10-13].Joe Z Tsien博士带领科研小组发展了第四代基因敲除技术(可诱导的、可逆的和区域特异性蛋白敲除技术),使用αCaM -Kinase-Ⅱ启动子,成功创建出蛋白修饰的αCaM KII-F89G转基因小鼠实现了αCaM KⅡ基因在前脑皮层、海马和杏仁核等区域过量表达[13].在新异物体识别任务中,αCaM KII-F89G和CaM KII-A sp286EC转基因鼠的识别记忆受损[9,11-13].以往的研究多集中于αCaM KII在一种固定规则学习任务中的作用,但是αCaM KII在非固定规则学习任务即学习灵活性中的作用却少有关注.因此,本研究选取Morris水迷宫空间学习记忆任务,再次利用蛋白修饰的αCaM KII-F89G转基因鼠[13]研究αCaM KII在前脑过量表达对于灵活性学习影响.
1 材料与方法
1.1 实验动物
从美国普林斯顿大学引进αCaM KII-F89G转基因小鼠多只.在华东师范大学脑功能基因组学研究所动物中心饲养和繁殖.用αCaM KII-F89G转基因雄性小鼠与B6/CBAF1雌性小鼠交配和繁殖.28 d后检测小鼠的基因型,分笼.每笼3~4只,自由摄食,饮水,自动光控(12L/12D昼夜交替),每日7:00~19:00开灯,19:00~次日7:00熄灯.行为学实验均在9:00~18:00内进行,室温(22±2)℃,相对湿度50%~60%.
1.2 仪器设备
Morris水迷宫实验装置及其追踪分析系统购买自美国CoulBourn Instrument公司.疲劳转棒实验装置及其分析系统购买自上海吉量软件科技有限公司
1.3 方法
1.3.1 疲劳转棒实验(Rotarod test)
实验装置有5个隔间,每个隔间的宽度为6.5 cm.每个隔间有红外探测和独立的测量系统装置,能检测到小鼠的跌落情况.程序化控制转棒仪的转速,速度范围在1~100 r/min,转棒既能匀加速也能匀减速的转动.疲劳转棒测试系统主要包括转棒仪、软件控制系统和数据采集分析系统.
实验前三天为习惯阶段.每天抚摸鼠5 m in,以消除实验鼠的紧张状态.随后,小鼠被放置在隔间的转棒上,控制转棒旋转5 min,让小鼠适应新的环境和运动方式.每5只鼠测试结束后,用75%的酒精擦拭测试隔间,以避免气味的干扰.测试阶段,操作方法同习惯阶段.小鼠分别放置在隔间的转棒上,运转5 min,转棒的速度从1到30 r/min匀加速增加,记录小鼠在转棒上爬行的总路程和平均速度.
1.3.2 Morris水迷宫实验(Morris water maze)
水迷宫实验装置为一圆柱形水池,直径1.5 m,高54 cm,平台直径10 cm,平台可升降.在水池边缘上等距离设4个标记点,将水池等分为4个象限,平台置于任意一个象限的中央.每个象限的边1/2弧度处标记为小鼠入水点.水池内加入白色颜料,平台在水面下1 cm处,在实验时小鼠无法看到平台.水温维持在(25±1)℃.实验期间迷宫四周参照物保持不变.水迷宫实验系统包括CCD摄像头、视频采集卡和水迷宫采集分析系统.
Morris水迷宫实验包括可视平台检测和隐藏平台检测两个部分.
在可视平台检测中,实验前一天为习惯阶段,让每只小鼠在没有平台的水迷宫中自由游泳1 min,以适应实验环境.测试过程中,在平台上固定一杆小旗(4 cm×2 cm),旗面位于水平面上方15 cm处.测试连续进行2 d,每天4次,每次间隔30 min.训练时,使小鼠头朝向缸壁,分别于四个入水点入水,记录小鼠从入水到寻找并爬上可视平台所需时间即逃避潜伏期(Escape latency),以及游泳速度(Swim speed)[9].
隐藏平台测试分为定位航行训练阶段(Place navigation training)、第一次空间探索阶段(1st spatial p robe test)、反向定位航行训练阶段(Spatial reversal learning)和第二次空间探索阶段(2nd spatial p robe test).定位航行训练阶段为14 d,每只每天4次,每次间隔30 min.使小鼠面向池壁于水缸4个入水点入水,记录逃避潜伏期(Escape latency)及所经过的路径(Length of swim path).如果小鼠在60 s内未找到平台,将其引至平台,逃避潜伏期记为60 s.每次训练小鼠在平台停留30 s.每只小鼠训练后,迅速将其洗净擦干,放回笼内.在此阶段平台置于任意一个象限的中央位置保持不变.每天4次逃避潜伏期的平均值作为该天的训练成绩,记为平均潜伏期,进行统计分析.然后小鼠被连续训练直至达到稳定的标准,即野生对照组能够连续4 d在20 s之内到达平台.在定位航行训练阶段结束1 d后,把平台从水迷宫中撤走,进行第一次空间探索测试.每只有3次测试机会,操作与定位航行训练相似,每只让其自由探索60 s,记录小鼠在各个象限的时间和路径.3次在平台象限的时间占总探索时间的百分比平均值作为记忆成绩,进行统计分析.在反向定位导航训练阶段,平台被移置对角象限的中心.每天操作方法同定位航行训练,总共训练4 d.第5天进行第二次空间探索测试,操作方法同第一次空间探索测试.
所有行为学实验都是试验者在小鼠基因型未知的条件下进行.
1.4 统计分析
疲劳转棒实验、第一次空间探索阶段和第二次空间探索阶段两组间比较采用Student′st-test进行检验;可视平台检测、隐藏平台测试中定位航行测试和反向定位导航测试采用SPSS软件进行Two-factor ANOVA分析.P<0.05为显著性差异(⋆),P<0.01为极显著差异(⋆⋆).数据均采用mean±S.E.M.表示.
2 结 果
2.1 疲劳转棒实验结果
在经历3 d的习惯阶段后,第4天进行5 min的检测.结果显示在转棒上爬行的总路程(W T(1 540.39±277.17)cm,Tg(1 246.27±175.93)cm,P=0.38;见图1 A)和平均速度上(W T(8.93±0.61)cm/s,Tg(8.32±0.52)cm/s,P=0.45;见图1 B),两组鼠没有显著的差异(见图1).这表明转基因鼠的体能和运动协调能力正常.
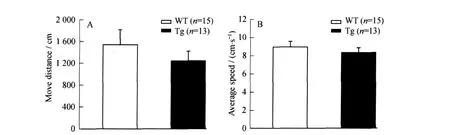
图1 转基因组和同窝野生对照组在疲劳转棒实验中爬行的距离和平均速度Fig.1 The move distance and average speed measured by rotarod test in both Tg and WT mice
2.2 Morris水迷宫实验结果
2.2.1 可视平台检测(Visible plat form test)
在2 d共8次的可视平台检测中,两组小鼠之间在逃避潜伏期(P=0.31;见图2 A)和游泳的速度(P=0.34;见图2 B)上无统计学差异(见图2).结果表明αCaM KII-F89G在前脑的过量表达,并没有对小鼠的视觉、运动能力和求生动机产生影响.
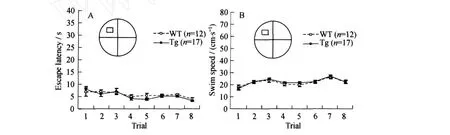
图2 转基因组和同窝野生对照组在水迷宫可视平台测试中逃避潜伏期和游泳的速度Fig.2 The escape latency and swim speed recorded during the visible platform test in both Tg and WT mice
2.2.1 隐藏平台检测(Hidden platform test)
在14 d的定位航行训练中,随着训练的时间延长,转基因鼠和同窝对照野生型鼠逃避潜伏期(见图3 A)和游泳的距离(见图3 B)都呈显著下降趋势(P<0.05,Two-factor ANOVA),并且两组之间训练成绩无统计学差异(P>0.05;Two-factor ANOVA)(见图3).在第15 d的空间探索测试中,转基因鼠和同窝对照野生型鼠在平台象限探索时间无显著差异(W T(35.16±2.03)%,Tg(34.46±1.95)%,P=0.80;Student′st-test),但它们在平台象限探索时间与在相邻象限探索时间相比有显著性差异(P<0.05;Student′st-test)(见图4 A).在反向定位航行训练中,两组鼠每天的训练成绩随着时间的增长显著升高(P<0.05;Two-factor ANOVA),并且两组鼠之间有显著性差异(P<0.05;Two-ANOVA).在此阶段的第2天和第3天转基因鼠的逃避潜伏期(the 2nd day:W T(24.94±2.64)s,Tg(32.27±2.34)s,P=0.04;the 3 rd day:W T(19.82±2.43)s,Tg(27.79±2.42)s,P=0.02;见图3 A)和游泳的距离(the 2nd day:W T(537.59±58.90)cm,Tg(706.65±55.07)cm,P=0.04;the 3 rd day:W T(443.62±55.42)cm,Tg(651.43±60.40)cm,P=0.01;见图3 B)都要显著的高于同窝野生对照组;在第二次空间探索测试中,两组鼠在平台象限探索时间也无显著性的差异(W T(29.92±1.19)%,Tg(28.29±0.86)%,P=0.25;Student′st-test)(见图4 B).
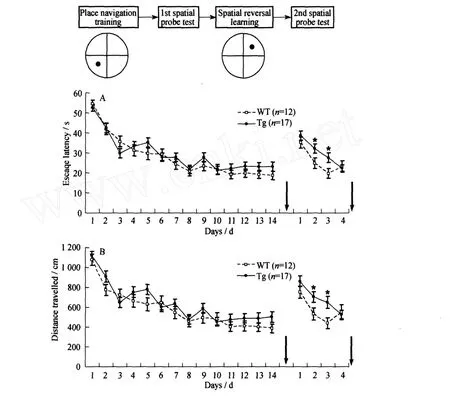
图3 转基因组和同窝野生对照组在水迷宫定位导航训练和反向定位导航训练中逃避潜伏期和游泳的距离随天数的变化Fig.3 The escape latency and distance measured during the p lace navigation test and spatial reversal learning in both groups of mice
3 讨 论
灵活性学习在动物适应多变的环境、保证生存方面起着重要的作用.已有研究表明灵活性学习主要和LTD有关[14,15].另有研究证实L TD的诱导与维持和αCaM KII密切相关[16].因此研究αCaM KII对于灵活性学习能力的影响有重要意义.
疲劳转棒实验测试中,两组鼠在匀加速的转棒上爬行的路程和平均速度无显著差异.说明前脑过量表达αCaM KII-F89G对小鼠的体能和运动协调能力无影响.
Morris水迷宫的可视平台测试中,两组鼠在游到可视平台的时间和速度上无显著的差异.提示前脑过量表达αCaM KII-F89G不影响转基因鼠的视觉功能、运动能力和求生欲望.
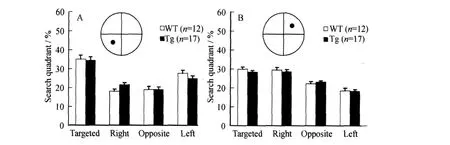
图4 转基因组和同窝野生对照组分别在第一次空间探索实验和第二次空间探索实验中在各个象限探索时间百分比Fig.4 The percent of time spent in the four quadrants recorded during the 1st and 2nd spatial p robe tests in both Tg and W T mice
定位航行训练(Place navigation training)和第一次的空间探索测试中(1st spatial p robe test),两组鼠之间的行为指标无显著性差异.表明转基因鼠在空间记忆的获取和巩固阶段表现正常.这与2003年Wang等人研究一致,Wang认为前脑过量表达αCaM KII不影响转基因鼠获取和巩固记忆[11,13].然而在反向定位空间训练阶段(Spatial reversal learning),平台移置对角象限的中心,在第二天和第三天的训练中,转基因鼠在游向平台所花时间和所经距离都显著大于野生对照鼠.说明转基因鼠灵活性学习能力有显著缺陷.但是随着训练次数的增加,这种缺陷能够得到补偿,且在第二次空间探索测试(2nd spatial p robe test)中两组鼠在平台象限探索时间也无显著的差异.结果提示,在定位航行训练和第一次空间探索阶段,两组小鼠已经学会了一种空间规则,而且掌握程度相当.当更换平台位置后,小鼠需要放弃先前的空间规则,再学习新规则.在此期间,前脑过量表达αCaM KII-F89G对转基因灵活性学习能力造成损伤.
最近Nicholls等利用转基因技术,抑制转基因小鼠前脑的蛋白质磷酸酶2A(Protein phosphatase 2A,PP2A)的活性,能损伤小鼠的灵活性学习能力[14].PP2A与CaM KII有着密切联系,它们有共同的激活底物钙-钙调蛋白(Ca-calmodulin),且PP2A能够使得去磷酸化的CaM KII磷酸化[16,17].推测大量激活CaM KII能抑制PP2A活性,进而导致灵活性学习能力缺陷.
学习记忆和突触可塑性密切相关[18,19].已有实验研究证明,在前脑过量表达αCaM KIIF89G转基因鼠海马的CA 1区,运用离体脑片场电位记录的方法,给予低频刺激(1 Hz,15 min),诱导出减弱的L TD现象.后来2006年Wei等人用同样的方法在该转基因鼠的前扣带回皮层(Anterior cingulate cortex)不能诱导出显著的L TD现象,相反在同窝对照野生型鼠中能诱导显著性的L TD[20].我们推测转基因鼠的空间灵活性学习能力的受损主要和其前脑的L TD减弱或者是消失有关.推测有以下的理论和实验依据:(1)新的记忆的存储被认为是与神经网络中突触传递效率的增强(L TP)有关,后来的再学习记忆被认为是储存在一个不同的突触或交叉于相同的突触[15,21].可能的理论是突触传递效率的降低(L TD)能够使传递效率增强的突触和周围突触之间的“信噪比”增加,即可以提高相邻突触L TP诱导的敏感性[15].(2)Duffy等最近的研究表明,D-serine能够增强在海马中NMDA受体依赖性的LTD,同时也能相应地提高小鼠的空间灵活性学习能力[14].Nicholls等人构建转基因鼠,抑制前脑的蛋白质磷酸酶2A(PP2A)的活性.转基因鼠海马中的L TD被抑制,灵活性学习能力也相应地削弱[15].(3)普遍的研究认为在水迷宫空间学习任务中,海马起着非常重要的作用[22,23].也有研究报道大鼠的前额叶损伤,前扣带回皮层损伤或者纹状体损伤都能破坏其在水迷宫中的空间学习记忆能力[24-27].
综上所述,本研究的结果表明,αCaM KII在前脑过量表达,导致小鼠的灵活性学习能力降低.原因可能与海马和前扣带回皮层的L TD减弱或者消失有关.本结果揭示了αCaM KII在灵活性学习中起重要作用,但是关于灵活性学习的机制还需要进一步的研究.
[1] LISMAN J,SCHULMAN H,CLINE H.The molecular basis of CaM KII function in synaptic and behavioural memory[J].Nat Rev Neurosci,2002,3(3):175-190.
[2] ELGERSMAY,SWEATT J D,GIESE K P.Mouse genetic app roaches to investigating calcium/calmodul-independent protein kinase II function in plasticity and cognition[J].J Neurosci,2004,24(39):8410-8415.
[3] SILVAAJ,STEVENSC F,TONEGAWA S,etal.Deficient hippocampal long-term potentiation in alpha-calcium-calmodulin kinase IImutant mice[J].Science,1992,257(5067):201-206.
[4] BACH ME,HAW KINSRD,OSMAN M,etal.Impairment of spatial but not contextual memory in CaM KII mutant mice with a selective loss of hippocampal LTP in the range of the theta frequency[J].Cell,1995,81(6):905-915.
[5] ELGERSMAY,FEDOROVN B,IKONEN S,et al.Inhibitory autophosphorylation of CaM KIIcontrols PSD association,plasticity,and learning[J].Neuron,2002,36(3):493-505.
[6] SILVA A J,PA YLOR R,WEHNER JM,et al.Impaired spatial learning in alpha-calcium-calmodulin kinase II mutant mice[J].Science,1992,257(5067):206-211.
[7] BEJAR R,YASUDA R,KRUGERS H,et al.Transgenic calmodulin-dependent protein kinase II activation:dose-dependent effects on synaptic plasticity,learning,and memory[J].J Neurosci,2002,22(13):5719-5726.
[8] MILLER S,YASUDA M,COATSJK,etal.Disruption of dendritic translation of CaM KIIalpha impairs stabilization of synap tic plasticity and memory consolidation[J].Neuron,2002,36(3):507-519.
[9] YASUDA M,MA YFORD MR.CaM KIIactivation in the entorhinal cortex disrupts previously encoded spatial memo ry[J].Neuron,2006,50(2):309-318.
[10] MA YFORD M,BACH M E,HUANG Y Y,etal.Control of memory formation through regulated exp ression of a CaM KII transgene[J].Science,1996,274(5293):1678-1683.
[11] CAO X,WANG H,M EIB,et al.Inducible and selective erasure of memories in the mouse brain via chemical-genetic manipulation[J].Neuron,2008,60(2):353-366.
[12] WANG H,FENG R,PH ILL IPWANG L,et al.CaM KIIactivation state underlies synap tic labile phase of L TP and short-term memory formation[J].Curr Biol,2008,18(20):1546-1554.
[13] WANG H,SHIMIZU E,TANG Y P,et al.Inducible p rotein knockout reveals temporal requirement of CaM KII reactivation for memory consolidation in the brain[J].Proc Natl Acad Sci USA,2003,100(7):4287-4292.
[14] DUFFY S,LABRIE V,RODER JC.D-serine augments NMDA-NR2B recep tor-dependent hippocampal long-term depression and spatial reversal learning[J].Neuropsychopharmacology,2008,33(5):1004-1018.
[15] NICHOLLSR E,ALARCONJM,MALLERET G,et al.Transgenic mice lacking NMDAR-dependent LTD exhibit deficits in behavioral flexibility[J].Neuron,2008,58(1):104-117.
[16] KEMP N,BASH IR Z I.Long-term depression:a cascade of induction and exp ressionmechanisms[J].Prog Neurobiol,2001,65(4):339-365.
[17] MALENKA RC,BEAR MF.LTP and LTD:an embarrassment of riches[J].Neuron,2004,44(1):5-21.
[18] MARTIN SJ,GRIMWOOD PD,MORRISR G.Synaptic plasticity and memory:an evaluation of the hypothesis[J].Annu Rev Neurosci,2000,23:649-711.
[19] MARTIN SJ,MORRISR G.New life in an old idea:the synap tic plasticity and memory hypothesis revisited[J].Hippocampus,2002,12(5):609-636.
[20] WEIF,WANG GD,ZHANG C,et al.Forebrain overexp ression of CaM KIIabolishes cingulate long term dep ression and reduces mechanical allodynia and thermal hyperalgesia[J].Mol Pain,2006(2):21.
[21] ROSENZWEIG E S,BARNESC A,MCNAUGH TON B L.Making room fo r new memories[J].Nat Neurosci,2002,5(1):6-8.
[22] D′HOOGE R,DE DEYN P P.App lications of the Morris water maze in the study of learning and memo ry[J].Brain Res Brain Res Rev,2001,36(1):60-90.
[23] MORRISR G,ANDERSON E,LYNCH GS,et al.Selective impairment of learning and blockade of long-term potentiation by an N-methyl-D-aspartate receptor antagonist,AP5[J].Nature,1986,319(6056):774-776.
[24] GRANON S,POUCET B.Medial prefrontal lesions in the rat and spatial navigation:evidence for impaired p lanning[J].Behav Neurosci,1995,109(3):474-484.
[25] MOGENSEN J,PEDERSEN T K,HOLM S,et al.Prefrontal cortical mediation of rats′place learning in amodified water maze[J].Brain Res Bull,1995,38(5):425-434.
[26] WARBURTON E C,AGGLETON JP,MU IR JL.Comparing the effects of selective cingulate cortex lesions and cingulum bundle lesions on water maze perfo rmance by rats[J].Eur J Neurosci,1998,10(2):622-634.
[27] WHISHAW IQ,MITTLEMAN G,BUNCH ST,et al.Impairments in the acquisition,retention and selection of spatial navigation strategies after medial caudate-putamen lesions in rats[J].Behav Brain Res,1987,24(2):125-138.
Forebrain overexpression ofαCaM KII disrupts behavioral flexibility
AN Shu-ming, ZENG Qing-wen, XU Hao, LIU Ru-qing, CAO Xiao-hua
(Key Laboratories of MOE and STCSM,Shanghai Institute of Brain Functional Genomics,East China Normal University,Shanghai200062,China)
Q6
A
2009-03
国家自然科学基金(30670682)
安述明,男,硕士研究生,研究方向为学习与记忆.
曹晓华,女,教授,研究方向为学习与记忆.E-mail:xhcao@brain.ecnu.edu.cn.
1000-5641(2010)02-0111-08
- 华东师范大学学报(自然科学版)的其它文章
- βCaM KII蛋白修饰转基因小鼠工作记忆的研究

