HIV-1 CN54 Pol P51抗原高效表达、纯化、复性及在抗体检测中的应用
侯爵,孙静,徐智勇,范文玲,张怡轩,刘勇,郝彦玲
1 沈阳药科大学 生命科学与生物制药学院,沈阳 110016 2 中国疾病预防控制中心 性病艾滋病预防控制中心 传染病防治国家重点实验室,北京 100050
HIV-1 CN54 Pol P51抗原高效表达、纯化、复性及在抗体检测中的应用
侯爵1,2,孙静2,徐智勇2,范文玲2,张怡轩1,刘勇2,郝彦玲2
1 沈阳药科大学 生命科学与生物制药学院,沈阳 110016 2 中国疾病预防控制中心 性病艾滋病预防控制中心 传染病防治国家重点实验室,北京 100050
为获得可溶性高纯度HIV-1中国株CN54 Pol P51抗原,将携带CN54 pol p51基因的重组质粒pTHioHisA51转化大肠杆菌BL21 codonplus-RIL,用IPTG进行诱导表达。用Chelating Sepharose FF-Ni亲和层析柱及DEAE Sepharose Fast Flow阴离子交换层析柱纯化目的蛋白,采用透析复性法得到可溶性抗原,Western blotting检测目的蛋白。用纯化的P51抗原蛋白标记辣根过氧化物酶及包被酶标板进行双抗原夹心法ELISA检测。结果显示P51以包涵体的形式表达,表达量占菌体总蛋白的50%,经两步层析和透析复性,目的蛋白纯度大于95%。Western blotting和双抗原夹心法ELISA检测均显示了良好的灵敏度和特异性。本研究可以为HIV-1疫苗研究和开发检测试剂提供支持。
HIV-1 CN54,逆转录酶P51,纯化,复性,抗体检测
Abstract:To obtain the pure and soluble P51 antigen of HIV-1 strain CN54, we transformed the Escherichia.coli strain BL21 codonplus-RIL with recombinant plasmid pTHioHisA51 which carries a gene encoding the Polymerase(Pol)P51 antigen of HIV-1 CN54 formerly, and induced protein expression by IPTG.We purified the recombinant protein with Chelating Sepharose FF-Ni and DEAE-Sepharose FF column chromatography, then renatured the recombinant protein by dialyzation.Purified protein was identified by Western blotting.We labeled and coated antigen P51 in a dual-antigen sandwich system, and tested it with serum samples from HIV-infected individuals.The results showed that P51 was expressed as inclusion body, and represented about 50% of total cellular protein.After purification and renaturation, the purity of P51 was up to 95%.Western blotting and sandwich ELISA demonstrated that recombinant P51 had good anti-HIV antibody specificity and sensitivity.The results suggested that recombinant HIV-1 P51 can be prepared as diagnostic reagent, and provides valuable support for HIV-1 detection and vaccine research.
Keywords:HIV-1 CN54, reverse transcriptase P51, purification, renaturation, antibody detection
HIV逆转录酶(RT)是pol基因编码的一个异源二聚体蛋白,由P66和P51两个亚单位组成,分子量约为117 kDa。逆转录酶在HIV生活史中具有逆转录酶、RNA酶H和整合酶活性,发挥着十分重要的作用。已有研究发现P66和P51作为抗原与HIV-1阳性血清具有很高的结合活性,P51抗原在进行 ELISA和Western blotting测定时,阳性检出率与 HIV-1 Gp41相当,比HIV-1 Gag高[1-2]。P51是检测HIV-1抗体检测试剂中最常用的抗原,无论在初筛试剂还是确认试剂都要求有P51抗原的存在。
HIV-1 CN54是我国科学家从云南分离的HIV-1 B’/C重组毒株(CRF07-BC),代表了我国很多地区的优势流行株,也是国内众多课题组研制的 HIV-1疫苗所针对的靶毒株。因此,制备高纯度的 CN54毒株P51抗原对于我国HIV-1疫苗的免疫原性研究及临床样本的检测具有非常重要的意义。本研究利用大肠杆菌表达系统对 P51全长蛋白进行高效表达,对尿素溶解后的包涵体蛋白进行复性,摸索出简便、快捷的纯化工艺,并对 P51在双抗原夹心ELISA检测中的使用条件进行了探讨。纯化后的CN54 P51重组蛋白为针对HIV-1中国流行株的疫苗和诊断试剂研究提供了关键材料。
1 材料与方法
1.1 材料
1.1.1 质粒及菌株
表达HIV-1中国株CN54 P51抗原全长基因的质粒pTHioHisA51由本课题组构建[3],抗原蛋白 N端采用非融合表达策略,C端引入6个组氨酸作为纯化标签。大肠杆菌菌株BL21 codonplus-RIL购自Stratagene公司。
1.1.2 试剂和培养基
iBlot® Dry Blotting System Western blotting电转系统购自 Invitrogen公司。Vivaflow50膜包购自Sartorius公司。
异丙基-B-D-硫代半乳糖苷(IPTG)为Merck公司产品。酵母提取物和蛋白胨均为Oxoid公司产品。低分子量蛋白标准为天根公司产品。预染蛋白标准品为 Fermentas公司产品。ELISA试剂盒为金豪公司为本室研发的HIV临床检测试剂盒。检测血清来自本室临床样本。层析填料是GE Healthcare公司产品。BCA试剂盒为PIERCE公司产品。常用化学试剂为国产分析纯试剂。
1.2 方法
1.2.1 目的蛋白的表达及细胞破碎
将质粒 pTHioHisA51转化大肠杆菌 BL21 codonplus感受态细胞,单菌落接种于5 mL含氨苄青霉素(Amp)的 LB培养基中,过夜培养后接种于500 mL含Amp的LB培养基进行摇瓶培养,37℃振荡培养3 h后加入0.01%(V/V)IPTG,诱导表达15 h后取样,SDS-PAGE分析表达量。4000×g离心10 min收集菌体,高压匀浆破碎后13 000×g离心10 min,SDS-PAGE分析目的蛋白表达量及在上清和沉淀中的分布。
1.2.2 包涵体的溶解
将 37℃下诱导表达的菌体高压匀浆破碎,分别用洗涤缓冲液(pH 7.0,20 mmol/L Tris-HCl,50 mmo1/L NaCl,1 mmo1/L EDTA,1% Triton X-100)洗涤2遍。以pH 10.0的8 mol/L 尿素的溶解液悬起,吹打均匀,室温放置 30 min,13 000×g离心15 min,SDS-PAGE分析目的蛋白的溶解情况。
1.2.3 层析纯化
金属离子螯合层析:将包涵体用上样缓冲液(50 mmol/L Tris-HCl,pH 10.0,50 mmol/L NaCl,50 mmol/L 咪唑,8 mol/L 尿素)溶解后,用 0.45 μm滤膜过滤,上样于Chelating Sepharose FF-Ni螯合柱,用上样缓冲液洗涤4个柱体积,再以20%的洗脱缓冲液(50 mmol/L Tris-HCl,pH 10.0,1 mol/L NaCl,500 mmol/L 咪唑,8 mol/L尿素)洗脱,收集主峰,之后以100%洗脱缓冲液洗脱。
离子交换层析:使用Vivaflow50膜包将亲和层析收集目的峰缓冲液更换成离子交换上样缓冲液(50 mmol/L Tris-HCl,pH 10.0,8 mol/L 尿素)并上样于DEAE Sepharose Fast Flow柱,用上样缓冲液洗涤柱子,之后用洗脱缓冲液(50 mmol/L Tris-HCl,pH 10.0,8 mol/L 尿素,1 mol/L NaCl)阶段洗脱,收集各峰,SDS-PAGE分析后合并高纯度样品。
1.2.4 蛋白的复性
将得到的纯品蛋白加入N-十二烷基肌氨酸钠,置于4℃透析24 h,之后逐步降低变性剂浓度直至完全没有变性剂,蛋白溶液呈现清亮透明,无沉淀无浑浊,即完成了复性。
1.2.5 Western blotting检测P51蛋白
取纯化后的P51蛋白进行SDS-PAGE检测,使用 iBlot® Dry Blotting System 系统将蛋白电转至PVDF膜(Millipore);用 5%脱脂奶粉封闭液(4%BSA,10 mmol/L Tris-HCl,15 mmol/L NaCl,0.1%Tween20)封闭2 h,以HIV-1质控阳性血清作为一抗,辣根过氧化物酶标记的兔抗人IgG抗体作为二抗,分别于室温下作用2 h;显色剂(0.3% NiCl2,0.01 mol/L Tris-HCl,3'-3′二氨基联苯胺,双氧水)显色10 min,终止反应。
1.2.6 P51抗原标记辣根过氧化物酶
采用过碘酸钠法将P51抗原标记辣根过氧化物酶(HRP)。抗原和酶的质量比为1~1.2∶1,HRP和抗原混合后置4℃过夜,然后以0.02 mol/L PBST(pH 7.4)4℃透析,其他参见常规标记方法[3]。
1.2.7 双抗原夹心法ELISA检测质控血清样本
取临床样本中已知HIV-1阳性血清及阴性血清作为实验样本。阳性血清从 1∶50倍比稀释至 1∶6400,阴性样本只做 1∶50稀释;双抗原夹心法的二抗(HRP标记的P51抗原)做1∶2000、1∶4000、1∶8000三个稀释度,间接法的二抗(HRP标记的IgG)做 1∶10 000、1∶20 000、1∶40 000三个稀释度。每个样本在梯度稀释下均有不同二抗稀释度与之相对应。其余操作按照常规ELISA实验进行。
2 实验结果
2.1 P51抗原的原核表达
本实验考察了不同诱导温度(37℃、25℃)时间(2 h、4 h、6 h、8 h)及诱导剂用量(0.1%、0.01%(V/V)IPTG)对目的蛋白表达的影响,综合各种因素选择37℃、0.01%(V/V)IPTG的诱导条件,在大肠杆菌BL21 codonplus中表达目的蛋白P51,经SDS-PAGE电泳检测,发现抗原蛋白得到了大量表达(图1)。
2.2 尿素溶解包涵体结果
通过设置梯度pH(7.0、8.0、9.0、10.0)及尿素浓度(2、4、6、8 mol/L)洗涤包涵体实验可知,在 pH 10.0时 8 mol/L尿素的溶解效果最佳,但仍不能完全溶解,结果见图2。
2.3 层析结果
2.3.1 金属离子螯合层析结果
综合SDS-PAGE电泳结果可知,螯合色谱特异性较好,填料对非特异性蛋白吸附量较低,大量杂蛋白在穿透峰中,进而一步洗脱即可使P51抗原纯度达到85%以上(图3、4)。
2.3.2 离子交换层析结果
结合SDS-PAGE电泳结果可知,P51在较低盐浓度时即可完全洗脱,提高盐浓度,将有少量杂蛋白伴随洗脱,因此梯度洗脱可获得较高纯度P51蛋白(图5、6)。
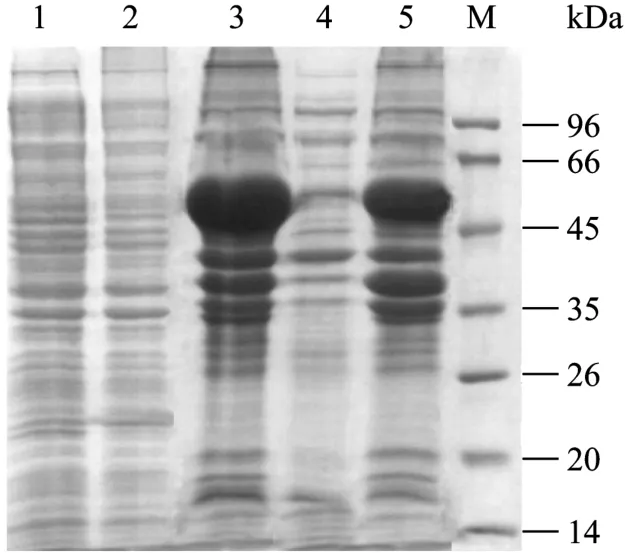
图1 P51在大肠杆菌BL21 codonplus中的表达Fig.1 P51 antigen expressed in E.coli BL21 codonplus.M:protein marker; 1: E.coli BL21 codonplus strain without plasmid; 2: E.coli BL21 codonplus/pTHioHisA51 without IPTG induction; 3: E.coli BL21 codonplus/pTHioHisA51 induced with IPTG; 4: supernatant of lysed cells(E.coli BL21 codonplus/pTHioHisA51 induced with IPTG); 5: precipitate of lysed cells(E.coli BL21 codonplus/pTHioHisA51 induced with IPTG).

图2 P51包涵体在尿素中的溶解Fig.2 Dissolution of inclusion bodies with 8 mol/L urea at pH 10.0.M: protein marker; 1: the supernatant after 8 mol/L urea dissolution; 2: the precipitation after 8 mol/L urea dissolution.

图3 Ni螯合柱层析图谱Fig.3 Ni-Chelating chromatography.Peak 1: flow through fraction; Peak 2: elution with 20% elution buffer; Peak 3:elution with 100% elution buffer.

图4 经Ni亲和层析样品的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the samples from Ni-chelating chromatography.M: protein marker; 1: sample before chromatography; 2: sample from Peak 1(flow through fraction);3,4: samples from Peak 2(eluted with 20% elution buffer); 5:sample from Peak 3(eluted with 100% elution buffer).

图5 DEAE离子交换层析图谱Fig.5 DEAE IE chromatogram.Peak 1: flow through fraction;Peak 2: the first elution fraction; Peak 3: the second elution fraction; Peak 4: the third elution fraction.
2.4 Western blotting检测结果
Western blotting结果表明,纯化的蛋白可与HIV阳性血清发生结合,大小准确,条带清晰、单一,显示了极好的特异性。见图7。
2.5 ELISA结果
如图8所示,间接法的cutoff值在二抗各稀释度下依次为 0.9、0.4、0.2,而同样的阴性样本夹心法cutoff值均为0.01左右(数据未标明),体现出夹心法具有较高特异性;阳性样本在稀释度为1∶6400时也能够较好的判阳,未出现漏检和假阳性情况,表现出较好的灵敏度。
3 讨论

图6 离子交换层析样品的SDS-PAGE分析Fig.6 SDS-PAGE analysis of samples from the DEAE-IE chromatography.M: protein marker; 1: sample from the first elution fraction; 2: sample from the second elution fraction; 3:sample form the third elution fraction.

图7 Western blotting检测纯化的P51蛋白Fig.7 Western blotting analysis of the purified P51.M:prestained protein marker; 1: recombinant P51 after purification;2: cell lysate of E.coli transformed with pThioHisA plasmid vector and induced with IPTG.

图8 P51的ELISA检测Fig.8 ELISA assay of P51.The OD values of positive sample≥2.1 folds the OD values of negative sample means.
P51蛋白在HIV-1中较为保守,在HIV-1各亚型中同源性在85%以上,与HIV-2之间也有60%的同源性。因此其用做检测试剂,假阳性率及漏检率均较低,能够真实地反映感染者血清学状况。在HIV-1感染者中,P51的检出率仅次于HIV膜蛋白,为90%以上,随着疾病的进展,其检出率稍有下降,但波动不大[4-5]。
本研究室曾成功表达纯化该蛋白,采用的策略为包涵体复性后采用DEAE精纯,得到较纯蛋白[6],但由于收率较低,且样品中仍含有变性剂,因而本实验改用金属离子螯合层析配合离子交换色谱技术,获得了单一条带的高纯度蛋白,并成功复性。
重组p51抗原易于形成包涵体,需要通过变性、复性手段,使重组蛋白折叠成天然构象状态[7]。包涵体蛋白的复性效率往往较低,复性成本较高,有的蛋白甚至不易成功地复性。研究证明,采用低pH(≤2.6)和高温(85℃)[8]或用高 pH(≥12)结合低浓度的变性剂[9]有利于包涵体复性。
溶解包涵体时,pH值和尿素浓度对其都有较大影响[10-11],结果表明在高尿素浓度(6 mol/L及8 mol/L)下,较高pH有利于包涵体的溶解。而且,适当提高pH可以保持包涵体中存在的具有天然状态二级结构的蛋白,有利于后续的复性过程[12-13],因此选择pH 10.0、8 mol/L尿素作为包涵体溶解的条件。
目的蛋白的复性过程中,添加N-十二烷基肌氨酸钠可起到2种作用:1)当N-十二烷基肌氨酸钠浓度较高时可作为变性剂,保持包涵体处于溶解状态;2)当 N-十二烷基肌氨酸钠浓度较低时起到保护剂的作用,可帮助蛋白折叠复性。采用较高的复性pH,有利于防止自由硫醇的质子化作用对形成正确二硫键的不利影响。过高或过低的 pH都会降低复性效率,最适宜的复性pH值一般是9.0左右。同时在复性缓冲液中添加高浓度Tris及甘油,有利于提高蛋白折叠效率[12-13]。
较之间接法 ELISA,双抗原夹心法可以同时检测血液中的IgG和IgM,有利于提高检出灵敏度并缩短“窗口期”。同时,酶标抗原与被包被抗原所捕获的抗体之间的结合具有高度特异性,不受非特异性抗体的干扰,因而双抗原夹心法的特异性更好[14-15]。从实验结果可以看出,采用间接法其本底值随二抗用量增多而加大,意味着有较多的非特异性结合,而夹心法由于其特异性优势,本底值极低,能很好地排除非特异性干扰,因此在保证特异性及灵敏度的前提下,可以加大抗原包被量得以更加灵敏的检测样本。由于 P51在大肠杆菌中表达极易形成包涵体,而双抗原夹心法做酶标记时要求抗原最好以可溶形式存在,因而其复性成功与否成为能否开发成功双抗原夹心法P51抗体检测试剂的关键。近年来逆转录酶抗原表位不断发现和阐明,为研究HIV疫苗提供了新思路,由于逆转录酶自身保守性,以逆转录酶作为抗原的病毒疫苗和核酸疫苗将对病毒的变异有更大的适应性[16-17],因此本研究为 HIV抗体检测及疫苗研究提供了关键试剂。
REFERENCES
[1]Tasara T, Amacker M, Hubscher U, et al.Intramolecular chimeras of the p51 subunit between HIV-1 and FIV reverse transcriptases suggest a stabilizing function for the P66 subunit in the heterodimeric enzyme.Bioehemistry,1999, 38: 1633–1642.
[2]Cabodevilla JF, Odriozola L, Santiago E, et al.Factors affecting the dimerization of the P66 form of HIV-1 reverse transeriptase.Eur J Bioehem, 2001, 268(5):1163–1172.
[3]Huang CX.Medical Virology Basis and Experimental Techniques.Beijing: Science Press, 1990: 211.黄祯祥.医学病毒学基础及实验技术.北京: 科学出版社, 1990: 211.
[4]Yang CX, Fu JH, Bi ZQ, et al.Detection of immunological and serological indicator of HIV-1 infectedindividuals.Chin J Public Health, 2008, 24(6): 695–696.杨彩霞, 傅继华, 毕振强, 等.HIV-1感染者免疫学及血清学指标检测.中国公共卫生, 2008, 24(6): 695–696.
[5]DeVico AL, Veronese FD, Lee SL, et al.High prevalence of serum antibodies to reverse transcriptase in HIV-1-infected individuals.AIDS Res Hum Retrovir, 1988, 4(1):17–22.
[6]Qu XW, Yang ZQ, Shao YM, et al.Overexpression and purification in E.coli of P66 and P51 protein of HIV-1 strain CN54.Huazhong Agricultural University, 2004.瞿小旺, 杨再清, 邵一鸣, 等.中国株 CN54 HIV-1 Pol P66/P51在大肠杆菌中的表达与纯化.华中农业大学, 2004.
[7]Vallejo LF, Rinas U.Strategy for the recovery of active protein through refolding of bacterial inclusion body proteins.Microb Cell Fact, 2004, 3: 11.
[8]Gavit P, Better M.Production of antifungal recombinant peptides in Escherichia coli.J Biotechnol, 2000, 79(2):127–136.
[9]Patra AK, Mukhopadhyay R, Muhhija R, et al.Optimization of inclusion body solubilization and renaturation of recombinant human growth hormone from Escherichia coli.Protein Expr Purif, 2000, 18(2): 182–192.
[10]Fu JJ, Sun J, Chen P, et al.Optimization of induction and purification of HIV-1 Gag protein in Escherichia coli expression system.Chin J Biotech, 2008, 24(7):1306–1311.傅晶晶, 孙静, 陈佩, 等.HIV-1 Gag蛋白在大肠杆菌表达系统中诱导和纯化条件的优化.生物工程学报, 2008,24(7): 1306–1311.
[11]Sun J, Liu Y, Hao YL, et al.Optimization of purification condition for inclusion body of recombinant HIV-1 transmembrane protein Gp41.Chin J Biologicals, 2009,22(4): 395–398.孙静, 刘勇, 郝彦玲, 等.重组HIV-1跨膜蛋白Gp41包涵体纯化条件的优化.中国生物制品学杂志, 2009,22(4): 395–398.
[12]Khan RH, Rao KB, Eshwari AN, et al.Solubilization of recombinant bovine growth hormone with retention of native like secondary structure and its refolding from the inclusion bodies of E.coli.Biotechnol Prog, 1998, 14:722–728.
[13]Singh SM, Panda AK.Solubilization and refolding of bacterial inclusion body proteins, J Biosci Bioeng, 2005,99(4): 303–310.
[14]He HX, Mao PY, Hou J, et al.Establishment of a double-antigen sandwich ELISA for detecting total antibodies to human immunodeficiency virus type 1/2.Chin J Exp Clin Virol, 2002, 16(3): 288–291.何红霞, 貌盼勇, 侯俊, 等.双抗原夹心法检测抗HIV1/2总抗体方法的建立和评价.中华实验和临床病毒学杂志, 2002, 16(3): 288–291.
[15]Zhao LH, Shen JC, Kong W, et al.Studies on antigencity of human immunodeficiency virus type-1(HIV-1)external glycoprotein as well as its expression in Pichia pastoris.Chin J Biotech, 2007, 23(3): 457–461.赵丽辉, 沈家骢, 孔维, 等.HIV-1膜蛋白在甲醇型酵母中的表达和抗原性的研究.生物工程学报, 2007, 23(3):457–461.
[16]Hehl EA, Kalpana GV, Prasad VR, et al.Interaction between human immunodeficiency virus type I reverse transcriptase and integrase protein.J Virol, 2004,5056–5067.
[17]Sevilya Z, Loya S, Duvshani A, et al.Mutagenesis of Cysteine 280 of the reverse transcriptase of human immunodeficiency virus type-1: the effects on the ribonuclease H activity.J Mol Biol, 2003, 327: 19–30.
Expression, purification and renaturation of Pol P51 antigen of HIV-1 strain CN54 and its application in antibody detection
Jue Hou1,2, Jing Sun2, Zhiyong Xu2, Wenling Fan2, Yixuan Zhang1, Yong Liu2, and Yanling Hao2
1 College of Life Science and Biopharmaceutics, Shenyang Pharmaceutical University, Shenyang 110016, China 2 State Key Laboratory for Infectious Disease Prevention and Control, National Center for AIDS/STD Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 100050, China
Received:September 29, 2009;Accepted:December 25, 2009
Supported by:Special Project of the “Eleventh Five-year Plan”(Nos.2008ZX1001-1010, 2009ZX10004-713).
Corresponding author:Yanling Hao.Tel: +86-10-67887758; Fax: +86-10-67887758; E-mail: hylyuer@yahoo.com.cn国家十一五科技重大专项(Nos.2008ZX1001-1010, 2009ZX10004-713)资助。

