展示生长抑素的猪细小病毒样颗粒构建及其免疫原性
张雪花,郑其升,陈瑾,薛刚,侯红岩,侯继波
1 江苏省农业科学院 国家兽用生物制品工程技术研究中心,南京 210014 2 南京农业大学 农业部动物疫病诊断与免疫重点开放实验室,南京 210095
展示生长抑素的猪细小病毒样颗粒构建及其免疫原性
张雪花1,2,郑其升1,陈瑾1,薛刚1,2,侯红岩1,侯继波1
1 江苏省农业科学院 国家兽用生物制品工程技术研究中心,南京 210014 2 南京农业大学 农业部动物疫病诊断与免疫重点开放实验室,南京 210095
为了获得既可预防猪细小病毒感染又能促进生长的嵌合病毒样颗粒疫苗,以PPV NJ-a株基因组DNA为模板扩增VP2基因片段,在VP2基因N端融合人工合成的4拷贝生长抑素基因,构建杆状病毒转移载体pFast-SS4-VP2。通过转化DH10Bac感受态细胞,pFast-SS4-VP2与穿梭载体Bacmid重组,获得重组Bacmid,命名为rBacmid-SS4-VP2。rBacmid-SS4-VP2转染Sf-9细胞,获得重组病毒rBac-SS4-VP2。SDS-PAGE与Western blotting鉴定可见约68 kDa的rSS4-VP2条带;rBac-SS4-VP2感染细胞IFA检测产生很强的特异性绿色荧光;感染细胞超薄切片电镜观察到大量特征性病毒样颗粒。将重组蛋白分别辅以铝胶、IMS和白油不同佐剂免疫小鼠,通过检测免疫小鼠VP2特异性ELISA抗体、PPV特异性中和抗体、生长抑素的抗体水平及生长激素水平来评价嵌合病毒样颗粒的免疫原性。结果表明,辅以铝胶与IMS佐剂重组蛋白组均产生了与PPV全毒组相似的ELISA抗体与中和抗体反应;重组蛋白免疫组均产生较好的针对生长抑素的抗体反应;免疫小鼠体内生长激素的水平明显升高;其中以铝胶佐剂组产生的各抗体水平最高,白油佐剂组各抗体水平最低。为以后生产安全、有效的颗粒化亚单位疫苗提供了一个新的设计思路,又为应用病毒样颗粒递呈外源肽,从而生产多联亚单位疫苗奠定了基础。
猪细小病毒,VP2蛋白,生长抑素,杆状病毒,病毒样颗粒
Abstract:In order to obtain a virus-like particle vaccine both for porcine parvovirus(PPV)prevention and growth-promotion,VP2gene of PPV NJ-a strain was amplified with PCR, and four copies of synthetic somatostatin gene were fused to the N-terminal ofVP2gene.The fused gene was cloned into pFast-HT A to construct the recombinant plasmid pFast-SS4-VP2, then the pFast-SS4-VP2was transformed into DH10Bac competent cells and recombined with shuttle vector Bacmid, followed by identification with blue-white screening and PCR analysis for three cycles, and the positive recombinant was named as rBacmid-SS4-VP2.The positive Sf-9 cells were transfected with rBacmid-SS4-VP2by Lipofectamine to produce recombinant baculovirus.When the cytopathic effect(CPE)was obvious, the transfected Sf-9 cell was harvested, and the positive recombinant virus was named as rBac-SS4-VP2.Theinsertion for the target gene into baculovirus genome was confirmed with PCR.SDS-PAGE and Western blotting revealed that the calculated protein of approximately 68 kDa was in the expressed in the insect cells.The Sf-9 cells infected with rBac-SS4-VP2 were stained positive against PPV antibody using the indirect immunofluorescence assay(IFA).Moreover, the virus particle self-assembly was observed under electron microscopy.90 four-week-old mice were immunized by the recombinant protein coupled with different adjuvants alhydrogel, IMS and oil.VP2-specific ELISA antibodies, PPV-specific neutralizing antibody, somatostatin antibody and growth hormone levels were examined to evaluate the immunogenicity of this virus like particle.Results indicated that mice groups immunized rSS4-VP2 protein with alhydrogel and IMS developed similar humoral immune response comparing with inactived PPV vaccine.Mice group immunized with rSS4-VP2 generated higher level of SS antibody and growth hormone comparing with negative control, mice receiving rSS4-VP2 with alhydrogel developed the highest antibody titre than all other groups, while the oil group developed the lowest antibody level.This study provides not only a new rout for production of safe and effective virus like particle subunit vaccine, but also the foundations for peptide presentation and multivalent subunit vaccine design.
Keywords:porcine parvovirus, VP2, somatostatin, baculovirus, virus-like particles
猪细小病毒(Porcine parvovirus,PPV)是引起猪繁殖障碍的主要病原之一,导致初产母猪流产、死胎、木乃伊胎,其中以胎儿木乃伊化为主,成年猪不表现明显临床症状,该病在世界范围内广泛流行,造成了巨大的经济损失[1]。在PPV组织培养物中,完整病毒粒子与不含DNA的空衣壳病毒粒子同时存在,大小形态相同,密度分别为 1.39 g/cm3和1.33 g/cm3[2]。Choi等报道,PPV空衣壳可影响病毒在传代细胞和猪体内的增殖。体内外试验表明,抑制作用依赖于空衣壳所占比例,当空衣壳与全病毒的比例超过30∶1时,接种的猪不表现临床症状,但DNA杂交显示有病毒存在的迹象[3]。大量研究发现,疫苗免疫接种是防治该病的关键,许多学者成功研制了相应的灭活疫苗和弱毒活疫苗。此外,Martinez等还证实,体外表达的PPV VP2蛋白具有良好的免疫原性,免疫动物后可诱导产生保护性免疫反应,与商品化疫苗的免疫效果相同[4]。
PPV属于自主型细小病毒,其基因组为线状单股负链DNA,大小约为5 kb,共有2个开放阅读框架(Open reading frame,ORF),一个编码结构蛋白(VP1、VP2),另一个编码非结构蛋白(NS1、NS2和 NS3)其中 VP2是构成病毒粒子的主要衣壳蛋白,具有血凝活性,约占病毒衣壳蛋白总量的80%,VP2蛋白携带主要的抗原决定簇,可诱导机体产生保护性中和抗体,VP2对病毒感染、发挥其致病性方面亦起关键作用。并且VP2蛋白在体外表达时可自主装配,能自动形成完整的病毒样颗粒,具有良好的免疫原性,成为病毒疫苗研究的主要方向[5]。病毒样颗粒(Virus-like particles,VLPs)是某种病毒的一个或多个结构蛋白装配成的空心颗粒,它既具有类似天然病毒的稳定性和免疫原性,又具备携带外源蛋白或多肽的潜能,不含有病毒的核酸没有感染性,使其有望成为构建多价疫苗的良好载体[6-8]。据报道,使用昆虫杆状病毒表达系统获得了PPV的病毒样颗粒,该 VLPs能够诱导小鼠产生强烈的免疫应答[9-10]。而在VP2基因的 5′端连接一段外源基因对PPV VLPs的形成影响较小[11]。
生长抑素(Somatostatin,SS)是下丘脑释放的14氨基酸的小肽,广泛分布于中枢神经系统和胃肠道组织中。SS能抑制生长激素(GH)的分泌,而GH处于动物生长轴的核心,GH通过与受体结合诱导肝细胞产生胰岛素样生长因子(IGF-1),而IGF-1能直接作用于动物体内的多种组织,促进蛋白质的合成,促进细胞增殖,从而促进骨骼、肌肉和内脏的生长[12]。由于SS是一个只有14个氨基酸的小肽,在体内稳定性较差,需要承载于其他大的蛋白载体,才能更好地发挥免疫原性。
本研究以猪细小病毒VP2蛋白为载体,在其N端插入4拷贝生长抑素,用杆状病毒表达系统获得自我装配的病毒样颗粒,以期获得既可预防猪细小病毒病又能促进生长的双价亚单位疫苗。为了提高抗原的免疫原性,使机体产生更好的免疫应答。本实验以白油、铝胶、IMS 1312、CpG为佐剂设计了不同的免疫组,旨在筛选出比较适合的佐剂来提高抗原的免疫效力。
1 材料与试剂
1.1 菌株、质粒、毒株与细胞
转座用大肠杆菌宿主菌 DH10Bac(含杆状病毒穿梭载体质粒Bacmid和辅助质粒Helper)、pFastBac HT A、草地贪夜蛾卵巢细胞Sf-9由江苏省农业科学院兽医研究所王芳老师惠赠;四拷贝的生长抑素基因由大连TaKaRa公司人工合成;大肠杆菌DH5α、PK-15细胞、猪细小病毒强毒株(NJ-a株)由国家兽用生物制品工程技术研究中心保存。
1.2 主要试剂
Grace′s培养基、优级胎牛血清(FBS)、Sf-900 ⅡSFM 无血清培养基、脂质体转染试剂盒Lipofectamine 2 000均购自Invitrogen公司;BamHⅠ、XhoⅠ工具酶,DNA Marker DL 2 000、15 000、λ-HindⅢ、异丙基-β-D-硫代半乳糖苷(IPTG)、5-溴-4-氯-3-吲哚半乳糖苷(X-gal)、T4 DNA连接酶、Ex TaqDNA聚合酶、DNA胶回收试剂盒购自大连TaKaRa公司;蛋白Marker购自北京全式金生物技术有限公司;质粒小提试剂盒购自Axygen公司;猪细小病毒抗体检测试剂盒购自深圳绿诗源生物技术有限公司;生长激素放射免疫分析检测试剂盒购自北京北方生物技术研究所;豚鼠抗PPV阳性血清实验室保存;HRP与FITC标记羊抗豚鼠IgG购自北京博奥森生物技术有限公司;HRP标记羊抗小鼠IgG购自博士德生物工程公司;人工合成的生长抑素由上海吉尔生化有限公司合成;铝胶由南京天邦公司提供;IMS 1312购自法国赛比克公司;其余试剂均为国产或进口分析纯。
2 方法
2.1 引物的设计与合成
以PPV NJ-a株为模板,用Primer Premier 5.0生物软件设计出 2条引物(表 1),用于扩增VP2全基因。
人工合成四拷贝猪生长抑素基因,带有BamHⅠ、BlgⅡ酶切位点GGATCCAAAAAGCTGG TTGTAAGAACTTTTTTTGGAAGACTTTTACTTC TTGTGCTGGTTGTAAGAACTTTTTTTGGAAGAC TTTTACTTCTTGTGCTGGTTGTAAGAACTTTTT TTGGAAGACTTTTACTTCTTGTGCTGGTTGTAA GAACTTTTTTTGGAAGACTTTTACTTCTTGTAG ATCT。
2.2 重组质粒pFast-SS4-VP2构建
以P1、P2为引物扩增PPVVP2,PCR产物克隆入 pMD18-T载体,获得质粒 pMD-VP2,进行序列测定,确定基因序列的正确性。
将人工合成的四拷贝生长抑素基因用BamHⅠ、BlgⅡ双酶切鉴定,送测序进一步验证基因序列。
利用BamHⅠ、XhoⅠ双酶切质粒 pMD-VP2,回收VP2片段,克隆至杆状病毒转移载体pFastBac HT A,得到重组质粒pFast-VP2。
BamHⅠ单酶切重组质粒 pFast-VP2,使其完全线性化后,CIAP去磷酸化,回收。BamHⅠ、BlgⅡ双酶切人工合成的四拷贝生长抑素,获得的四拷贝生长抑素片段与线性化的pFast-VP2进行连接,获得重组质粒pFast-SS4-VP2。
2.3 重组穿梭载体 rBacmid-SS4-VP2的构建和鉴定
按照Bac-to-Bac Baculovirus Expression System操作说明,将重组质粒pFast-SS4-VP2转化DH10Bac感受态细胞,在DH10Bac中在helper质粒辅助作用下重组质粒pFast-SS4-VP2与Bacmid发生位点特异性转座作用。在含有IPTG/X-gal、Kan、Gen及Tet抗生素的LB固体平板中出现蓝白菌落,经 3次蓝白斑筛选,利用通用引物PUC/M13F和针对目的基因SS4-VP2的引物进行 PCR鉴定得到纯化的rBacmid-SS4-VP2。

表1 用于PCR扩增的引物Table 1 Primers used for PCR amplification
2.4 重组杆状病毒的制备和鉴定
按照 LipofectamineTM2 000转染试剂说明书操作,将重组穿梭载体 rBacmid-SS4-VP2转染对数生长期的Sf-9(10% FBS Grace′s培养液培养)细胞,27℃静置培养5 d以上,直至细胞出现病变,获得的重组病毒命名为rBac-SS4-VP2。
PCR鉴定:从感染重组杆状病毒的Sf-9细胞中提取总DNA,分别用通用引物PUC/M13F,特异性引物扩增目的片段。
2.5 重组杆状病毒滴度的测定
按常规方法测重组杆状病毒的滴度,病毒用2% FBS Grace′s 依次倍比稀释至最高稀释度 10−10;每个病毒稀释度做8个平行复孔,加样时从最高稀释度开始;第11列和12列作为阴性对照,阴性对照孔中加入 100 μL 2% FBS Grace′s;于 27℃培养,每天观察病变情况,直至对照细胞老化、脱落;计录每一列中出现阳性的孔数;按Karber法计算结果。
2.6 重组蛋白在Sf-9细胞中的表达及检测
2.6.1 SDS-PAGE电泳分析
重组病毒分别以MOI 0.01、0.05、0.1、0.5感染处于对数生长期Sf-9(Sf-900ⅡSFM培养液培养)细胞,同时以野生杆状病毒为对照。感染后96~120 h待细胞病变明显时收集细胞,用PBS洗3次,适量PBS重悬,加入 5×SDS Loading Buffer,用 10%SDS-PAGE凝胶电泳分析。
2.6.2 Western blotting检测
SDS-PAGE方法同上;半干法转印,DAB显色,拍照留图。
2.6.3 间接免疫荧光检测
重组病毒以MOI 0.5感染长满Sf-9单层的6孔板,同时设立未感染的Sf-9昆虫细胞和野生杆状病毒感染的细胞作对照;待 6孔板内的细胞完全病变后,弃上清,用75%的酒精固定40~60 min;用含1% BSA的 PBS洗3次,自然风干;加入1∶100稀释的豚鼠抗 PPV阳性血清(已与野生杆状病毒蛋白作用过),37℃湿盒孵育2 h;用含1% BSA的PBS洗3次,自然风干;加入1:50稀释的FITC标记的羊抗豚鼠二抗,37℃作用30 min;用含1% BSA的PBS洗3次,自然风干;荧光显微镜下观察结果。
2.6.4 电镜观察
以MOI 0.5感染Sf-9细胞,120 h待细胞完全病变后收毒,用PBS洗3次,2 000 r/min离心10 min沉淀细胞,2.5%戊二醛(0.1 mol/mL 磷酸缓冲液pH 7.4)固定液4℃固定过夜,制备超薄切片,电镜观察。
2.7 重组蛋白的纯化
重组病毒以MOI 0.05感染处在对数生长期的Sf-9细胞,5 d后收集病变细胞,用PBS洗2次,2 000 r/min离心15 min,重悬于25 mmol/L NaHCO3(pH 8.3)中,使细胞密度为2×107cells/mL,超声波裂解后,10 000 r/min离心15 min,上清液中含有表达的 rSS4-VP2蛋白。收集上清中加入饱和硫酸铵(pH 7.0)至终浓度20%,4℃搅拌过夜进行沉淀,然后18 000 r/min离心10 min,沉淀重悬于PBS中,加Triton X-100和TBP-磷酸三丁酯至浓缩物的1%和0.3%灭活杆状病毒,室温静置30 min,透析除盐,再用超滤管超滤离心,去除杂蛋白,即得到重组蛋白的纯化物[13]。
2.8 小鼠免疫试验
2.8.1 试验设计
小鼠随机分组,每组10只,具体设计见表2。
2.8.2 免疫程序
免疫3次,每次免疫时间间隔为2周。免疫200 μL/只,后腿各注射100 μL,每只小鼠重组蛋白免疫剂量为50 μg。免疫后每周小鼠眼球采血,常规分离血清,−20℃保存待用。
2.9 抗体检测
2.9.1 猪细小病毒检测试剂盒检测抗体
具体操作步骤按试剂盒附带说明书:用样品稀释液将血清 1∶40稀释后加入预包被的微孔板中,每孔加 100 μL;同时设置阴、阳性对照孔,每孔加100 μL;另设一空白对照孔,空白对照孔加100 μL稀释液。OD630测定结果。
2.9.2 免疫小鼠中和抗体的检测
采用固定病毒稀释血清法进行微量中和试验检测。其中血清无菌处理后作 2−1、2−2、2−3……系列倍比稀释,接种于长满 PK-15 细胞单层的 96孔板中,每孔50 μL。然后每孔加入用DMEM(GIBCO)稀释为200 TCID50的PPV NJ-a株50 μL,同时设细
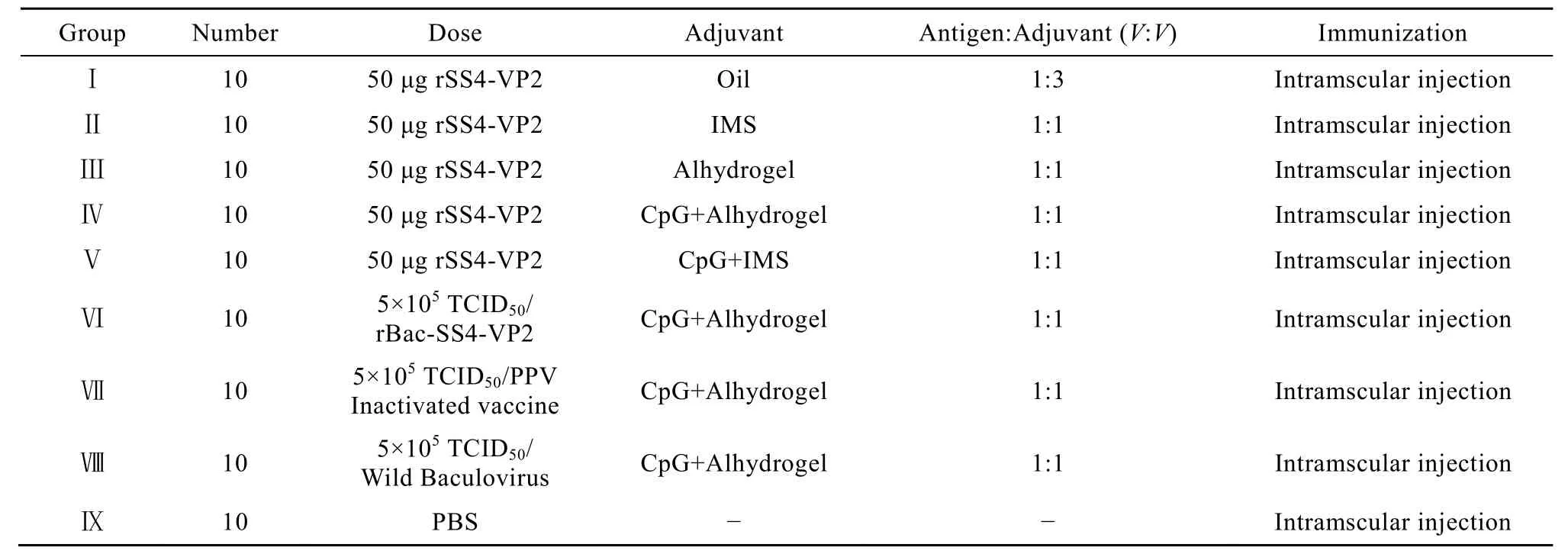
表2 试验动物分组与疫苗制备Table 2 Animal grouping and treatment
胞对照和病毒对照孔,37℃、2% CO2培养箱中培养,逐日观察并记录细胞病变结果,以能完全保护细胞不发生病变的最高稀释倍数为被检血清中 PPV特异性中和抗体的效价。
2.9.3 间接ELISA检测生长抑素抗体水平
以人工合成的生长抑素(5 μg/mL)为抗原包被酶标板,100 μL/孔,2免后2周的小鼠血清为一抗1∶100稀释,检测血清抗生长抑素抗体水平。
2.9.4 GH水平检测
取100 μL 2免后2周的小鼠血清,送南京军区总医院检测生长激素(GH)含量。
3 结果
3.1 重组转移载体的构建及酶切鉴定
载体pFast-HT A 用BamHⅠ与XhoⅠ双酶切,使之完全线性化,先与VP2相连,酶切鉴定正确后,BamHⅠ单酶切,去磷酸化后与生长抑素连接,酶切鉴定,并命名为pFast-SS4-VP2。由图可以看到酶切后得到一条1 910 bp的条带,与目的条带大小相当,证明重组载体构建成功(图1)。
3.2 重组穿梭载体的构建与鉴定
将空载体pFast-HT A、重组载体pFast-SS4-VP2转入含穿梭质粒Bacmid的感受态细胞DHl0Bac中,在Helper质粒编码的转座酶的协助下,重组转移载体 pFast-SS4-VP2与 DHl0Bac发生位点特异性的转座作用,将目的基因克隆入Bacmid,经3次蓝白菌落筛选及利用通用引物 PUC/M13PCR鉴定,空载体与Bacmid重组后扩增出的条带大小为2 430 bp,重组载体与Bacmid重组后扩增出条带大小为4 300 bp左右,与预期结果一致(图2)。
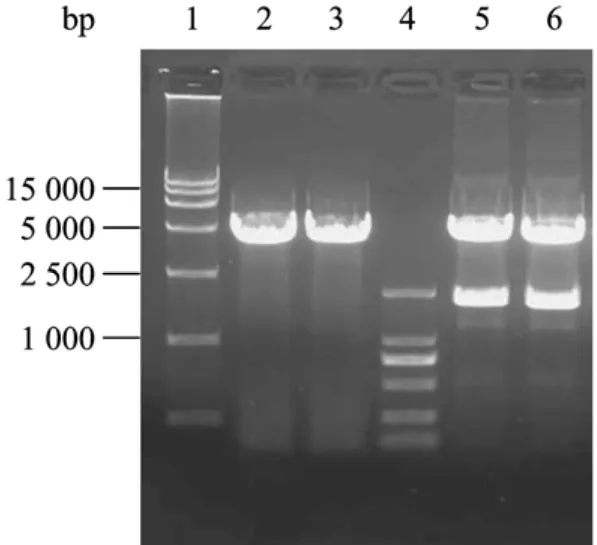
图1 重组质粒的酶切鉴定Fig.1 Identification of the recombinant plasmid by enzyme digestion.1: DL15 000 DNA marker; 2−3: pFast-HT A plasmid digested byBamH I; 4: DL2 000 DNA marker; 5−6: pFast-SS4-VP2 recombinant plasmid digested byBamH I andXhoI.
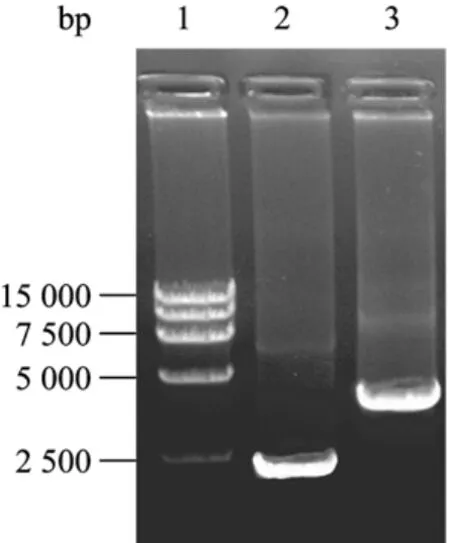
图2 PCR鉴定重组BacmidFig.2 Identification of the recombinant Bacmid by PCR.1:DL15 000DNA marker; 2: PCR product of rBacmid-pFast.
3.3 重组杆状病毒的制备
转染后每天观察细胞状态,对照细胞生长良好,轮廓清晰,胞体明亮,能看到明显的细胞分裂,增殖的哑铃型细胞,转染重组病毒的细胞开始没有明显变化;3 d后,细胞开始变化,细胞变大变圆,细胞核充满整个细胞,病变细胞随着时间增加,感染重组病毒细胞生长停止,细胞中出现囊泡、病毒包涵体,折光率增加,最后早期感染的细胞开始死亡,有细胞脱落、破裂(图3)。
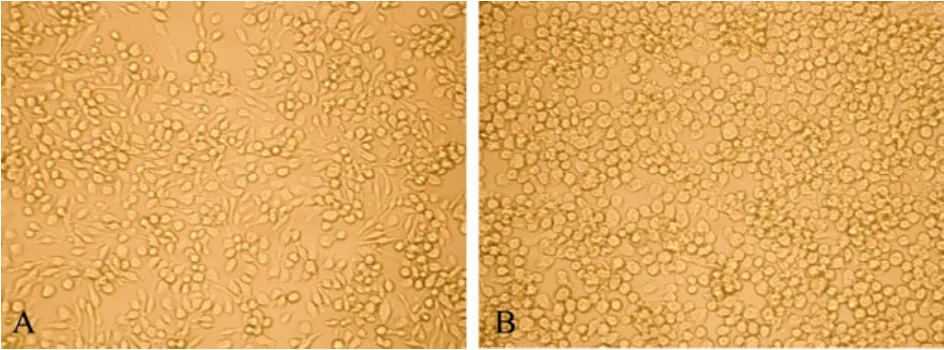
图3 重组杆状病毒rBac-SS4-VP2在Sf-9细胞上引起的细胞病变Fig.3 CPE on Sf-9 cells induced by rBac-SS4-VP2 infection.(A)Normal Sf-9 cell.(B)Sf-9 cell transfected with rBacmid-SS4-VP2.
3.4 重组杆状病毒的PCR鉴定
提取病变细胞DNA基因组,分别以PUC/M13通用引物、特异性引物进行PCR扩增,0.8%琼脂糖凝胶电泳,可见条带与目的片段大小一致,且没有出现杂带,证明外源基因成功插入杆状病毒基因中,并说明病毒已得到纯化(图4)。
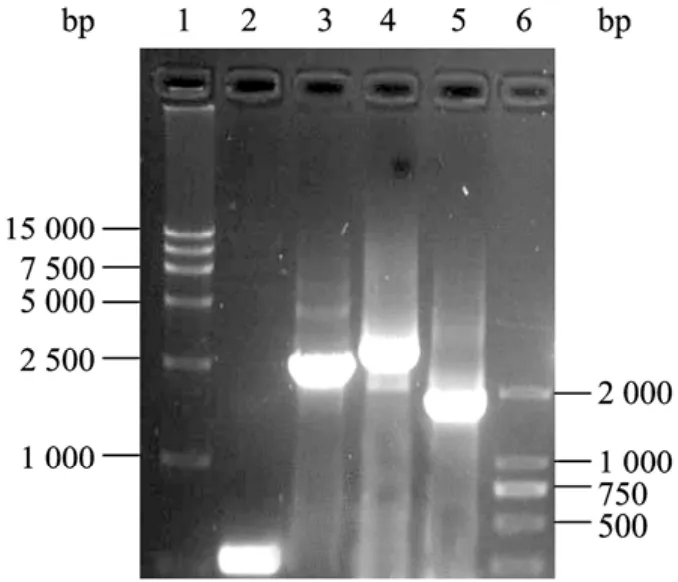
图4 重组杆状病毒PCR鉴定Fig.4 Identification of the recombinant baculovirus by PCR.1: DL15 000 DNA marker; 2: PCR amplification with M13 primer for Bacmid transfected Sf-9 cells; 3: PCR amplification with M13 primer for rBacmid-pFast; 4: PCR amplification with M13 primer for rBac-SS4-VP2; 5: PCR amplification with specific primer for rBac-SS4-VP2; 6: DL2 000 DNA marker.
3.5 重组蛋白的SDS-PAGE鉴定
分别以不同MOI 0.01、0.05、0.1、0.5感染Sf-9细胞,96 h后收集病变Sf-9细胞,用PBS洗涤3次后,加上样缓冲液煮沸10 min后进行SDS-PAGE,结果表明,在lane2~5中均出现一条大小约为68 kDa的特异性蛋白质条带,与DNAStar分析的蛋白分子量基本一致,阴性对照(lane1)未出现该蛋白质条带,且不同的感染比感染细胞蛋白表达量相当(图5)。
3.6 重组蛋白的Western blotting鉴定
Western blotting检测,以MOI 0.1、0.5感染细胞,制备样品方法同SDS-PAGE,结果在lane2、lane3中出现特异性蛋白条带,lane4中则没有出现特异性条带(图6),表明利用杆状病毒表达的rSS4-VP2蛋白可与 PPV阳性血清发生特异性免疫反应,从而证实其具有生物学活性。

图5 重组蛋白的SDS-PAGE分析Fig.5 SDS-PAGE analysis of rSS4-VP2 protein.1: wild baculovirus control; 2−5: Sf-9 cells infected with rBac-SS4-VP2 in the different MOI 0.01, 0.05, 0.1 and 0.5; 6: standard protein marker.

图6 重组蛋白的Western blotting分析Fig.6 Identification of rSS4-VP2 protein by Western blotting.1: standard protein marker; 2−3: Sf-9 cells infected with rBac-SS4-VP2 in the different MOI 0.1 and 0.5; 4: wild baculovirus control.
3.7 间接免疫荧光检测
分别将野生杆状病毒、rBac-SS4-VP2重组杆状病毒感染对数生长期细胞,待细胞完全产生病变后,用 75%乙醇固定细胞做间接免疫荧光,健康细胞Sf-9作对照。重组病毒与猪细小病毒豚鼠阳性血清特异性反应,显微镜下观察可见很强的绿色荧光,而野毒感染细胞只是在病变周围存在很弱的非特异性荧光,健康细胞未检测到荧光(图7)。
3.8 电镜观察鉴定
取重组病毒感染120 h的细胞,戊二醛固定后,制备电镜超薄切片进行电镜观察。发现在细胞中有大量聚集在一起的直径约20~30 nm的球形颗粒,其形态大小均与 PPV的全病毒粒子相近,证实SS4-VP2重组蛋白在杆状病毒表达系统中自我组装成嵌合病毒样颗粒(Chimeric Virus-Like Particles,CVLP)(图8)。
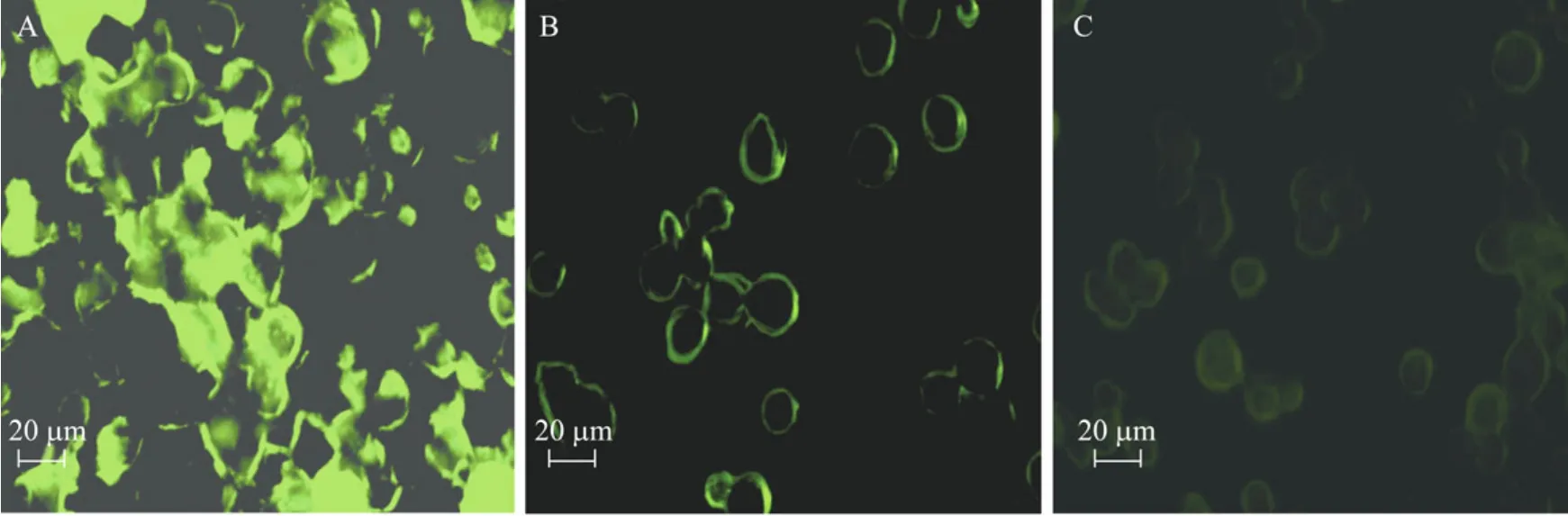
图7 重组病毒的IFA检测Fig.7 Identification of the rSS4-VP2 protein expression by IFA.(A)Cells infected with rBac-SS4-VP2.(B)Cells infected with wild baculovirus.(C)Normal Sf-9 cells.

图8 细胞中形成的病毒样颗粒Fig.8 VLPs in Sf-9 cells.(A)Sf-9 cells infected with rBac-SS4-VP2 through electron microscopy.(B)Sf-9 cells infected with wild baculovirus through electron microscopy.
3.9 猪细小病毒检测试剂盒检测抗体结果
利用试剂盒检测结果,免疫后 1周没有检测到抗体,2周可以检测到抗体但含量偏低,2免后1周抗体逐渐升高,2免后 2周每组抗体明显升高(图9)。从总体的抗体水平来看,2免后2周PPV灭活苗组与重组蛋白组均产生了特异性抗体;从佐剂不同、抗原相同的组来看,抗体水平:Alhydrogel>IMS>CpG+Alhydrogel>CpG+IMS>Oil组,但差异不显著;从佐剂相同、抗原不同的组比较看,抗体水平:PPV Inactivated vaccine>rSS4-VP2>rBac-SS4-VP2>Wild Baculovirus。
3.10 PPV中和抗体的检测结果
利用中和试验检测免疫小鼠血清中和抗体滴度以评价重组病毒免疫后产生的体液免疫反应,2免后2周每组血清中和抗体水平平均值(图10)。在9个免疫组中,rSS4-VP2/Alhydrogel免疫组产生的中和抗体最高;PPV Inactivated vaccine/CpG+Alhydrogel组次之;rSS4-VP2/IMS,rSS4-VP2/CpG+IMS,rSS4-VP2/CpG+Alhydrogel免疫组所产生的中和抗体滴度相当,但稍低于前 2组;rSS4-VP2/Oil最差;Wild Baculovirus /CpG+Alhydrogel与PBS对照组在整个试验中没有检测到任何PPV特异性中和抗体。
3.11 生长抑素抗体ELISA检测结果
间接ELISA检测2免后2周血清生长抑素抗体水平。结果表明:免疫重组蛋白rSS4-VP2/Alhydrogel、rSS4-VP2/IMS、rSS4-VP2/CpG+IMS、rSS4-VP2/CpG+Alhydrogel、rBac-SS4-VP2均产生了特异性抗体,而对照组Wild Baculovirus/CpG+Alhydrogel与PBS组没有特异性抗体产生。rSS4-VP2/Alhydrogel组抗体水平最高,稍高于其他组,其他重组蛋白免疫组间差异不显著(图11)。
3.12 生长激素浓度的检测结果
免疫重组蛋白的各免疫组 GH浓度均有明显升高,rSS4-VP2/Alhydrogel组GH水平最高,其他重组蛋白免疫组间差异不显著,rSS4-VP2/Oil组稍微低一些,但与Wild Baculovirus /CpG+Alhydrogel和PBS对照组相比明显升高(图12)。
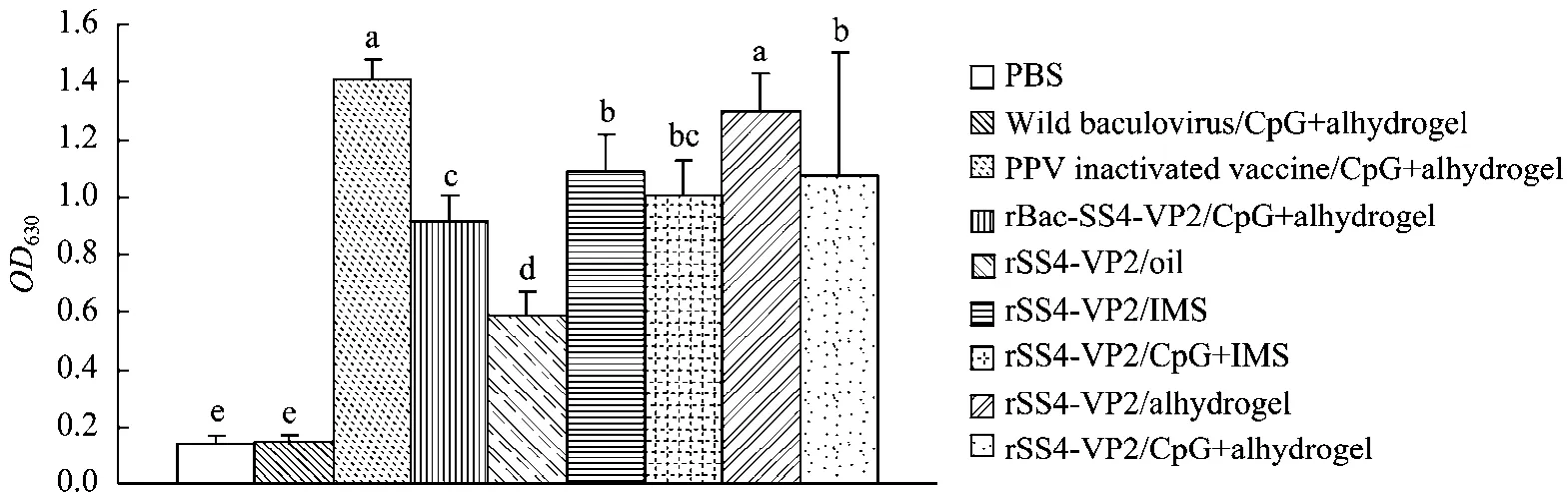
图9 猪细小病毒试剂盒检测抗体Fig.9 Antibody detected by the kit.Values with different letters indicate significant differences(P<0.05).

图10 免疫小鼠PPV特异性中和抗体Fig.10 PPV specific neutralizing antibody detection for the immunized mice.
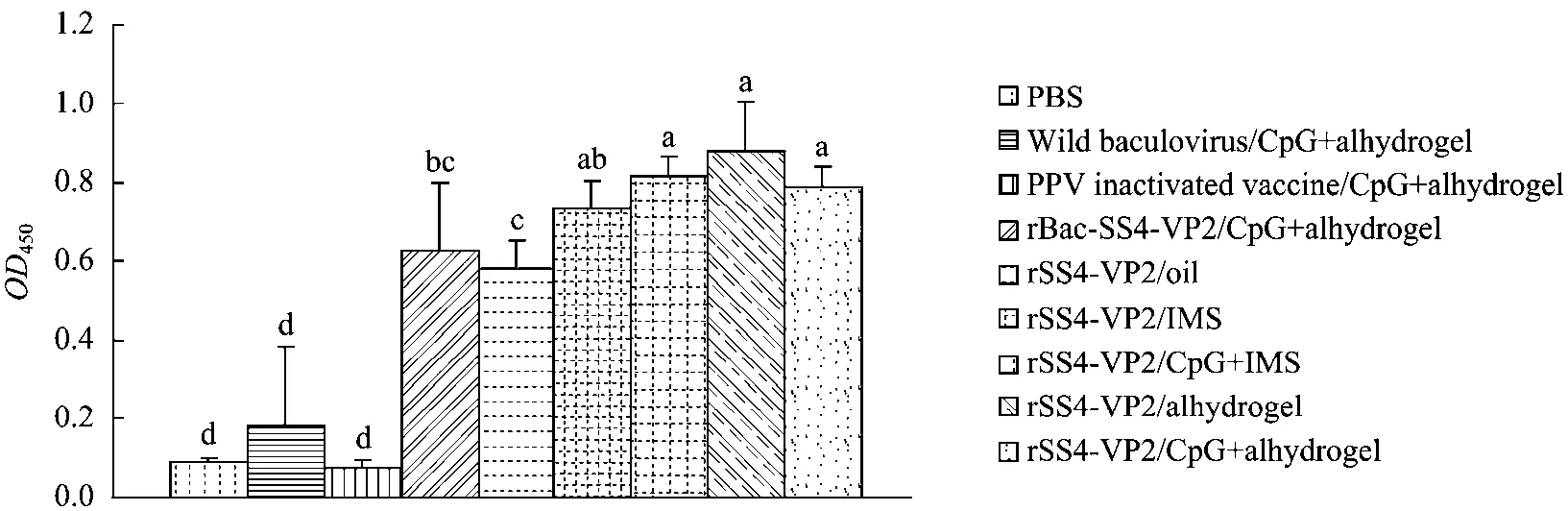
图11 各组小鼠血清生长抑素抗体水平Fig.11 Antibody level in serum of the immunized mice.Values with different letters indicate significant differences(P<0.05).
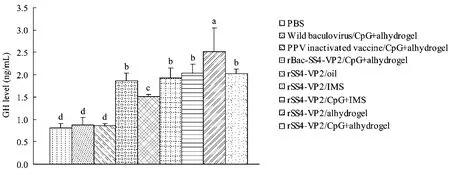
图12 免疫小鼠生长激素水平检测Fig.12 GH level in serum of the immunized mice.Values with different letters indicate significant differences(P<0.05).
4 讨论
猪细小病毒是一种重要的猪繁殖障碍疾病,当前应用较多的是灭活疫苗,但其存在着许多缺陷和不足。猪细小病毒在 PK-15或 ST细胞上增殖的滴度较低,增加了灭活疫苗的生产成本,并且在生产灭活苗的过程中涉及到强毒的繁殖,因此存在散毒的潜在危险;灭活疫苗产生抗体慢,仅能诱发体液免疫应答,不产生或仅产生轻微的细胞免疫应答和局部黏膜免疫应答;灭活疫苗免疫保护时间短,需多次或反复接种,使用剂量大,费用较高;不能产生局部分泌型抗体SIgA,不能阻止病原微生物的局部感染;以及灭活疫苗免疫效果的不稳定等。因此寻找和发展更为安全有效的疫苗一直是猪细小病毒病免疫预防研究的重要内容。猪细小病毒的结构蛋白VP2可自我组装成病毒样颗粒(VLPs),VLPs不仅本身具有良好的免疫原性,而且可以用作载体对半抗原分子进行展示,以提高半抗原的免疫原性。王金良等[14]将VP2全基因进行原核表达,并利用所表达的蛋白建立了检测PPV血清抗体的间接ELISA方法。魏战勇等将PPVVP2基因克隆至pCI-neo真核表达载体中,构建了 pCI-neo-VP2重组质粒,转染至 PK-15细胞中,并以小鼠为动物模型,将pCI-neo-VP2、pCI-neo重组质粒、PPV活疫苗和对照组通过肌肉注射进行免疫,结果显示:pCI-neo-VP2在体外能够诱导 PK-15细胞表达 VP2蛋白,小鼠注射pCIneo-VP2质粒1周后能够诱导机体产生抗体,4周时达到高峰,与活疫苗对照组产生的抗体滴度、诱导T淋巴细胞增殖和诱导强的细胞毒性基本一致。
杆状病毒表达系统具有与动物细胞相似的转录、翻译及翻译后加工等功能,表达的外源蛋白保持原有的生物学活性,迄今已成功地用于表达多种病毒抗原,有些病毒结构蛋白可形成病毒样粒子(Virus-like particles,VLPs)[15-16]。作为一种安全的抗原载体,越来越多的学者将多肽基因与在大肠杆菌、酵母、杆状病毒等不同表达系统中能自我组装成病毒样颗粒的病毒衣壳蛋白基因融合[17-18],以增强多肽的免疫原性。Martinez等[19]将PPVVP2基因克隆至杆状病毒表达系统并在昆虫细胞中高产量表达。表达产物可自我装配成粒子,在结构和抗原性上与常规的PPV衣壳并无差异。将高度提纯的表达产物(类病毒粒子)免疫猪,其免疫效果与商品化的PPV疫苗的相同。Sedlik等[18]证明携带淋巴细胞性脉络丛脑膜炎病毒(LCMV)的CTL表位的PPV VP2自我装配形成的假病毒粒子,免疫动物后,免疫动物能抵抗致死量病毒的攻击。细小病毒的VP2基因可以独立地或者形成杂合的类病毒粒子并引起宿主产生免疫应答[20-21],说明VP2蛋白产生的类病毒粒子具有良好的免疫原性,而且作为一种抗原的转运载体具有很大的潜在价值,为进行多价重组疫苗的研究创造了良好的条件。
SS是动物生长调节的一个重要因子。研究表明,所有哺乳动物 SS的分子结构均相同,无种属特异性。猪免疫生长抑素后不影响猪肉品质,人通过免疫后的猪肉摄入生长抑素或生长抑素的抗体,不会产生副作用,因为生长抑素本身在人体内就是存在的,而生长抑素的抗体在猪肉加工的的过程中将会被破坏,失去活性。并且已有多种文献报道,SS已广泛用于治疗各种人类疾病,具有较好的生物安全性能。
本实验以猪细小病毒VP2蛋白可在杆状病毒表达中自我组装成病毒样颗粒为基础,在VP2基因5′端连接一小段基因不影响装配的特性,将其作为小分子量外源蛋白的运输载体。设计了以PPV的核衣壳蛋白VP2为支架载体,以四拷贝的生长抑素为展示蛋白,试图制备出携带生长抑素的PPV病毒样颗粒,这种展示生长抑素的设计尚属首次。Western blotting、IFA证明了杆状病毒表达的重组蛋白具有生物活性,可以与猪细小病毒阳性血清发生特异性反应;电镜观察发现,在感染重组病毒的Sf-9细胞内含有直径约为20~30 nm、形态大小均与全病毒粒子相似的病毒粒子,也证实了在体外细小病毒能与其他蛋白自我组装成杂合的病毒样颗粒。
为了检测重组蛋白的免疫效力并筛选出能显著增强重组蛋白免疫效力的佐剂,重组蛋白分别辅以铝胶、IMS和白油不同佐剂免疫小鼠,通过猪细小病毒特异性抗体水平,PPV特异性中和抗体水平,生长抑素抗体水平的检测,结果均检测到了特异性抗体;生长激素水平的检测,发现生长激素水平明显提高,证实重组蛋白具有较好的免疫效力。其中铝胶佐剂组抗体水平最高,因其可吸附抗原形成凝聚性大颗粒,易被细胞吞噬而增强抗原的免疫原性;白油佐剂组抗体水平最低,油乳苗产生免疫力慢,抗体空白期长;CpG效果不明显,分析原因可能是CpG主要刺激机体产生细胞免疫;从而筛选出铝胶佐剂是比较适合的佐剂。
本实验得到的细小病毒抗体水平达到了较高的水平。生长抑素相关测定数值整体都稍低,这与免疫动物的日龄、免疫剂量、抗体水平测定时间有很大关系,因动物体内存在SS,不同年龄存在量不同;SS免疫不同动物免疫反应的强弱不同,同种类甚至同群动物中,抗体产生强度和速度也有明显变化。另一方面由于市场上无法买到小鼠生长激素放射免疫分析检测试剂盒,所以本实验用的是人源的生长激素放射免疫分析检测试剂盒,存在着种属差异性,测定值会稍有影响,但对照组与实验组横向比较,数据都明显升高。
总之,重组蛋白在杆状病毒表达系统中形成的杂合病毒样颗粒在小鼠免疫试验中展现了良好的免疫效力,为进一步研究既可预防猪细小病毒病,也能提高猪生长速度的二联疫苗奠定了基础。目前正在进行重组蛋白猪体免疫效力试验。
REFERENCES
[1]Yin Z, Liu JH.Animal Virology.2nd ed.Beijing: Science Press, 1997.殷震, 刘景华.动物病毒学.2版.北京: 科学出版社,1997.
[2]Molitor T, Joo H, Collett M,et al.Porcine parvovirus:virus purification and structural and antigentic properties of virion polypeptides.J Virol, 1983, 45: 842−854.
[3]Choi C, Molitor T, Joo H,et al.Inhibition of porcine parvovirus replication by empty virus particles.Arch Virol, 1987, 96: 75−87.
[4]Martinez C, Dalsgaard K, Lopez de Turiso J,et al.Production of porcine parvovirus empty capsids with high immunogenic activity.Vaccine, 1992, 10: 684−690.
[5]Molitor TW.Identification and characterization of a porcine parvovirus nonstructural poplypetide.J Virol,2002, 55: 554−559.
[6]Sedlik C, Saron MF, Sarraseca J,et al.Recombinant parvovirus-like particles as an antigen carrier: a n-ovel nonreplicative exogenous antigen to elicit protective antiviral cytotoxi T cells.Proc Natl Acad Sci USA, 1997,94(14): 7503−7508.
[7]Adriaan F, Christine J, PAaloma R,et al.A novel recombinant virus-like particle vaccine for prevention of porcine parvovirus-induced reproductive failure.Vaccine,2006, 24(24): 5481−5490.
[8]Pan QX, He KW, Huang KH.Development of recombinant porcine parvovirus-like particles as an antigen carrier formed by the hybrid VP2 protein carrying immunoreactive epitope of porcine circovirus type 2.Vaccine, 2008, 26(17): 2119−2126.
[9]Martine ZC, Dalsqaard K, Lopez de Turiso JA,et al.Production of porcine parvovirusempty capsid with high immunogenic activity.Vaccine, 1992, 10(10): 684−690.
[10]Kim J, Chae C.Concurrent presence of porcine circovirus type 2 and porcine parvovirus in retrospectivecases ofexudative epidermitis in pigs.Vet J, 2004, 167(1):104−106.
[11]Allan GM, Kennedy S, McNeilly F,et al.Experimental reproduction of severe wasting disease by coin-fection of pigs with porcine circovirus and porcine parvovirus.Comp Pathol, 1999, 121(1): 1−11.
[12]Spencer GSG, Garssen GJ.A novel approach to growth promotion using autoimmuneization against smatostatinⅢ,effects in a commercial breed of sheep.Livestock Pro Sci, 1985, 13: 43−52.
[13]Adriaan FG, Christianne JM, Paloma R,et al.A novel recombinant virus-like particle vaccine for prevention of porcine parvovirus-induced reproductive failure.Vaccine,2006, 24: 5481−5490.
[14]Wang JL, Shen ZQ, Tang N,et al.Prokaryotic expression of porcine parvovirus SD1 strain VP2 full gene and development of an indirect ELISA assay with the recombinant protein.Ch J Vet Med, 2008, 44(7): 22−24.王金良, 沈志强, 唐娜, 等.猪细小病毒 PPV-SD1株 VP2全基因原核表达及间接ELISA检测方法的建立.中国兽医杂志, 2008, 44(7): 22−24.
[15]Luckow V, Summers M.Trends in the development of baculovirus expression vectors.Biotechnology, 1988, 6:47−55.
[16]Urakawa T, Ferguson M, Minor P,et al.Synthesis of immunogenic, but non-infectious, poliovirus particles in insect cells by a baculovirus expression vector.J Gen Virol, 1989, 70: 1453−1463.
[17]Casal JI, Rueda P, Hurtado A.Parvovirus-like particles as vaccine vectors.J Virol Methods, 1999, 19: 174−186.
[18]Sedlik C, Jaron M, Sarraseca J,et al.Recombinant parvovtrus-like particles as an antigen carrier: a novel non-replicative exogenous antigen to elicitprotective antiviral cytotoxic T cells.Proc Natl Acad Sci USA,1997,94(14): 7503−7508.
[19]Martinez C, Dalsgaard K, Lopez de Turiso JA,et al.Production of porcine parvovirus empty capsids with high immunogenic activity.Vaccine, 1992, 10: 684−690.
[20]Brown C, Vanlent J, Vlak J,et al.Assembly of empty capsids by using baculorus recombinants expressing human parvovirus B19 structural protein.J Virol, 1991,65: 2702−2706.
[21]Sedlik C, Dadaglio G, Saron M,et al.In vivoinduction of a high-avidity, high-frequency cytotoxic T-lymphocyte response is ssociated with antiviral protective immunity.J Virol, 2000, 74(13): 5769−5775.
Construction and immunogenicity of recombinant porcine parvovirus-like particles with somatostatin
Xuehua Zhang1,2, Qisheng Zheng1, Jin Chen1, Gang Xue1,2, Hongyan Hou1, and Jibo Hou1
1 National Research Center of Veterinary Biological Engineering and Technology, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China 2 Key Laboratory of Animal Disease Diagnosis and Immunology, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, China
Received:December 23, 2009;Accepted:May 17, 2010
Supported by:Construction Projects of National Research Center of Veterinary Biologicals Engineering and Technology(No.4910706), Scientific Research on Public Causes of National Agriculture(No.200803020).
Corresponding author:Jibo Hou.Tel: +86-25-84392008; E-mail: houjibo@jaas.ac.cn国家兽用生物制品工程技术研究中心建设项目(No.4910706),国家农业公益性行业科研专项(No.200803020)资助。

