基于偶联法合成4-(1-萘基)苯硼酸
苏 雨,殷耀兵
(河北工程大学城市建设学院,河北邯郸056038)
金属有机试剂参与的碳-碳键的形成反应在有机化学研究和有机化工生产中占据着非常重要的地位。然而,传统的金属试剂[1]对水和空气敏感,反应条件苛刻且易燃易爆。有机硼试剂[2-3](除了硼氢和硼卤化物外)在通常条件下对空气和水不敏感、无毒、安全,而且容易制备、保存方便,具有良好的官能团兼容性。芳环硼酸是有机硼酸中的典型代表,各种取代芳环硼酸是重要的有机合成中间体及医药、农药中间体。对于各种取代芳环硼酸的合成研究,最早起于20世纪50年代左右,此后对它们的应用研究日益增多。黄世文等[4]采用“一锅法”合成了多种芳环硼酸,其中苯硼酸分离产率 48%,α-噻吩基硼酸分离产率55%。安忠维,陈新兵[5]也报道了多环芳烃类单取代硼酸的“一锅”合成方法,产率达40%~60%。Tatsuo Ishiyama.等[6]首次提出钯催化氧硼基化法制备芳基硼酸酯,产率可达60%~98%,并且反应物带有的各种官能团如硝基、氰基、酯基和羰基不受影响。
目前,已研制出来的芳环硼酸种类有数百种之多,4-(1-萘基)苯硼酸作为其中的一员,主要被用作开发新一代有机发光材料的原料,市场价格已高达每公斤10 000元人民币。然而,至今还没有关于4-(1-萘基)苯硼酸合成工艺的报道,所以,其合成工艺的研究很有实用价值。本文以对溴苯胺和1-溴萘为原料,研究了经由重氮化反应[7]、格氏反应、Suzuki偶联法[8]和丁基锂试剂法[9]四步反应合成4-(1-萘基)苯硼酸的工艺,并探讨了影响反应的各种因素。
1 实验部分
1.1 仪器和试剂
NMI20-Analyst核磁共振分析仪(上海纽迈电子科技公司),GC-2014气相色谱仪(日本岛津公司)和LC-2010HT高效液相色谱仪(日本岛津公司)。主要化学试剂为对溴苯胺、亚硝酸钠、碘化钾、1-溴萘、硼酸三甲酯、四-(三苯基膦)钯[Pd、丁基锂、硼酸三异丙酯等,所有试剂均为分析纯。
1.2 实验方法
1)对溴碘苯的合成。将86g对溴苯胺溶于147g浓硫酸,倒入盛有碎冰的烧杯中,0~5℃下,依次缓慢加入 37g亚硝酸钠和少量尿素,过滤。5~20℃下,将滤液滴加到盛有83g碘化钾饱和溶液的三口烧瓶中,反应2h,冷却后过滤。产品用甲苯溶解,浓硫酸、亚硫酸氢钠各洗2遍,碳酸钠和硫酸钠干燥,过滤,滤液旋蒸浓缩,析晶,得 80g对溴碘苯晶体。
2)1-萘硼酸的合成。在三口烧瓶中依次加入14g镁屑和150ml四氢呋喃,少量溴乙烷引发反应。60~65℃下滴加103.5g1-溴萘,反应1.5h即制得格氏盐。另取一三口烧瓶,依次加入61g硼酸三甲酯和150ml甲苯,在 T<10℃下,向其中滴加格氏盐,加完后自然升温,反应1h。然后保持温度20℃,加入盐酸溶液调节pH<2。过滤,分液,有机层用水洗涤,旋蒸浓缩得1-萘硼酸固体,将其碱洗后调至酸性,过滤,乙酸乙酯结晶,得50.6g1-萘硼酸晶体。
3)4-(1-萘基)溴苯的合成。将对溴碘苯、1-萘硼酸、碳酸钾、N,N-二甲基甲酰胺、水、Pd(Pph3)4依次加入到三口烧瓶中,85℃下反应,薄层色谱(TLC)和气相色谱(GC)监控反应进程。反应结束后加水搅匀,甲苯萃取,过滤,分液,有机层旋蒸浓缩至无溶剂蒸出,然后进行减压蒸馏,收集180~190℃的馏分。
4)4-(1-萘基)苯硼酸的合成。将4-(1-萘基)溴苯和四氢呋喃依次加入三口烧瓶中,氮气保护,-80~-70℃下,依次滴加丁基锂试剂和硼酸三异丙酯。滴完,自然升温至0℃后酸化,调节pH<2。反应完过滤,分液,有机层旋蒸浓缩,蒸出一半溶剂后用二乙醇胺处理,酸化,过滤,烘干得27.6g产品。
2 结果与分析
2.1 对溴碘苯合成工艺分析
重氮化合成对溴碘苯是整个制备工艺的第一步,是多步合成反应取得成功的关键。取对溴碘苯用四氢呋喃溶解后进气相检测,其谱图表明第一个峰为溶剂峰,出峰时间在1~2min之间;产品峰在6.668min出现,其含量为98.5%。本步产品收率为56.5%。结果说明,重氮化反应收率高,产品纯度好,为后续反应打下了良好的基础。
由于重氮化是放热反应,反应速率相当快,而且重氮盐不稳定。因此重氮化时浓硫酸需过量2倍,防止生成的重氮盐与未反应的芳胺偶合,生成不可逆的重氮氨基化合物。此外,必须保持亚硝酸稍过量,以免引起自我偶合反应,通常为理论用量的102%~105%,重氮化以后,过剩的亚硝酸钠常加入尿素或氨基磺酸分解。
2.2 1-萘硼酸合成工艺分析
高效液相色谱(HPLC)谱图中在产品峰前面有一些小杂质峰,总含量为 0.13%;产品峰在5.520min出现,含量为 99.8%;产品峰后面在13min和17min也有两个杂质峰,总含量为0.07%。产品收率为58.8%。分析结果说明,第二步合成的收率高,产品纯度非常好。
在格氏反应中,格氏试剂不稳定,遇水易分解。所以卤代烃与其他溶剂必须不含水,所用的仪器也必须完全干燥;而在反应时,应隔绝空气,以避免它与空气中的水蒸气、氧气和二氧化碳接触发生分解。此外,1-溴萘的格氏盐在低温时极易析出,实验时应保持在较高温度下滴加格氏盐。
2.3 4-(1-萘基)溴苯合成工艺分析
GC谱图中有 5个小的杂质峰,分别在3.803min、8.178 min、9.243 min、9.960 min 和11.892min出现,其总含量约为1.89%;产品峰在10.798min出现,其含量为98.11%。产品收率为83.3%。产品纯度稍差,但是收率比较高。
本工艺采用对溴碘苯作为反应原料,它的纯度对这一步的影响颇大。当用95%的对溴碘苯反应时,在产品峰附近(9~10min之间)存在很大的杂质峰,严重影响了产品的后处理和收率。而用对二溴苯代替对溴碘苯进行偶联时,产品产率不足60%。
2.4 4-(1-萘基)苯硼酸合成工艺分析
4-(1-萘基)苯硼酸HPLC谱图分析如下:产品峰在2.959min出现,含量为99.4%;其前面有若干小杂质峰,含量约为0.32%;后面有2个杂质峰,含量为0.28%。产品收率74.2%。产品纯度非常好,收率也比较高。
其核磁共振分析(见图1)谱图中化学位移δ=2~3出现的峰为未被氘代的水中的氢;δ=3.69的峰为二甲基亚砜上未被氘代的氢;芳环上的氢在δ=7~9之间出现,对该区域进行积分可计算出这个区间的氢的个数比为4:1:6,共11个氢,而4-(1-萘基)苯硼酸芳环上的氢正好是11个。
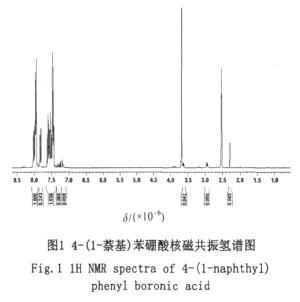
4-(1-萘基)苯硼酸的后处理采用与二乙醇胺成酯的方法,一般的碱处理提纯方法不适用,而且二乙醇胺的用量最好是1:1(理论)的比例,过量太多的二乙醇胺会影响后续工作。
3 结论
1)以对溴苯胺和1-溴萘为原料,经重氮化、格氏反应、Suzuki偶联和丁基锂试剂法四步反应,合成了4-(1-萘基)苯硼酸。
2)通过1H NMR、GC和HPLC分析方法表征了合成的中间物和产物,产品纯度高达99.4%,总收率为20.5%。
3)各步反应操作简单,重现性好,为4-(1-萘基)苯硼酸的工业化生产提供了依据。
[1] 麻生明.金属参与的现代有机合成反应[M] .广州:广东科技出版社,1999.
[2] MIYAURA N,SUZUKI A.Palladium-catalyzed crosscoupling reaction of organoboron compounds[J] .Chem Rev,1995,95(7):2457-2483.
[3] FAGNOU K,LAUTENS M.Rhodium-catalyzed carbon?carbon bond forming reactions of organometallic compounds[J] .Chem Rev,2003,103(1):169-196.
[4] 黄世文,单自兴,赵德杰.“一锅法”简便合成一芳基硼酸和二芳基硼酸[J] .有机化学,1995,15(1):64-67.
[5] 安忠维,陈新兵.多环芳烃类单取代硼酸的合成研究[J] .精细化工,2000,17(5):297-298.
[6] ISHIYAMA T,MUR ATA M,MIYAURA N.Palladium(0)-catalyzed cross-coupling reaction of alkoxydiboron with haloarenes:A direct procedure for arylboronic esters[J] .Org Chem,1995,60(23):7508-7510.
[7] 段行信.实用精细有机合成手册[M] .北京:化学工业出版社,2000.
[8] 周少林,徐利文,夏春谷,等.Suzuki偶联反应的最新研究进展[J] .有机化学,2004,2(12):1501-1512.
[9] 王积涛,宋礼成.金属有机化学[M] .北京:高等教育出版社,1989.

