柳穿鱼黄酮类成分的提取工艺优化
兰洲,田铁辉,关红峰,华会明,刘晓秋*
(1.沈阳药科大学中药学院,辽宁 沈阳 110016;2.沈阳药科大学高职学院,辽宁 沈阳 110032)
柳穿鱼黄酮类成分的提取工艺优化
兰洲1,田铁辉2,关红峰1,华会明1,刘晓秋1*
(1.沈阳药科大学中药学院,辽宁 沈阳 110016;2.沈阳药科大学高职学院,辽宁 沈阳 110032)
目的:优化柳穿鱼中黄酮类成分的提取工艺。方法:采用正交试验方法,以分光光度法测定总黄酮的含量和HPLC法测定柳穿鱼苷的含量为指标,确定柳穿鱼中黄酮类成分的提取工艺。结果:最佳提取工艺为80%乙醇8倍量,回流提取2次,每次1 h。结论:此提取工艺合理可行,为柳穿鱼的进一步研究提供参考。
柳穿鱼;黄酮;提取工艺;分光光度法;HPLC
柳穿鱼为玄参科(Scrophlariaceae)植物柳穿鱼Linaria vulgarissubsp.sinensis(Bebeaux)Hong的干燥全草。具有清热解毒,散瘀消肿之功效。该植物的化学成分有黄酮类[1]、环烯醚萜苷类[2]、生物碱类[3]、三萜类[4]等。民间主要用于黄疸、头痛、头晕、痔疮便秘、皮肤病和烫伤[5]。其主要成分为黄酮类化合物,具有抗炎、降血压、抗癌、镇痛等多种药理活性[6-9]。黄酮类成分中含有柳穿鱼苷、蒙花苷、乙酰蒙花苷、柳穿鱼苷元、刺槐素、木犀草素、香叶木素、白杨素[1],其中柳穿鱼苷为黄酮类的主要成分[10-12]。目前,尚没有关于柳穿鱼黄酮提取工艺的报道,本文以HPLC测定柳穿鱼苷的含量和分光光度法测定总黄酮的含量为指标,通过正交设计优选黄酮类成分的提取工艺,为柳穿鱼的开发和合理利用提供依据。
1 仪器与材料
UV-2100紫外分光光度计(日本岛津公司),RE5-CS旋转蒸发器(上海亚荣生化仪器厂),SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司),高效液相色谱仪(LC-10Atvp泵、DAD检测器、CLASS-VP工作站,日本Shimadzu公司)。Diamonsil ODSC18色谱柱(250 mm×4.6 mm,5μm,北京迪马科技公司)。
柳穿鱼药材于2008年9月采自哈尔滨江北郊区,经内蒙古医学院乔俊缠教授鉴定为柳穿鱼Linaria vulgarissubsp.sinensis(Bebeaux)Hong的干燥全草。柳穿鱼苷(本实验室自制,纯度为99.2%)。柳穿鱼苷对照品(纯度质量分数>98%,自制),乙腈(色谱纯,天津康科德科技有限公司),甲醇(色谱纯,天津康科德科技有限公司),纯净水(杭州娃哈哈集团有限公司),其他试剂(分析纯,市售)。
2 方法与结果
2.1 分光光度法测定总黄酮的含量
2.1.1 对照品溶液的制备 取柳穿鱼苷对照品约5 mg,精密称定。加80%乙醇制成每1 mL含0.212 mg的溶液,作为对照品溶液。
2.1.2 供试品溶液的制备 取药材约0.5 g,精密称定,置50 mL量瓶中,用80%乙醇稀释至刻度,精密吸取上清液1mL,置25mL量瓶中,用80%乙醇稀释至刻度,摇匀,即得。
2.1.3 测定波长的选择 精密量取供试品溶液和对照品溶液适量,在200~400 nm对供试品溶液和对照品溶液扫描,供试品和对照品均在330 nm处有最大吸收,故确定330 nm为测定波长。
2.1.4 标准曲线的绘制 分别精密吸取 “2.1.1”项下的柳穿鱼苷对照溶液 0.2,0.4,0.5,0.6,0.7 mL,加80%乙醇至10mL,摇匀,于330 nm波长处测定吸光度。以吸光度(A)为纵坐标,对照品量(X)为横坐标绘制标准曲线,得回归方程A=4.450×10-2X+8.500×10-3,r=0.999 1(n=5)。表明柳穿鱼苷在4.24~14.84μg·mL-1呈良好的线性关系。
2.1.5 精密度试验 取同一批药材约0.5 g,精密称定,按 “2.1.2”制备供试品溶液。取溶液分别在330 nm波长处重复测定5次,测得5次吸光度平均值为0.306,RSD=1.0%。表明仪器精密度良好。
2.1.6 稳定性试验 取 “2.1.5精密度试验”项下的供试品溶液,在0,2,4,8,12 h测定吸光度,测得5次吸光度平均值为0.309,RSD=1.5%,表明样品溶液在12 h内基本稳定。
2.1.7 重复性试验 分别取同批药材6份,各约0.5 g,精密称定,按 “2.1.2”制备供试品溶液。取溶液分别在330 nm波长处测定吸光度,计算总黄酮的含量,测得平均含量为2.8%,RSD=2.6%。表明重复性良好。
2.1.8 加样回收率试验 取已知含量的1号药材粉末约0.25 g,精密称定,加入适量的柳穿鱼苷对照品约3.7 mg。按 “2.1.2”制备供试品溶液。取溶液在330 nm下测定吸光度,计算总黄酮含量,平均回收率为98.9%,RSD=3.0%。
2.1.9 样品的测定 取3批药材适量,按照“2.1.2”制备供试品溶液,测定吸光度,根据回归方程计算药材中总黄酮的量,结果发现,总黄酮的含量分别为2.92%,2.91%,2.81%。
2.2 HPLC测定柳穿鱼苷的含量
2.2.1 供试品溶液的制备 取药材约0.5 g,精密称定,置50 mL量瓶中,加体积分数为80%的乙醇50 mL,加热回流30 min,滤过,取滤液10 mL,浓缩至5 mL,经0.45μm微孔滤膜滤过,即得供试品溶液。
2.2.2 样品的测定 取 “2.2.1”项下供试品溶液,按照文献[13]所建立的HPLC方法,对柳穿鱼苷进行含量测定。结果表明,3批药材柳穿鱼苷的含量分别为1.52%,1.50%,1.45%。
2.3 正交试验因素水平的确定
根据单因素分析结果和实际情况,对提取时间(A)、提取次数(B)、溶剂倍量(C)及乙醇浓度(D)4个因素进行考察,每个因素选择3个水平,采用L9(34)正交表安排试验,以柳穿鱼中总黄酮和柳穿鱼苷含量为考察指标,因素水平安排见表1。
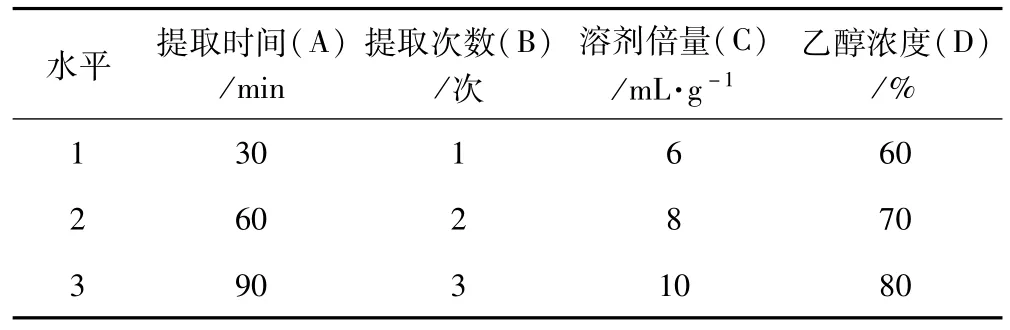
表1 柳穿鱼总黄酮提取工艺正交试验因素水平表
2.4 正交试验结果
按照 “2.1”项下及 “2.2”项下方法操作,以总黄酮和柳穿鱼苷含量为指标,计算结果及进一步的方差分析分别见表2和表3。
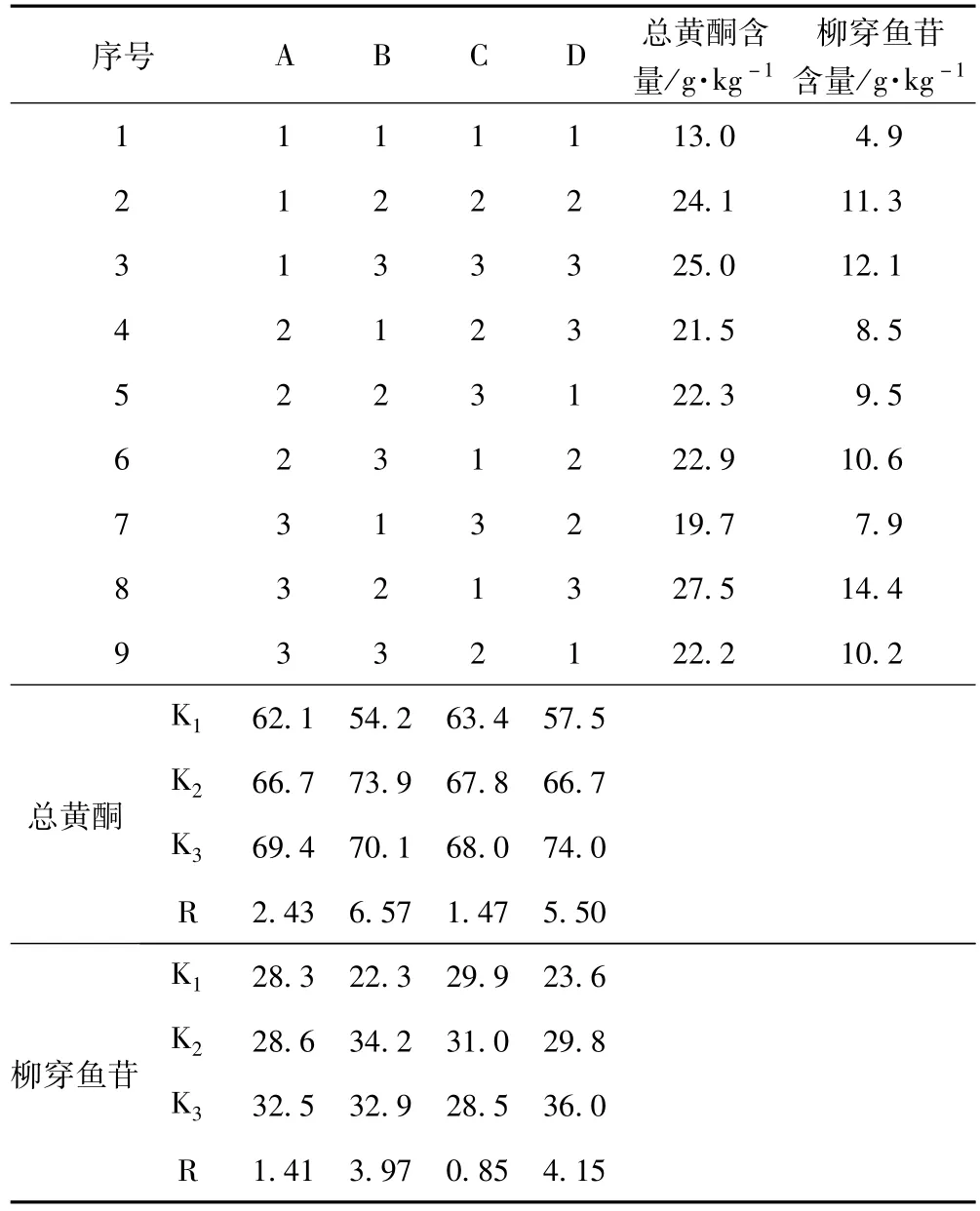
表2 正交试验结果
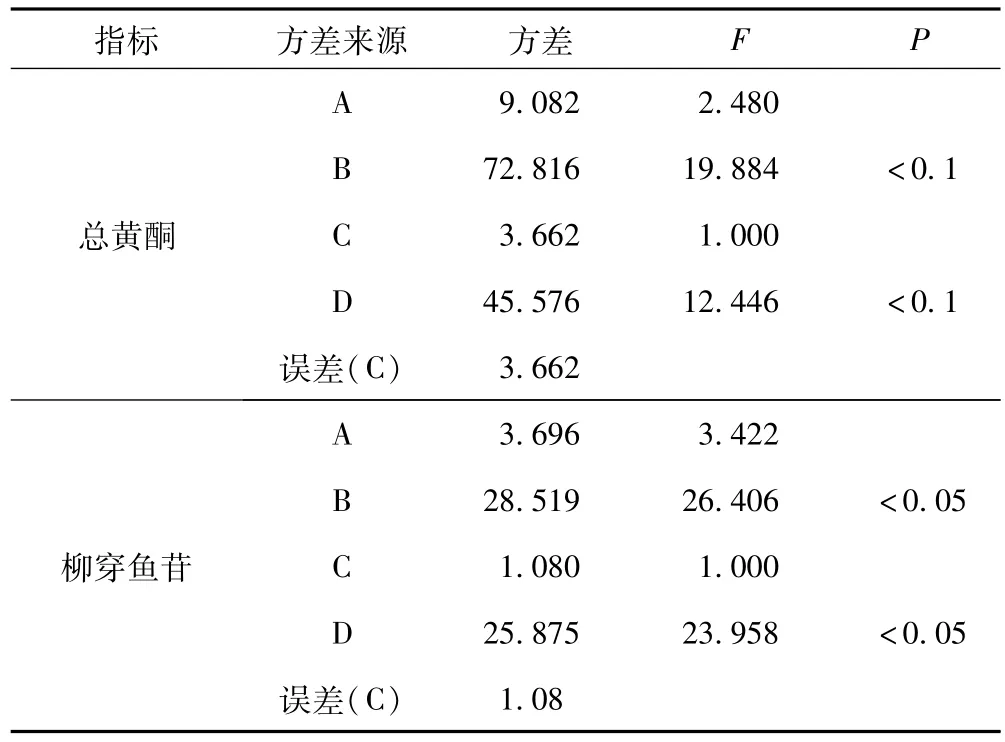
表3 方差分析表
由表2直观分析结果表明,以总黄酮成分含量为指标,各因素对指标成分的提取率的影响依次为B>D>A>C,最佳工艺为A3B2C3D3;以柳穿鱼苷的含量为指标,各因素对指标成分的提取率的影响依次为D>B>A>C,最佳工艺为A3B2C2D3。
由表3方差分析结果表明,B因素(提取次数)和D因素(乙醇浓度)对总黄酮提取率有影响(P<0.1),对柳穿鱼苷的提取率则有显著性影响(P<0.05)。而A因素(提取时间)和C因素(溶剂倍量)因素的影响不大,对于A因素,结合直观分析可选择A2(60 min);对于C因素(溶剂倍量),从节约溶剂的角度考虑,可选择C2(8倍量)。最后确定工艺工艺为A2B2C2D3。
2.5 试验结果验证
取3份药材各约10 g,精密称定。按A2B2C2D3提取,即80%乙醇8倍量回流提取2次,每次1 h,测得的总黄酮与柳穿鱼苷量分别为23.8,9.2 g·kg-1;25.5,11.7 g·kg-1;24.6,10.5 g·kg-1;与预测值基本一致,结果表明该提取工艺较合理。
3 讨论
根据文献报道,柳穿鱼中主要的黄酮类成分为柳穿鱼苷、蒙花苷、乙酰蒙花苷、刺槐素和柳穿鱼苷元等,紫外最大吸收波长分别都在270 nm和330 nm附近,而其中环烯迷萜苷类、生物碱类和三萜类成分在此波长下均无紫外吸收,因此对总黄酮及柳穿鱼苷的测定均不产生干扰。
柳穿鱼中主要的黄酮类成分柳穿鱼苷、蒙花苷等在水、甲醇及乙醇中溶解性较差,而易溶于热甲醇和热乙醇中,因此采用加热回流提取法进行回流提取。
[1]华会明,孙军,李铣.柳穿鱼黄酮成分的研究[J].中药材,1999,30(5):332-334.
[2]Esposito P,ScarpatiM L.IridoidⅨ 10-O-β-glucosil-aucubia dallaLinaria vulgaris[J].Gazz Chim Ital,1970,100:836-845.
[3]华会明,朴奉花,王素贤,等.柳穿鱼新生物碱的研究[J].沈阳药科大学学报,1997,14(3):219.
[4]华会明,侯柏玲,李文,等.柳穿鱼中三萜类化合物的研究[J].中草药,2000,31(6):409-412.
[5]江苏新医学院.中药大辞典(下册)[M].上海:上海人民出版社,1977:1526.
[6] Esther Del Olmo, Arturo San Feliciano.Chem ical Constituents of Linaria aucheri[J].Turk JChem,2004,28:133-139.
[7]Hyun LIM,Kun Ho SON,Hyeun Wook CHANG,et al.Anti-inflammatory Activity of Pectolinarigenin and Pectolinarin Isolated fromCirsium chanroenicum[J].Biol.Pharm.Bull,2008,31:2063-2067.
[8]Rosa Tundis,Brigitte Deguin,Monica R.Loizzo,et al.Potential antitumor agents:Flavones and their derivatives fromLinaria reflexaDesf[J].Med.Chem.Lett,2005,15:4757-4760.
[9]Monica Rosa Loizzoa,Rosa Tundis,Federica Menichini,et al.Acetyl-cholinesterase Inhibition by Extracts and Isolated Flavones fromLinaria reflexaDesf.(Scrophulariaceae)[J].Nat.Prod.Com,2007,2:759-763.
[10]VALDE’S B.Flavonoid pigments in flower and leaf of the genusLinaria(Scrophulariaceae)[J].Phytochem,1970,9:1253-1260.
[11]Hua Huim ing,Cheng Maosheng,Li Xian,et al.A new phyrroloquinazoline alkaloid fromLinaria vulgaris[J].Chem Pharm Bull,2002,50(10):1393-1394.
[12]EMI IA I,NEDJALKA H,SIMEON S.Iridoid glucosides fromLinaria vulgaris[J].Phtochem,1992,31(3):1040-1041.
[13]关宏峰,刘晓秋,兰洲,等.HPLC法同时测定中药柳穿鱼中柳穿鱼苷和橙皮苷的含量[J].沈阳药科大学学报,2009,26(2):119-122.
Optimization of Extraction Process of Flavonoids from Linaria Vulgaris
Lan Zhou1,Tian Tiehui2,Guan Hongfeng1,Hua Huiming1,Liu Xiaoqiu1
(1.School of Traditional Chinese Materia Medica,Shenyang Pharmaceutical University,Shenyang Liaoning110016,China;2.Higher Vocational Technology College of Shenyang Pharmaceutical University,Shenyang Liaoning110032,China)
Objective:To optimize the conditions for extraction of flavonids fromLinaria vulgaris.Methods:The extraction conditions were studied by the orthogonal design with the content of total flavonoids and pectolinarin as indexes.Results:The optimum conditions were as follows Adding 8 times amount of 80%(V∶V)ethanol,and extracting for two times,1 h each times.Conclusion:The optimized method is reasonable and feasible for flavonids fromLinaria vulgarisssp.sinensis,and can provide a reference for further research.
Linaria vulgaris;Flavonoids;Extraction process;Spectrophotometry;HPLC
*刘晓秋,E-mail:liuxiaoqiu3388@tom.com
2010-05-18)

