微生物细胞工厂中多基因表达的控制策略
姜天翼,李理想,马翠卿,许平
1 山东大学 微生物技术国家重点实验室,济南 250100
2 上海交通大学 微生物代谢教育部重点实验室,上海 200240
细胞工厂的优化
微生物细胞工厂中多基因表达的控制策略
姜天翼1,李理想1,马翠卿1,许平2
1 山东大学 微生物技术国家重点实验室,济南 250100
2 上海交通大学 微生物代谢教育部重点实验室,上海 200240
微生物代谢工程和合成生物学是当今微生物技术领域研究的热点,微生物的生长速度快、容易进行大规模培养;遗传背景清楚、遗传操作简便可靠等性质使其在与人类生活相关的多个领域中起到重要的作用。微生物细胞工厂是指人工设计的能够进行物质生产的微生物代谢体系。许多微生物细胞工厂的构建由于引入多个基因或整条代谢途径,而可能导致代谢失衡、部分代谢中间产物积累等问题,需要使用一定的调控策略加以控制。以下对涉及多个基因作用的微生物细胞工厂中所使用的调控策略,分为若干层次进行了总结和探讨,并对今后多基因控制策略的发展方向进行了预测与展望。
微生物细胞工厂,代谢工程,多基因表达,基因表达调控
Abstract:Microbial metabolic engineering and synthetic biology are important disciplines of microbial technology nowadays.Microbial cells are fast growing, easy to be cultivated in large scale, clear in genetic background and convenient in genetic modification. They play an important role in many domains. Microbial cell factory means an artificial microbial metabolic system that can be used in chemical production. The construction of a microbial cell factory needs transferring of multiple genes or a whole metabolic pathway, which may cause some problems such as metabolism imbalance and accumulation of mesostates. This review focuses on the regulation strategies of different levels involving simultaneous engagement of multiple genes. Future perspectives on the development of this domain were also discussed.
Keywords:microbial cell factory, metabolic engineering, expression of multiple genes, gene expression regulation
微生物是自然界中结构最为简单、研究最为深入,而应用潜力十分巨大的物种。人类利用微生物进行工业生产具有悠久的历史,其产物从传统的酒、醋等食品已经延伸到现在的燃料、医药、化工制品等与人类社会息息相关的各个领域。传统的微生物应用方法为从自然界中按照一定的要求直接筛选,或再通过诱变方法得到目的菌株或菌群即加以应用。然而由于微生物的结构简单,其自身所拥有的生产能力往往达不到较好的应用效果。随着分子生物学技术的不断发展,微生物代谢工程应运而生。1991年,Bailey JE将代谢工程定义为“采用重组DNA技术,操纵细胞的酶、运输及调节功能,达到提高或改善细胞活性的目的”[1]。代谢工程为微生物“细胞工厂”绘制出了重要的蓝图[2],微生物细胞逐渐被开发为一种“可编程的”装置 (‘Programmable’entities),其改造方法由单一的过表达或失活某种酶发展成为新式的、由工程设计所导向的对细胞组件进行整体规模上的改造,以及以简单的组件为基础构建精细的代谢系统[3]。因此,在现代的细胞工厂构建工程中,往往要引入多个基因甚至整套的代谢途径,并要使其在宿主中最大化行使其功能。通过代谢工程构建含多个外源基因的微生物细胞工厂已被应用在多种物质的生产中,如萜类化合物[4-5]、聚酮类化合物[6-8]、生物塑料制品[9]、非核糖体多肽[10]、聚合物模块[11]等。
1 重组代谢途径中多基因表达所存在的问题
虽然在微生物中构建含有外源合成途径的细胞工厂以生产复杂化合物及医药制品是一种替代化学合成方法的理想途径,但这一方法还是存在着重大的缺陷:即在将较复杂的代谢途径转移的过程中,其原本的代谢流调控机制往往无法再发挥作用[5]。自然的代谢调控是一系列十分严谨的过程 (如正、负反馈调节),在进化过程中往往会形成某种代谢物“恰到好处”的合成方式 (‘Just enough’synthesis)。然而,人工构建合成途径的代谢流量通常远远高过自然代谢途径的代谢流量,过高的外源表达会与宿主本身的代谢过程竞争包括核苷酸、氨基酸在内的各种资源,这些资源可能是宿主用于自身的增殖,甚至是目的产物的合成[12]。同时,过高的外源表达量会诱发宿主的一系列反应,例如压力反应 (Stress response)、严谨反应 (Stringent response)、热激反应(Heat shock response)等[13-15],这些反应会导致多种特殊基因的转录,抑制细胞正常蛋白的合成,质粒不稳定、细胞的裂解和细胞遗传信息的改变,并最终会导致构建的细胞工厂无法按照预先设计的方式进行工作[16]。另一方面,引入外源代谢途径虽然能够移除某些限制代谢流量的调控位点,但其中各步酶反应的代谢流量难以保持平衡,这种失衡也是影响总体生产能力的重要制约因素。某些中间代谢物,尤其是细胞毒性物质的大量积累会严重影响宿主细胞正常的运转,从而导致生产效率的下降[17]。为了避免上述一系列情况的发生,在细胞工厂的构建过程中,对外源代谢途径的总体流量以及各个酶反应效率的平衡加以有效地控制是十分重要的。当代的代谢工程研究已经为协调多基因表达提供了多个层次的策略,包括转录水平的控制、翻译水平的控制、以及使用一些特殊的附加装置进行控制等[3,12]。
2 控制多基因表达的策略
2.1 针对DNA转录过程的控制策略
对转录过程的控制方法主要集中在对于启动子的研究方面。协调多个外源基因表达最简单、最直接的途径是对不同的基因使用不同的诱导型启动子,如使用Plac启动子控制第 1个基因的表达,而用PBAD启动子控制第2个基因的表达。Van Dien SJ等通过在大肠杆菌宿主中分别使用Ptac启动子和PBAD启动子控制编码多磷酸盐激酶 (PPK) 的基因和编码多磷酸盐酯酶 (PPX) 的基因,能够在不同的培养时期添加相应的诱导剂分别启动 2个基因的表达。通过这一控制方法,该课题组对于微生物中磷酸盐和能量的储存以及多聚磷酸盐的作用进行了深入的研究[18-19]。利用多个启动子的方法虽然设计简单,但是具有严重缺陷:首先,反应体系需要添加多种诱导剂,在代谢途径中设计的环节较多时,不可避免地会使用到价格昂贵的物质,大大增加了生产成本;第二,较多的诱导剂添加过程会增加反应过程的复杂性,从而降低细胞工厂体系生产中的稳定性;第三,多种诱导剂的添加可能会引起交互作用 (Cross-talk),限制了许多启动子组合的应用[20-21]。
基于上述缺点,研究者希望能够通过一种诱导物质同时诱导多个基因以不同的强度表达,最先被考虑到的方法是对启动子进行改造。多种方法被应用于对启动子的筛选及人工改造。构建启动子库是一种获得多种使用相同诱导剂而强度不同的启动子的有效方法,该方法也可被称为“启动子工程”,其理论基础是保持调控蛋白结合位点序列不变,通过改变启动子−10区和−35区的保守序列或者其间的若干个碱基,可将启动子的强度调整至不同的水平[16]。Nevoigt等使用随机突变构建出一个酿酒酵母Saccharomyces cerevisiae中的DAN1启动子库,并使用多级流式细胞术筛选出溶氧敏感性的启动子,细胞在生长过程中对氧气的消耗即可诱导启动子的启动[22]。对于启动子−10和−35保守区碱基的突变会使启动子的强度发生较大的变化,而对两者之间碱基进行突变对启动子强度的影响较小,适合于更加精细的对启动子进行改造[23]。Jensen等通过保持保守序列不变,而随机突变之间的分隔区域,构建了乳酸乳球菌Lactococcus lactis中的启动子库,筛选得到了38个突变的启动子,其启动强度从0.3个单位到 2 000个单位不等。更值得注意的是,所获得启动子强度的增强并非跳跃式的,而是逐步升高[24]。通过构建这一类启动子库,可以选择合适的启动子对不同蛋白质的表达水平进行更加精细的控制,这对细胞工厂的设计将会起到重要的帮助作用。构建启动子库的方法可以使细胞工厂体系中所有的基因由同一种诱导剂进行诱导,并且不用顾及诱导剂的加量而使各个基因按照合适的水平进行表达。但是其构建的过程往往较为困难,并且对于一条代谢途径进行控制时,必须首先对各个步骤酶的活性进行复杂的优化以确定选用何种强度的启动子进行控制[20]。
除了针对启动子的选择和改造以外,还有其他的方法可以对转录过程进行控制。Khlebnikov 等通过添加可以独立地对于诱导剂的运输进行控制的基因,限制诱导剂进入细胞的过程,构建了一套阿拉伯糖诱导的可调控表达系统[25]。使用外源的RNA聚合酶或者转录因子,同样可以在单个细胞的水平对基因表达进行控制[20]。微生物基因组中的σ因子是RNA聚合酶的亚基之一,其变化可以改变启动子对于RNA聚合酶的选择性,影响转录水平,从而可以对转录组进行总体水平上的控制[26-28]。Stephanopoulos课题组通过随机突变大肠杆菌中的σ70因子,同时改变了多个基因的调控并进行优化,增加了外源构建的番茄红素生产途径的代谢产量及宿主的抗逆性[29]。
2.2 针对mRNA翻译过程的控制策略
传统的在翻译水平对于基因表达的控制是由突变核糖体结合位点以增强或减弱翻译起始的水平实现的,而现在已经发展出更加先进的方法,包括使用人工的核酶、核糖开关 (Riboswitch) 等感应组件、人工构建操纵子并改变操纵子基因间序列(Intergenic region)、构建基因间序列库等。
生物体中的许多mRNA含有一种称为核糖开关的调控装置,该装置是一类具有复杂折叠结构的RNA 结构域,位于 mRNA 的 5′非翻译区 (5′Untranslated regions, 5′UTRs),在其寡核苷酸适配子部分 (Aptamers) 与特定的小分子物质结合的情况下,通过使mRNA发生某些结构变化而影响mRNA翻译的起始、延伸等过程,从而调节基因的表达水平[30]。相对于在特定蛋白的帮助下与mRNA结合的小RNA (MicroRNAs, miRNAs) 和干扰RNA (Short interfering RNAs, siRNAs) 调控方式,每一个核糖开关与一种特定的简单物质 (抗生素、代谢产物等) 相应的结合即可行使其功能,而不需要辅助蛋白质参与这一调节过程[31]。并且,如果通过体外人工筛选获得可识别细胞代谢物的适配子[32],则可设计出根据细胞自身的代谢状况调节基因表达的系统,故核糖开关被认为能够比启动子更精确地调节基因表达和优化代谢途径[16]。在细胞工厂的设计方案中,可以通过添加人工构建的核糖开关对基因的表达进行控制。人工构建的核糖开关主要有通过插入适配子进行调控,通过促使 RNA螺旋移动的方式进行调控,通过反义RNA进行调控等几种方式[31]。其中,人工选择合适适配子插入mRNA的调控方法只有在真核细胞中的应用报道,如哺乳动物细胞[33]、酵母[34-35]等,而在微生物中难以加以应用。这是因为插入的适配子只有位于核糖体结合区域和翻译起始密码子之间才能发挥作用,而原核生物的核糖体结合位点 (SD序列) 与起始密码子在空间上是紧密偶联的,两者之间的距离不能超过13个核苷酸。除非能够筛选出新型的适配子,一般意义上的适配子无法插入到这么短的一段距离内[31]。利用RNA螺旋移动的方式进行调控是一种原核细胞适用的调控策略,即在目标mRNA的SD序列之前添加含双结构域的元件,阻碍核糖体小亚基与 SD序列结合,当特定配体与适配子结构域结合时,会造成另一个结构域——桥状结构域发生滑动,使该元件整体远离SD序列,核糖体得以结合上去,从而使翻译起始[36]。反义RNA调控同样可以在微生物中加以应用,其方式是通过一小段人工插入的 RNA序列 1与原始mRNA的 SD序列形成颈环结构,阻碍核糖体的结合,而通过另一小段额外转录的非编码RNA序列2高特异性地结合RNA序列1,可以解除其与SD序列的结合,颈环结构消失,翻译得以起始[37]。在细胞工厂的设计中,合理地加入不同类型的核糖开关组件,可以达到控制多个基因的差异水平表达的效果,甚至是与细胞代谢情况密切相关的表达控制。
在微生物中,多亚基蛋白或是一条代谢途径中的多个酶通常位于一个由单个启动子控制的操纵子中,而操纵子通过某些机制改变转录物稳定性或者翻译起始能力,以协调这些基因的表达水平。这种调控方式为在mRNA水平上人工控制多基因差异水平表达提供了另一种思路,即将多个基因构建在一个操纵子中,再对操纵子中基因间的序列进行改造,引入mRNA的二级结构或者RNA酶作用位点等调整mRNA的性质,从而影响基因的表达水平。该种方法可以在使用一个启动子、一种诱导剂的作用下实现多种蛋白的差异水平表达。Keasling课题组对这种控制策略进行了较为系统的研究。该课题组在大肠杆菌宿主中尝试使用经过系统设计的操纵子基因间序列进行调控,将编码绿色荧光蛋白的gfp基因和编码半乳糖苷酶N端的lacZ基因依次置于一个操纵子中,而将两段编码区中间设计一段特殊的序列,在初始mRNA上5′端至3′端依次结构为:gfp基因-发夹结构-RNA 酶 E酶切位点-发夹结构-lacZ基因-发夹结构,在其加工过程中该段序列会被RNA酶剪切为两段单独的 mRNA,而通过加入的发夹结构影响两段 mRNA各自的稳定性,使用不同的RNA酶E酶切位点以及发夹结构,可以将2种酶的酶活控制在不同的比例[38]。如果将2个编码基因gfp和lacZ的位置互换,同时分别使用上述控制策略,能够使两者的酶活相差更大[39]。然而,上述方法也存在着缺陷。首先,同启动子的诱导剂一样,多种转录后的调控元件会有交互作用,如mRNA降解影响转录,而转录状况的变化又有可能加速mRNA的降解[40];其次,上述方法只能将2个基因的相对活性控制在少数几个固定的水平,因此在实际的代谢途径构建中难以设计出能将相对比例控制在合适水平的组件。为了克服这些缺陷,该课题组构建了一个可调节基因间序列 (Tunable intergenic regions, TIGRs) 库,通过PCR将4组寡核苷酸序列随机组合,得到了 104个基因间序列,这些序列包括不同mRNA二级结构、RNA酶剪切位点、核糖体结合位点抑制序列等的组合。再经过转化子筛选,得到的可调节基因间序列库可以将2个基因编码蛋白的活性比例在1∶1到1∶100的范围内改变。通过选择合适的序列,他们优化了在大肠杆菌中构建的甲羟戊酸合成途径,并成功地将其产量提高了7 倍[41]。
2.3 应用支架蛋白质的控制策略
在细胞工厂的构建过程中,相比于基因水平上的改造,在蛋白质层次上对于代谢途径的平衡和控制较为困难,因为蛋白质的定向进化或修饰是一项相当复杂的工作,虽然具有理论上的可能性,比如通过改造调整代谢关键步骤酶的酶活,使构建的代谢途径达到平衡,但其实验的设计、操作都具有较高的难度。而另一种针对蛋白质的特殊调控策略研究正在逐渐开展起来,即使用人工合成的支架蛋白质 (Scaffold proteins) 对代谢途径中的各个组件进行模块化的控制 (Modular control)。支架蛋白本身是一种存在于生物信号转导系统中的辅助蛋白,在空间上将该系统中的多个蛋白组织到一起,形成一个复合物[42-43]。Bashor等报道了使用酵母中改造的Ste5支架蛋白对酵母接合MAP激酶途径进行调整,在自然状态下,酵母中的Ste5支架蛋白将3个接合MAP激酶途径中的蛋白整合在一起,而该工作在Ste5上额外添加了一个碱性亮氨酸拉链结合位点,再通过添加装有酸性亮氨酸拉链的正/负调节剂(Modulators),即可以将该途径的代谢通量上调或者下调[44]。自然存在的支架蛋白质只限应用于其固有的信号途径中,相应的改造同样应用十分局限,但以其原理为基础,也可以构建出完全根据需要而人工设计的支架蛋白质原件。Keasling课题组在该领域同样有突出的贡献,他们针对在大肠杆菌中构建的甲羟戊酸代谢途径设计了一个支架蛋白组件,该蛋白由3个不同的配基组成,而在该代谢途径的3个酶上各添加一个相应的配体,通过该支架的作用,可以将 3个酶同时固定在一个复合物中。如果将支架蛋白质的 3个配基设定为不同的数量,则可以在同一支架上固定不同数量的 3种酶,以此可以调整 3个酶的数量的比值。该设计方案不仅可以优化代谢途径中多个酶的化学计量数比,平衡途径中各个环节的流量,还可以缩短各个酶之间的空间距离,起到“底物通道”(Substrate channeling) 的效果,使中间代谢产物传递距离更短,与细胞环境的接触更少而避免扩散和降解。在这些特点共同的作用下,甲羟戊酸的产量成功地提高了 77倍[12]。人工设计的支架蛋白质对于多基因表达的控制虽然精密、高效、应用范围广,但是其设计和实施同样较为复杂,实施的难度较高,目前类似的工作报道很少。
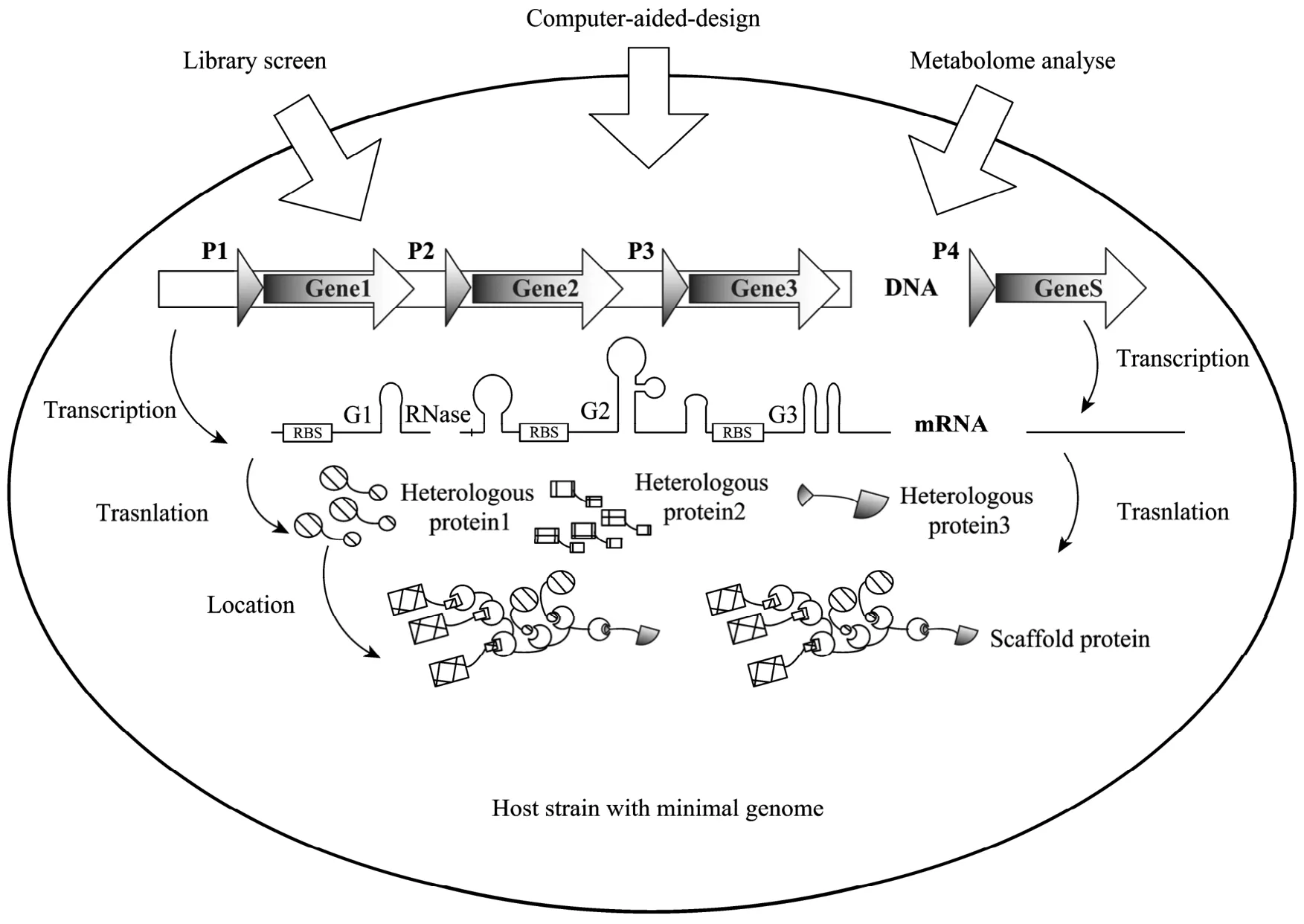
图1 微生物细胞工厂中多基因表达调控方式总览[12,20]Fig.1 Overview of the regulation strategies for multiple genes expression in microbial cell factory[12,20].
3 结论与展望
微生物细胞工厂的设计是精细而复杂的,然而随着代谢工程、合成生物学等相关研究工作的不断深入,已经为这项工作提供了越来越多的服务平台。各种文库如启动子文库、核糖开关文库、基因间序列文库等的构建极大地方便了对于多基因的控制,设计者只需要选择合适的元件组合到目标外源代谢途径中,即可以平衡各个基因的表达水平,甚至精确地控制各个酶数量和活性的相对值。目前,研究者进一步认识到,除了自身的平衡问题以外,一条外源代谢途径的植入会在代谢网络的层次上对宿主菌株产生许多干扰[45],而以生物信息学、基因芯片技术、功能基因组、转录组、蛋白质组学等为辅助,解决工程菌株整体代谢网络中存在的问题,构建更加高效和复杂的细胞工厂系统已经成为研究的新热点,对于多基因代谢途径控制的研究已逐渐从模块化的组件水平上升至完整的系统水平。计算机辅助工具以及专用代谢模拟工具的出现和完善将会进一步为含有多个外源基因细胞工厂体系的设计提供强有力的支持,但是相关的开发工作仍处于起步阶段,并且难度较大。因为微生物细胞即使相对于自然界中其他的生命体系较为简单,其对于计算机编程来说仍然还是一个十分复杂的系统。一个可行的方向是构建只含有最小基因组(Minimal genome)[46]的宿主菌株,最大程度地减少宿主本身代谢的复杂性,简化计算机模拟程序的设计。相信在不久的将来,将有越来越多设计精密、含有更多更复杂的基因而控制又更加方便的细胞工厂系统,能够为人类社会作出巨大的贡献。
REFERENCES
[1] Bailey JE. Toward a science of metabolic engineering.Science, 1991, 252(5013): 1668−1675.
[2] Li Y, Cao ZA. Microbial metabolic engineering: gateway to develop blueprints for cell factories.CIESC J, 2004,55(10): 1573−1580.
李寅, 曹竹安. 微生物代谢工程: 绘制细胞工厂的蓝图.化工学报, 2004, 55(10): 1573−1580.
[3] Purnick PE, Weiss R. The second wave of synthetic biology: from modules to systems.Nat Rev Mol Cell Biol,2009, 10(6): 410−422.
[4] Martin VJ, Pitera DJ, Withers ST,et al. Engineering a mevalonate pathway inEscherichia colifor production of terpenoids.Nat Biotechnol, 2003, 21(7): 796−802.
[5] Pitera DJ, Paddon CJ, Newman JD,et al. Balancing a heterologous mevalonate pathway for improved isoprenoid production inEscherichia coli.Metab Eng, 2007, 9(2):193−207.
[6] Peiru S, Menzella HG, Rodriguez E,et al. Production of the potent antibacterial polyketide erythromycin C inEscherichia coli.Appl Environ Microbiol, 2005, 71(5):2539−2547.
[7] Murli S, Kennedy J, Dayem LC,et al. Metabolic engineering ofEscherichiacolifor improved 6-deoxyerythronolide B production.J Ind Microbiol Biotechnol, 2003, 30(8): 500−509.
[8] Pfeifer BA, Admiraal SJ, Gramajo H,et al. Biosynthesis of complex polyketides in a metabolically engineered strain ofE. coli.Science, 2001, 291(5509): 1790−1792.
[9] Aldor IS, Keasling JD. Process design for microbial plastic factories: metabolic engineering of polyhydroxyalkanoates.Curr Opin Biotechnol, 2003, 14(5): 475−483.
[10] Watts KT, Mijts BN, Schmidt-Dannert C. Current and emerging approaches for natural product biosynthesis in microbial cells.Adv Synth Catal, 2005, 347(7/8): 927−940.
[11] Nakamura CE, Whited GM. Metabolic engineering for the microbial production of 1,3-propanediol.Curr Opin Biotechnol, 2003, 14(5): 454−459.
[12] Dueber JE, Wu GC, Malmirchegini GR,et al. Synthetic protein scaffolds provide modular control over metabolic flux.Nat Biotechnol, 2009, 27(8): 753−759.
[13] Wick LM, Egli T. Molecular components of physiological stress responses inEscherichia coli.Adv Biochem Eng Biotechnol, 2004, 89: 1−45.
[14] Harcum SW, Bentley WE. Heat-shock and stringent responses have overlapping protease activity inEscherichia coli. implications for heterologous protein yield.Appl Biochem Biotechnol, 1999, 80(1): 23−37.
[15] Gill RT, Valdes JJ, Bentley WE. A comparative study of global stress gene regulation in response to overexpression of recombinant proteins inEscherichia coli.Metab Eng,2000, 2(3): 178−189.
[16] Wang JS, Qi QS. Synthetic biology for metabolic engineering-a review.Chin J Biotech, 2009, 25(9):1296−1302.
王俊姝, 祁庆生. 合成生物学与代谢工程. 生物工程学报, 2009, 25(9): 1296−1302.
[17] Zhu MM, Lawman PD, Cameron DC. Improving 1,3-propanediol production from glycerol in a metabolically engineeredEscherichia coliby reducing accumulation ofsn-glycerol-3-phosphate.Biotechnol Prog, 2002, 18(4): 694−699.
[18] Van Dien SJ, Keasling JD. Optimization of polyphosphate degradation and phosphate secretion using hybrid metabolic pathways and engineered host strains.Biotechnol Bioeng, 1998, 59(6): 754−761.
[19] Van Dien SJ, Keyhani S, Yang C,et al. Manipulation of independent synthesis and degradation of polyphosphate inEscherichia colifor investigation of phosphate secretion from the cell.Appl Environ Microbiol, 1997,63(5): 1689−1695.
[20] Keasling JD. Synthetic biology for synthetic chemistry.ACS Chem Biol, 2008, 3(1): 64−76.
[21] Lee SK, Chou HH, Pfleger BF,et al. Directed evolution of AraC for improved compatibility of arabinose- and lactose-inducible promoters.Appl Environ Microbiol,2007, 73(18): 5711−5715.
[22] Nevoigt E, Fischer C, Mucha O,et al. Engineering promoter regulation.Biotechnol Bioeng, 2007, 96(3):550−558.
[23] Jensen PR, Hammer K. Artificial promoters for metabolic optimization.Biotechnol Bioeng, 1998, 58(2/3): 191−195.
[24] Jensen PR, Hammer K. The sequence of spacers between the consensus sequences modulates the strength of prokaryotic promoters.Appl Environ Microbiol, 1998,64(1): 82−87.
[25] Khlebnikov A, Risa O, Skaug T,et al. Regulatable arabinose-inducible gene expression system with consistent control in all cells of a culture.J Bacteriol,2000, 182(24): 7029−7034.
[26] Owens JT, Miyake R, Murakami K,et al. Mapping the sigma70subunit contact sites onEscherichia coliRNA polymerase with a sigma70-conjugated chemical protease.Proc Natl Acad Sci USA, 1998, 95(11): 6021−6026.
[27] Siegele DA, Hu JC, Walter WA,et al. Altered promoter recognition by mutant forms of the sigma 70subunit ofEscherichia coliRNA polymerase.J Mol Biol, 1989,206(4): 591−603.
[28] Gardella T, Moyle H, Susskind MM. A mutantEscherichia colisigma 70subunit of RNA polymerase with altered promoter specificity.J Mol Biol, 1989,206(4): 579−590.
[29] Alper H, Stephanopoulos G. Global transcription machinery engineering: a new approach for improving cellular phenotype.Metab Eng, 2007, 9(3): 258−267.
[30] Mandal M, Breaker RR. Gene regulation by riboswitches.Nat Rev Mol Cell Biol, 2004, 5(6): 451−463.
[31] Bauer G, Suess B. Engineered riboswitches as novel tools in molecular biology.J Biotechnol, 2006, 124(1): 4−11.
[32] Bayer TS, Smolke CD. Programmable ligand-controlled riboregulators of eukaryotic gene expression.Nat Biotechnol, 2005, 23(3): 337−343.
[33] Werstuck G, Green MR. Controlling gene expression in living cells through small molecule-RNA interactions.Science, 1998, 282(5387): 296−298.
[34] Grate D, Wilson C. Inducible regulation of theS.cerevisiaecell cycle mediated by an RNA aptamer-ligand complex.Bioorg Med Chem, 2001, 9(10): 2565−2570.
[35] Berens C, Thain A, Schroeder R. A tetracycline-binding RNA aptamer.Bioorg Med Chem, 2001, 9(10):2549−2556.
[36] Suess B, Fink B, Berens C,et al. A theophylline responsive riboswitch based on helix slipping controls gene expressionin vivo.Nucleic Acids Res, 2004, 32(4):1610−1614.
[37] Isaacs FJ, Dwyer DJ, Ding C,et al. Engineered riboregulators enable post-transcriptional control of gene expression.Nat Biotechnol, 2004, 22(7): 841−847.
[38] Smolke CD, Carrier TA, Keasling JD. Coordinated,differential expression of two genes through directed mRNA cleavage and stabilization by secondary structures.Appl Environ Microbiol, 2000, 66(12): 5399−5405.
[39] Smolke CD, Keasling JD. Effect of gene location, mRNA secondary structures, and RNase sites on expression of two genes in an engineered operon.Biotechnol Bioeng,2002, 80(7): 762−776.
[40] Deana A, Belasco JG. Lost in translation: the influence of ribosomes on bacterial mRNA decay.Genes Dev, 2005,19(21): 2526−2533.
[41] Pfleger BF, Pitera DJ, Smolke CD,et al. Combinatorial engineering of intergenic regions in operons tunes expression of multiple genes.Nat Biotechnol, 2006, 24(8):1027−1032.
[42] Pawson T, Scott JD. Signaling through scaffold,anchoring, and adaptor proteins.Science, 1997, 278(5346):2075−2080.
[43] Burack WR, Shaw AS. Signal transduction: hanging on a scaffold.Curr Opin Cell Biol, 2000, 12(2): 211−216.
[44] Bashor CJ, Helman NC, Yan S,et al. Using engineered scaffold interactions to reshape MAP kinase pathway signaling dynamics.Science, 2008, 319(5869): 1539−1543.
[45] Kizer L, Pitera DJ, Pfleger BF,et al. Application of functional genomics to pathway optimization for increased isoprenoid production.Appl Environ Microbiol, 2008,74(10): 3229−3241.
[46] Posfai G, Plunkett GR, Feher T,et al. Emergent properties of reduced-genomeEscherichia coli.Science, 2006,312(5776): 1044−1046.
Strategies for regulating multiple genes in microbial cell factories
Tianyi Jiang1, Lixiang Li1, Cuiqing Ma1, and Ping Xu2
1State Key Laboratory of Microbial Technology,Shandong University,Jinan250100,China
2MOE Key Laboratory of Microbial Metabolism,Shanghai Jiao Tong University,Shanghai200240,China
Received:May 24, 2010;Accepted:July 19, 2010
Supported by:National Natural Science Foundation of China (No. 30770064), National Basic Research Program of China (973 Program) (No.2007CB707803).
Corresponding author:Cuiqing Ma. Tel: +86-531-88364003; Fax: +86-531-88369463; E-mail: macq@sdu.edu.cn
国家自然科学基金 (No. 30770064),国家重点基础研究发展计划 (973计划) (No. 2007CB707803) 资助。

