猪胸膜肺炎放线杆菌PCR检测方法的建立
马晓平,曹三杰,文心田,肖国生,杨 利,陈华美,张雪峰
(四川农业大学动物医学院动物传染病与基因芯片实验室,四川省动物疫病与人类健康重点实验室,四川雅安 625014)
猪传染性胸膜肺炎(Infectious p leuropneumonia of sw ine,IPPS)是由胸膜肺炎放线杆菌(Actinobacillus p leuropneumonia,App)引起的一种以胸膜炎、肺炎和肺脏的充血、出血、坏死以及纤维素性黏连为特征的传染病,患猪表现为高度呼吸困难,因急性败血症而突然死亡;感染后存活的育肥猪生长缓慢,平均日增重下降,饲料报酬低,耐过种猪因带菌往往成为潜在的传染源[1-2]。该病已成为危害养猪业最严重的疾病之一,及时、快速、准确地诊断该病以便采取相应的措施,是成功控制该病的关键[3]。对该病的诊断有血清学方法和病原学方法,A pp共有15个血清型,而且各型之间没有很好的交叉反应,因而影响血清学方法检出的准确性[4-5]。病原学方法主要采用细菌分离培养,再通过培养特性和一系列的生化特性进行鉴定,费时费力。这些传统的诊断方法或准确性较差,或费时费力,常延缓对该病的准确诊断,耽误疫情的控制,造成严重损失。因此,建立一种灵敏度高、特异性好、快速准确的诊断方法已成为迫切的需要。
国内外科技工作者在建立的PCR方法中主要以APXⅣ基因序列和OLMA基因序列设计引物,也取得了很好的效果[6-8],但以dsbE-like基因序列设计引物建立的PCR方法还未见报道。
1 材料与方法
1.1 材料
1.1.1 菌株 标准菌株App 1-4、App 6-10型;猪多杀性巴氏杆菌标准菌株(5:A和6:B型;大肠埃希菌(K 88株)和链球菌(Ⅱ型)均购自中国兽医药品监察所,由四川农业大学动物医学院动物传染病与基因芯片实验室保存。
1.1.2 分离菌株 重庆某猪场分离菌株,编号为MC、ME和MH。经血清学鉴定为猪传染性胸膜肺炎放线杆菌(App)。
1.1.3 培养基 PPLO培养基购自北京天坛生物制品有限公司(批号:040508);月示蛋白胨(批号:20030525)、胰蛋白胨(批号:20030425)和大豆胨(批号:20030522)均为北京奥博星生物技术责任有限公司生产;NAD(批号:20031217)为Sigm a公司产品;供体马血清(EQUINE SERUM DEFINED,批号:SH 30074.02)为Sigma公司产品;微量生化实验试管购自杭州天和微生物试剂有限公司;TSA培养基、兔血巧克力培养基、兔血琼脂培养基、普通营养琼脂培养基、麦康凯琼脂培养基等。
1.1.4 主要试剂 Taq(5 U/μL)、dNTPs、MgCl2、10×PCRbu ffer(Mg2+)MgCl2(25mmol/L)、2 000 bp DNA Ladder M arker均购自宝生物工程(大连)有限公司(批号:20041023)。
1.2 方法
1.2.1 引物设计与合成 根据已发表的dsbE-like基因序列,应用Oligo(7.0)设计一对特异性引物,引物 为 :App dsbE-2L:5′-GCTTCCA TACTTGCCTTATTCG-3′;AppdsbE-2R:5′-TCGGTTGATCGGAATAGGTAAG-3′。由北京三博远志生物科技有限公司合成,用ddH2O按25μmol/L稀释,置-20℃保存备用。
1.2.2 菌株培养 各菌株接种于含有0.1mL/L NAD(烟酰胺腺嘌呤二核苷酸)和100 mL/L马血清的PPLO液体培养基,37℃200 r/min摇床震荡培养24 h。
1.2.3 基因组DNA的提取 将猪胸膜肺炎放线杆菌标准菌株、分离株、大肠埃希菌(K 88)、巴氏杆菌(5:A)纯培养菌液10 000 r/min离心5 min,弃上清液,用无菌水溶解沉淀后,沸水中水浴10 min后冰浴冷却,10 000 r/min离心5min,取上清液为制作模板[7-8]。
1.2.4 PCR 扩增 5μL 10×PCR buffer、4μL 25 mmol/L MgCl2、4 μL 2.5 mmol/LdNTPS、25μmol/L上下游引物各1 μL、0.3 μL 5 U/μL Taq酶、5μL模板、29.7μL无菌水,总体积为 50μL。PCR反应条件为:94℃变性4 min;94℃35 s,60℃35 s,72℃35 s,35个循环后72℃延伸10 min;4℃保存。
1.2.5 PCR扩增产物的琼脂糖凝胶电泳 取6μL扩增产物和5μL 2 000 bp DNA Ladder M arker,在含EB的10 g/L琼脂糖凝胶板的点样孔中点样,电压50 V,电流400 mA,电泳50min,以凝胶成像系统分析扩增结果。
1.2.6 特异性试验 分别用上述方法制备App、大肠埃希菌、巴氏杆菌和链球菌标准菌株的模板,以建立的检测方法分别进行PCR扩增,验证建立的PCR检测App方法的特异性[9]。
1.2.7 敏感性试验 将App标准菌株接种PPLO液体培养基,37℃水浴振荡培养24 h,以平板计数法测定细菌浓度。将菌液1~10-10稀释后,制备模板,分别取1μL摸板进行PCR扩增,检验PCR检测方法的敏感性。
1.2.8 重复性试验 对App 1-4、App 6-10型标准菌株,分别进行5次PCR扩增,检验PCR方法的重复性。
1.2.9 PCR对分离株的检测 分别制备了A pp分离菌株的DNA摸板,以建立的检测方法分别进行PCR扩增。
2 结果
2.1 PCR检测App的特异性试验
经PCR扩增,App标准株(血清1-4,6-10型)均能扩增出大小约374 bp大小的DNA特异性片段;而猪巴氏杆菌、大肠埃希菌、链球菌的扩增结果均为阴性(图1和图2)。特异性试验结果表明试验建立的PCR检测App的方法具有特异性。
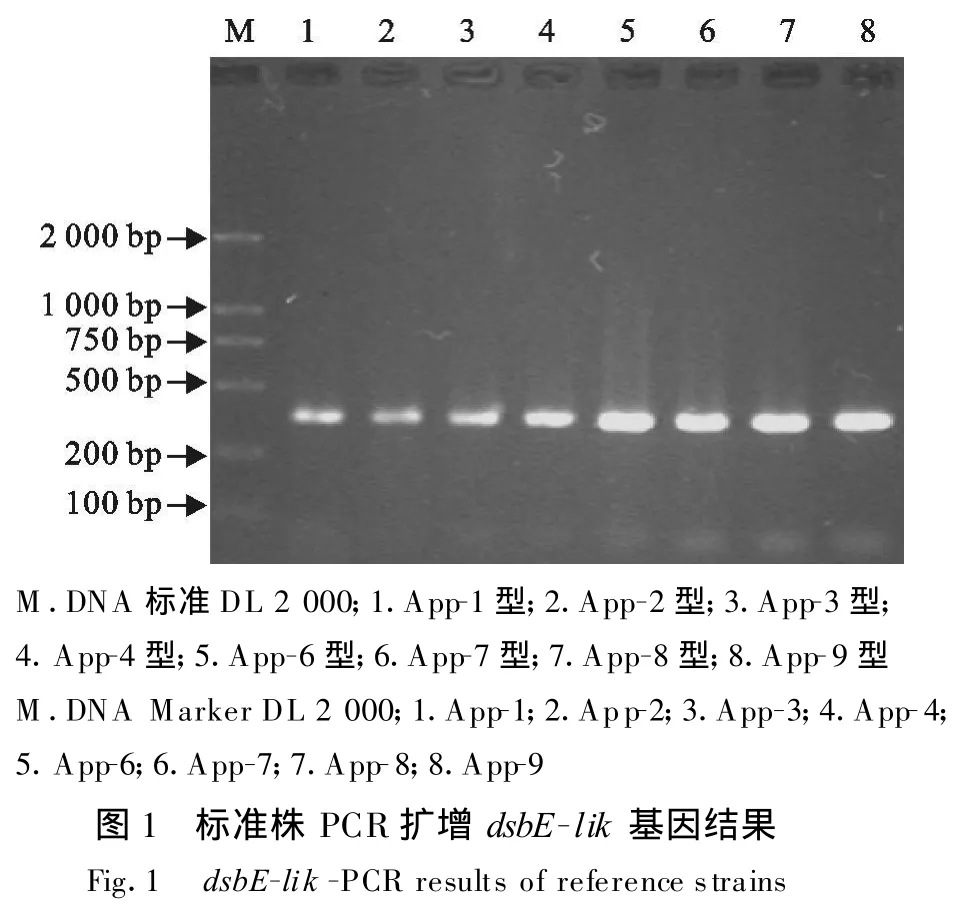

2.2 敏感性试验
建立的PCR检测App敏感性试验结果表明,该方法对App菌液最低检出浓度为71 cfu/mL。
2.3 重复性试验
对App 1-4、A pp 6-10型标准菌株,分别进行5次PCR扩增,均能够扩增出目的DNA条带,试验结果表明建立的App PCR检测方法具有较好的检测重复性。
2.4 分离株的检测
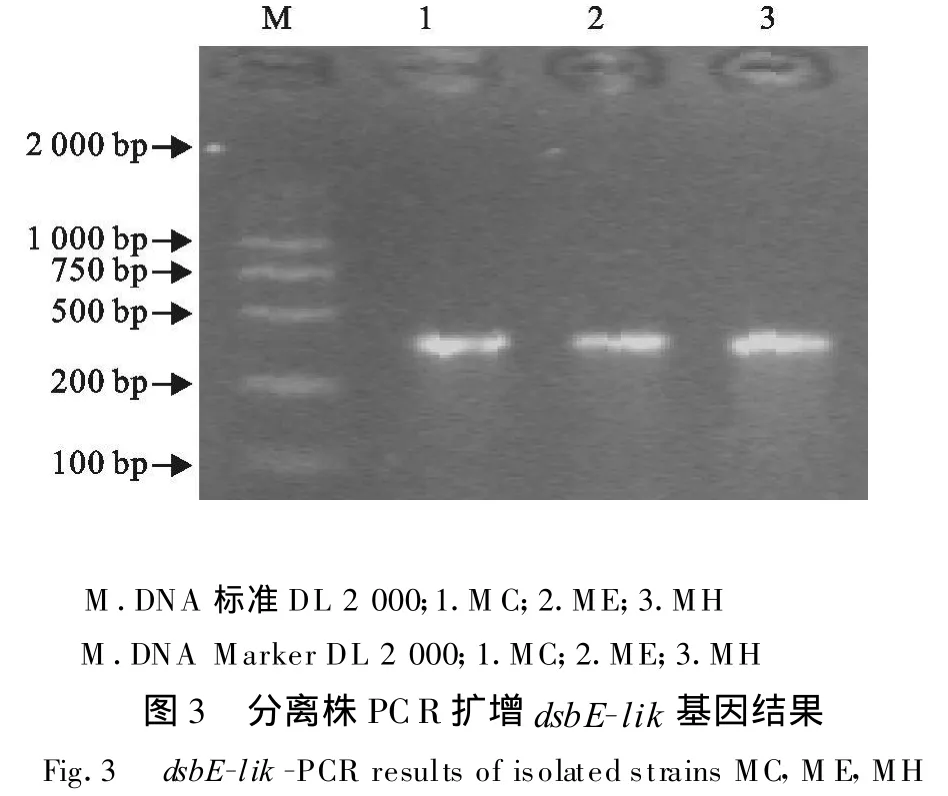
PCR检测方法对试验分离的MC、ME、MH株进行了检测,均可扩增出大小约374 bp的DNA条带(图3),表明建立的PCR检测方法用于分离App菌的检测。
3 讨论
试验参考Chiers K等[10]介绍的方法,设计了一对可扩增374 bp片段的特异性引物。成功的从9个标准株和3个分离株中扩增出特异性的目的DNA片段,而巴氏杆菌、大肠埃希菌和链球菌均为阴性,对App菌液最低检出浓度为71 cfu/mL。表明本检测方法对App具有特异性和敏感性。
在PCR反应体系中,模板DNA的用量可以在1μL~10μL之间变化,这取决于细菌的浓度[11];本试验用煮沸法制备模板[11],比用其他方法制备模板简单、快捷,但沸水中水浴后一定要离心,否则会有“拖尾”现象出现。
建立的PCR诊断方法,避免了血清学方法可能产生的交叉反应现象。但是PCR作为一种病原学诊断方法均有自身的局限性[12-13]。本方法虽能检测出所有的血清型,但不能将菌株分型[14]。只有把病原学和血清学方法结合起来,才能对本病的血清型做出确切的诊断[15-16]。
国内外已经建立了很多以A pp、ApxⅠ、ApxⅡ、ApxⅢ、ApxⅣ以及Omp等某一DNA片段为目的基因的PCR诊断方法。但是与App相近的一些种属也存在着这些目的基因或者是差别极小,在进行PCR扩增的时候,可能会出现假阳性,造成误诊[5,11,17]。
[1]马晓平,彭广能,曹三杰,等.猪传染性胸膜肺炎放线杆菌病的初步分离鉴定与诊治体会[J].中国兽医杂志,2008,44(2):75-76.
[2]杨旭夫,彭发泉.我国猪胸膜肺炎嗜血杆菌感染的确定和诊断[J].畜牧兽医学报,1990,21(3):243-245.
[3]徐公义,王海丽,葛长城,等.鲁西地区猪胸膜肺炎放线杆菌流行病学调查[J].安徽农业科学,2009,37(13):6002-6004.
[4]马晓平,曹三杰,文心田.猪传染性胸膜肺炎病原特性及其诊断方法研究进展[J].动物医学进展,2005,26(5):6-9.
[5]Gram T,Ahrens P.Im proved diagnostic PCR assay for Actinobacillus p leuropneumoniae based on the nucleotide sequence of an outer memb rane lipoprotein[J].JC linical M icrobiol,1998,36(2):443-448.
[6]陈华美,曹三杰,文心田,等,猪传染性胸瞑肺炎放线杆菌Om-LA-PCR检测方法的建立[J].黑龙江畜牧兽医,2009(3):79-80.
[7]刁有祥,丁家波 ,姜世金 ,等.猪胸膜肺炎放线杆菌 PCR诊断方法的建立与应用[J].中国兽医学报,2006,26(4):379-381.
[8]冼琼珍,叶润全,顾万军,等.猪胸膜肺炎放线杆菌 PCR检测方法的建立及临床应用[J].中国兽医科学,2007,37(2):117-l20.
[9]冯元璋,马 萍,周碧君,等.胸膜肺炎放线杆菌的 PC R诊断方法研究[J].华中农业大学学报,2008,27(1):75-79.
[10]Chiers K,Van Overbeke I,Donne E,et al.Detection of Actinobacillus p leu ropneumoniae in cultures from nasal and tonsillar swabsof pigsby a PCR assay based on the nucleotide sequence of a dsbE-like gene[J].Vet M icrobiol,2001,83(2):147-159.
[11]陆杏华,何后军,王 萍,等.猪传染性胸膜肺炎放线杆菌江西株的分离鉴定及 PCR诊断[J].安徽农业科学,2008,36(6):2231-2232.
[12]庞耀珊,谢芝勋,刘加波,等.二温式PCR检测猪传染性胸膜肺炎放线杆菌方法的建立与应用[J].广西农业科学,2006,37(2):203-205.
[13]王牟平,刘思国,王春来,等.猪传染性胸膜肺炎 PCR诊断方法的建立[J].中国预防兽医学报,2003,25(4):305-309.
[14]冯元璋,马 萍,周碧君,等.胸膜肺炎放线杆菌的PC R诊断方法研究[J].华中农业大学学报,2008,27(1):75-79.
[15]G ram T,Ah rens P,A ndreasen M,et al.An Actinobacillus p leuropneumoniae PCR typing system based on the apx and omLA genes--evaluation of isolates fromLungs and tonsils of pigs[J].Vet M icrobiol,2000,75(1):43-57.
[16]贺 英,赵 萍,储岳峰,等.复合PCR鉴定胸膜肺炎放线杆菌和副猪嗜血杆菌方法的建立及初步应用[J].江西农业大学学报,2009,31(1):13-16.
[17]吴秀芬,杨焕民,李 鹏.联PCR检测猪胸膜肺炎放线杆菌和猪巴氏杆菌[J].黑龙江畜牧兽医,2007(3):82-83.

