浙江省不同地区实验兔血液蛋白多态性研究
赵伟春,徐孝平,李莉,王德军,喻琦,陈民利
(1.浙江中医药大学生物工程学院,杭州 310053;2.浙江中医药大学动物实验研究中心,杭州310053;3.浙江工业大学药学院,杭州 310014)
浙江省不同地区实验兔血液蛋白多态性研究
赵伟春1,徐孝平2,李莉1,王德军2,喻琦3,陈民利2
(1.浙江中医药大学生物工程学院,杭州 310053;2.浙江中医药大学动物实验研究中心,杭州310053;3.浙江工业大学药学院,杭州 310014)
目的 研究浙江省不同产地实验兔血液蛋白的多态性,了解各地实验兔的遗传背景,指导优良品系的选育。方法 选择兰溪、农科院、上虞和余姚等地生产的实验兔的11个血液蛋白位点进行聚丙烯酰胺凝胶电泳,根据电泳图谱分析基因频率、Hardy-weinberg平衡状态、遗传变异程度和遗传相似性。结果 Pr、Ptf、Hbα、Hbβ和Alb在所有实验兔中表现为单态,其余蛋白位点呈多态。各蛋白位点的变异程度Prt1>Sag>Tf1>Po>Tf2>Prt2。各地实验兔蛋白位点平均杂合度为兰溪>农科院>上虞>余姚。农科院与余姚实验兔间的遗传距离最近,上虞与兰溪实验兔的亲缘关系最远,遗传相似系数分别为0.7938和0.7687。结论 血液蛋白多态性反映了浙江省不同地区生产的实验兔的遗传背景,为实验兔的选育提供了实验依据。
兔;血液蛋白多态性;基因频率;杂合度;遗传距离
实验兔是生物医药产品研发及医学科学研究领域最常用的生物研究材料。由于兔的繁殖场地较大,实验室进行大规模的养殖比较困难,目前各实验室使用的实验兔大部分来自于农科系统单位和农民个体养殖场等作为经济动物饲养的兔。由于不同的饲养方式和环境条件导致各种群兔的生物学特性发生改变,质量参差不齐。为规范实验兔的饲养管理,稳定实验兔的生物性状,提高实验兔的质量,浙江省实验动物平台对有一定饲养基础的浙江省农业科学院畜牧兽医研究所、上虞市星火兔业养殖场、余姚市泗门建飞实验兔养殖场等兔场进行引导扶植,按实验动物的生产设施和管理体系要求,扩大实验兔的饲养规模,提高实验兔的遗传品质。本实验通过聚丙烯酰胺凝胶电泳对农科院、上虞和余姚生产的日本大耳白兔的后白蛋白(Po)、前转铁蛋白1(Prt1)、前转铁蛋白2(Prt2)、转铁蛋白1(Tf1)、转铁蛋白2(Tf2)、后转铁蛋白(Ptf)、慢α球蛋白(Sag)、血红蛋白 α(Hbα)、血红蛋白β(Hbβ)和白蛋白(Alb)共11个血液蛋白位点进行了多态性的研究,并以兰溪农户生产的日本大耳白兔作为对照,为了解规范化饲养后各养殖场实验兔的遗传背景,以及与经济动物方式饲养的差异提供参考,为实验兔的生产和应用提供指导。
1 材料与方法
1.1 实验动物
取日本大耳白兔的同龄母兔同期繁殖生产的后代,共129只(雌64只,雄65只),体质量(2.25±0.25)kg。其中,浙江省农业科学院畜牧兽医研究所养兔场30只,雌雄各半,生产许可证【SCXK(浙)2006-0025】,以下简称“农科院兔”;余姚市泗门建飞实验兔养殖场 40只,雌雄各半,生产许可证【SCXK(浙)2008-0026】,以下简称“余姚兔”;上虞市星火兔业养殖场29只,雌14只,雄15只,生产许可证【SCXK(浙)2008-0036】,以下简称“上虞兔”;兰溪农户采购30只,雌雄各半,由浙江中医药大学动物实验研究中心采购,以下简称“兰溪兔”。所有实验兔均预饲养一周后,进行血样采集。浙江中医药大学动物实验研究中心兔实验饲养室,使用许可证【SYXK(浙)2008-0116】。
1.2 血样采集
每只实验兔采集血样2 mL,其中1 mL血样加入至肝素抗凝管中制备红细胞溶血液(抗凝管的制备:在1.5 mL离心管中加入每滴含30 U的肝素溶液2滴,于60~80℃烘干),反复倒置,使抗凝剂与血液混匀;剩余血样加至不加抗凝剂的离心管中用于制备血清。
1.3 样品的制备
取未加抗凝剂的血样离心(2000 r/min,10 min,4℃),将血清转移至 0.5 mL离心管中,– 20℃保存。将加抗凝剂的血样离心(2000 r/min,10 min,4℃)后弃上层血浆,用10倍于红细胞压积的生理盐水洗涤 3 次(2000 r/min,10 min,4℃),取洗涤过的红细胞40 μL于0.5 mL离心管中,用等体积的蒸馏水稀释,震荡使红细胞破裂溶血,制成红细胞溶血液,–20℃保存。
1.4 Pr、Ptf、Po、Sag、Prt1、Prt2、Tf1 和 Tf2 的电泳测定
采用聚丙烯酰胺凝胶电泳对各实验兔的血清样品进行检测。电泳系统如下:电泳缓冲液为Tris-甘氨酸(pH 8.3),分离胶缓冲液为 Tris-HCl(pH 8.9),浓缩胶缓冲液为 Tris-HCl(pH 6.7),浓缩胶和分离胶浓度分别为3.5%和12%。各实验兔的血清样品先用PBS稀释5倍后,再与等体积的上样缓冲液(2×)混匀,取上述混合液15 μL上样。每一块凝胶均加了同一个实验兔的血液样品作为对照,下同。样品在浓缩胶和分离胶中的泳动电压分别为150 V和350 V,电泳时间16 h。整个过程在4℃下进行。采用考马斯亮蓝法染色1 h,然后用甲醇:冰乙酸脱色液脱色至背景无色为止。
1.5 Alb的电泳测定
Alb位点电泳时分离胶浓度改为8%,各实验兔的血清样品先用PBS稀释30倍后,再与等体积的上样缓冲液(2×)混匀,取上述混合液15 μL上样,电泳4 h。其他实验条件同前。
1.6 Hb的电泳测定
Hb位点电泳加样时,将红细胞溶血液用 PBS作10倍稀释,再与等体积的上样缓冲液(2×)混匀,取上述混合液15 μL上样。Hb属于有色蛋白,无须染色即可观察到分离的带型。其他实验条件同Alb位点的电泳检测。
1.7 数据分析
各等位基因及表型识别均参考 Grunder等[1]和Arana等[2]的标准。根据表型频率,采用基因计数法计算基因频率。根据基因型频率实际观测值计算理论值,并用χ2适合性检验比较实际值与理论值的差异,检验二者的差异是否显著,了解群体的基因频率是否符合Hardy-Weiberg平衡定律。计算平均杂合度、有效等位基因数和奈氏遗传距离,采用UPGMA法进行聚类分析。
2 结果
2.1 血清蛋白位点基因型频率及基因频率的分析
2.1.1 Pr、Po、Prt1、Prt2、Tf1、Tf2、Ptf和 Sag 蛋白位点基因型频率及基因频率分析:Pr、Po、Prt1、Prt2、Tf1、Tf2、Ptf和 Sag位点的部分电泳图谱见图 1,基因型频率及基因频率结果见表1。在被检测的所有实验兔个体中,Pr和Ptf的电泳图谱均只有一个条带,为单态位点。Po在所有实验兔个体中均表现出AB一种表型。兰溪和农科院兔的Prtl均有6种表型,而上虞兔该蛋白位点无 BC表型,余姚兔则无CC表型。Prt2的表型由2个基因所控制,在4个实验兔群中均无BB表型,只有AA型和 AB型。Tf1位点的表型由3个等位基因所控制,其中余姚的无AA和AC表型,其余3个实验兔群则无 AA和 CC表型。Tf2的表型由2个等位基因所控制,其中兰溪和余姚兔无BB表型,农科院和上虞兔则AA、BB和AB这3种表型均有。Sag在4个实验兔群中均无CC表型,其中余姚兔无C基因,且只呈现AB表型,兰溪兔无BB和CC表型,农科院兔无CC和BC表型,上虞兔则无AA和CC表型。
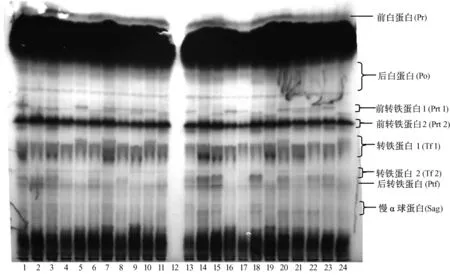
注:第12泳道为空白对照;第1~8泳道为兰溪样品;第9~11泳道为农科院样品;第13~17泳道为上虞样品;第18~24泳道为余姚样品。图 1 Pr、Po、Prt1、Prt2、Tf1、Tf2、Ptf和 Sag 的电泳图谱Note:Lane 12 was blank controls.Lanes 1 to 8 were samples from rabbits bred in Lanxi.Lanes 9 to 11 were samples from the Agricultural Academy.Lanes 13 to 17 were samples from Shangyu.Lanes 18 to 24 were samples from Yuyao.Fig.1 Electrophoresis patterns of Pr,Po,Prt1,Prt2,Tf1,Tf2,Ptf and Sag
2.1.2 血红蛋白(Hb)和白蛋白(Alb)蛋白位点基因型频率及基因频率分析:在所有被检测的样品中,Hb只分离出 Hbα和 Hbβ两种成分,泳动较快的Hbα比泳动较慢的Hbβ成分少(图2)。Alb呈均一的球状带(图3)。
2.2 蛋白位点的Hardy-Weinberg平衡状态分析
由于 Pr、Ptf、Hbα、Hbβ 和 Alb 位点为单态位点,不进行Hardy-Weinberg平衡状态分析,其余位点的统计结果见表2。经χ2适合性检验,在兰溪生产的实验兔中Prt1、Prt2和Tf1为平衡位点,Po为高度不平衡位点(P<0.01),Tf2和 Sag为不平衡位点(0.01<P<0.05)。在农科院生产的实验兔中 Po和Tf1是高度不平衡位点(P<0.01),其余位点均为平衡位点(P>0.05)。在上虞生产的实验兔中Po和Prtl为高度不平衡位点(P<0.01),其余位点均为平衡位点(P>0.05)。余姚生产的实验兔则以Po和Sag为高度不平衡位点(P<0.01)。
2.3 蛋白位点变异程度的分析
如表3所示,6个多态蛋白位点的平均杂合度之和在4个产地实验兔间存在差异,排列次序为兰溪>农科院>上虞>余姚,各蛋白位点的变异程度Prt1>Sag>Tf1>Po>Tf2>Prt2。Prt1在各实验兔
群中的变异程度均最大,而 Prt2的变异程度均最小,其余蛋白位点的变异程度在各实验兔群间存在差异,其中兰溪兔蛋白位点的杂合度为Sag>Tf1>Po>Tf2;农科院兔为 Tf1>Sag>Po>Tf2;上虞兔为Sag>Tf1>Po>Tf2;余姚兔则 Po=Sag>Tf1>Tf2。
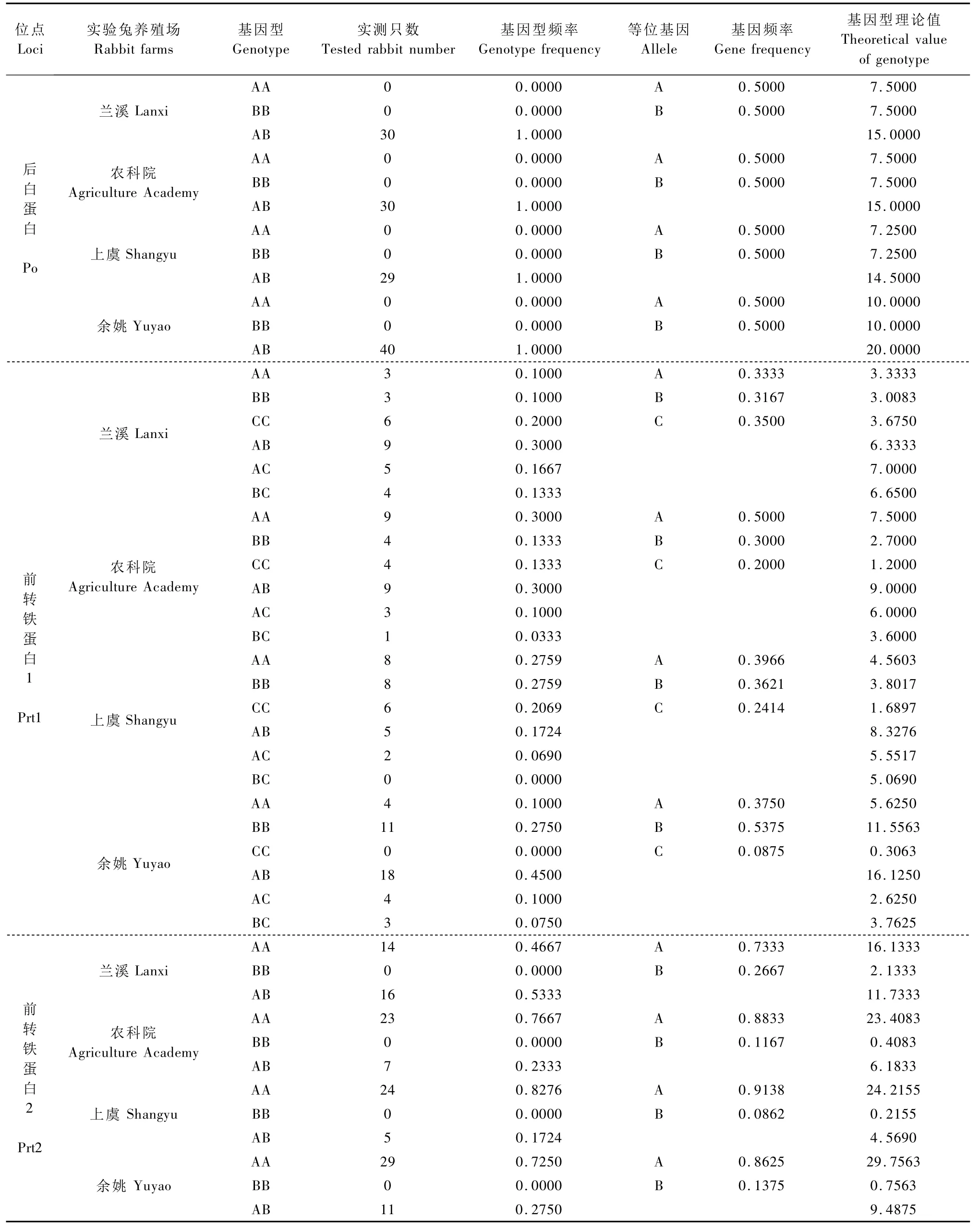
表1 Po、Prt1、Prt2、Tf1、Tf2和 Sag位点的基因型频率和基因频率Tab.1 Genotype frequency and gene frequency of Po,Prt1,Prt2,Tf1,Tf2 and Sag
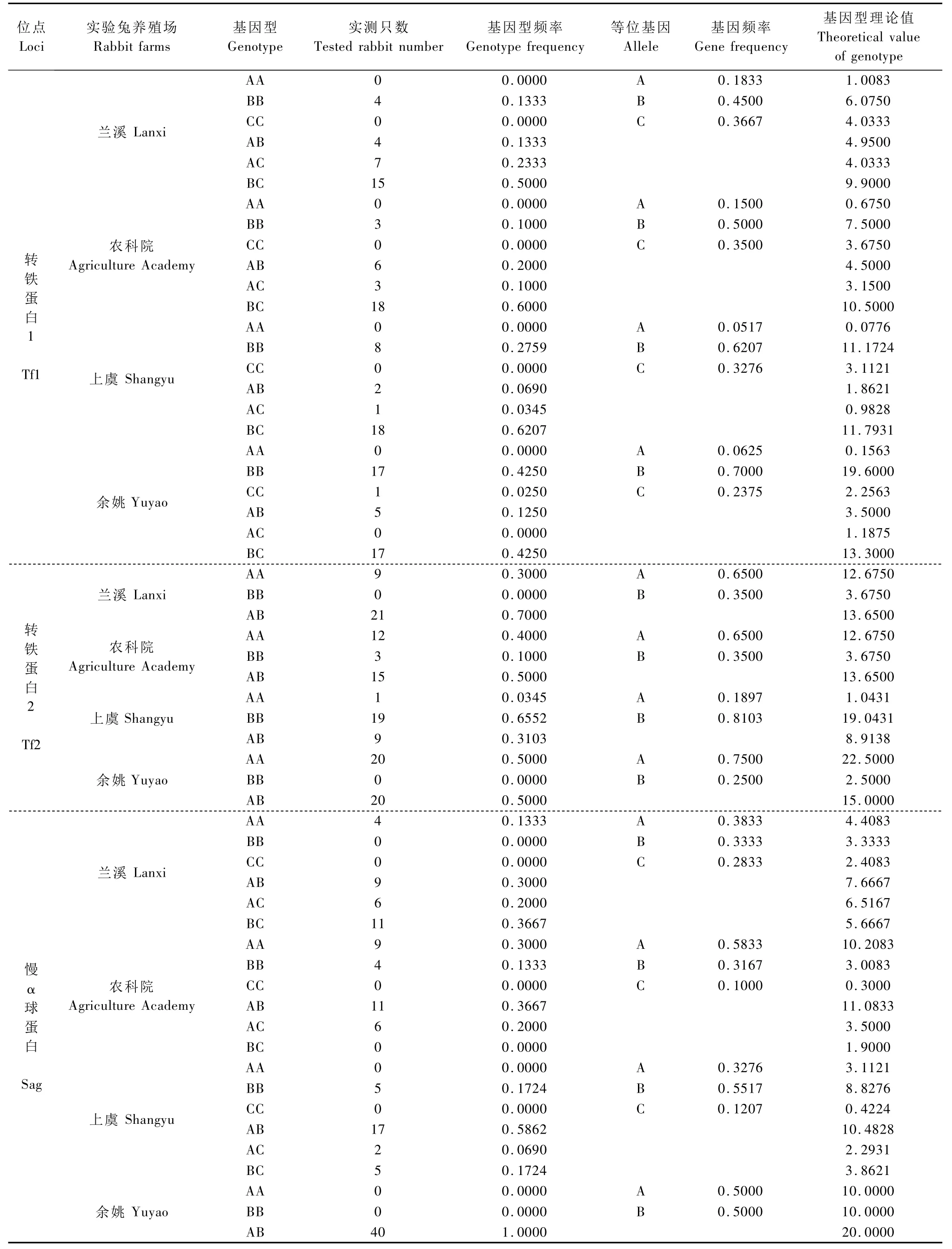
续表
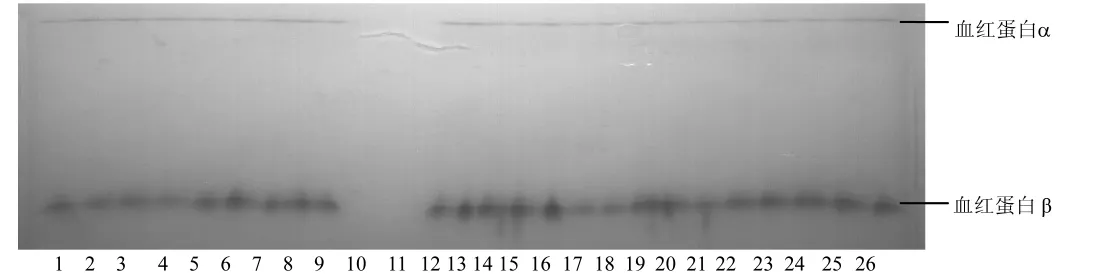
注:第10和11泳道为空白对照,1~9泳道为兰溪兔样品,12~26为农科院兔样品。图2 血红蛋白的电泳图谱Note:Lanes 10 and 11 were blank controls.Lanes 1 to 9 were samples of rabbits bred in Lanxi.Lanes 12 to 26 were samples of Agriculture Academy.Fig.2 Electrophoretic patterns of hemoglobin
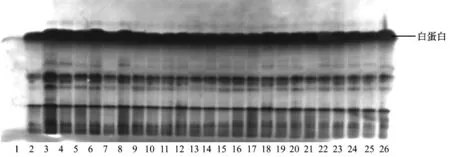
注:第1泳道为空白对照;第2~19泳道为农科院兔的血清样品;第20~26泳道为兰溪兔的血清样品。图3 白蛋白的电泳图谱Note:Lane 1 was blank control.Lanes 2 to19 were samples of rabbits from the Agriculture Academy.Lanes 20 to 26 were samples of rabbits from Lanxi.Fig.3 Electrophoretic patterns of serum albumin
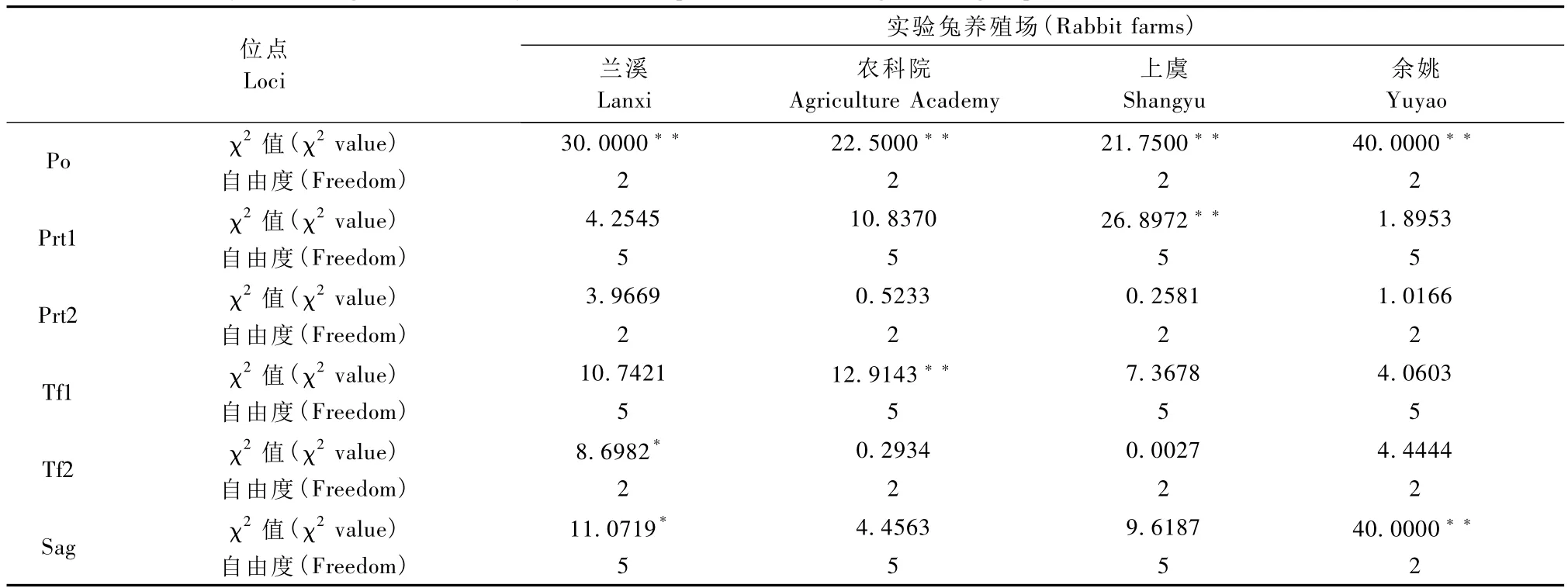
表2 4个养殖场实验兔血液蛋白位点的Hardy-weinberg平衡状态分析Tab.2 Hardy-Weinberg balance analysis of serum protein loci among rabbit groups bred in different farms
2.4 不同产地实验兔群的遗传相似性分析
4个产地的实验兔群中(图4),农科院、余姚和兰溪兔间的遗传相似系数均大于0.78,其中农科院与余姚兔间的遗传距离最近,遗传相似系数为0.7938。上虞兔与其他3个产地实验兔的遗传相似系数均较小,其中与兰溪兔的遗传距离最远,遗传相似系数为0.7687。
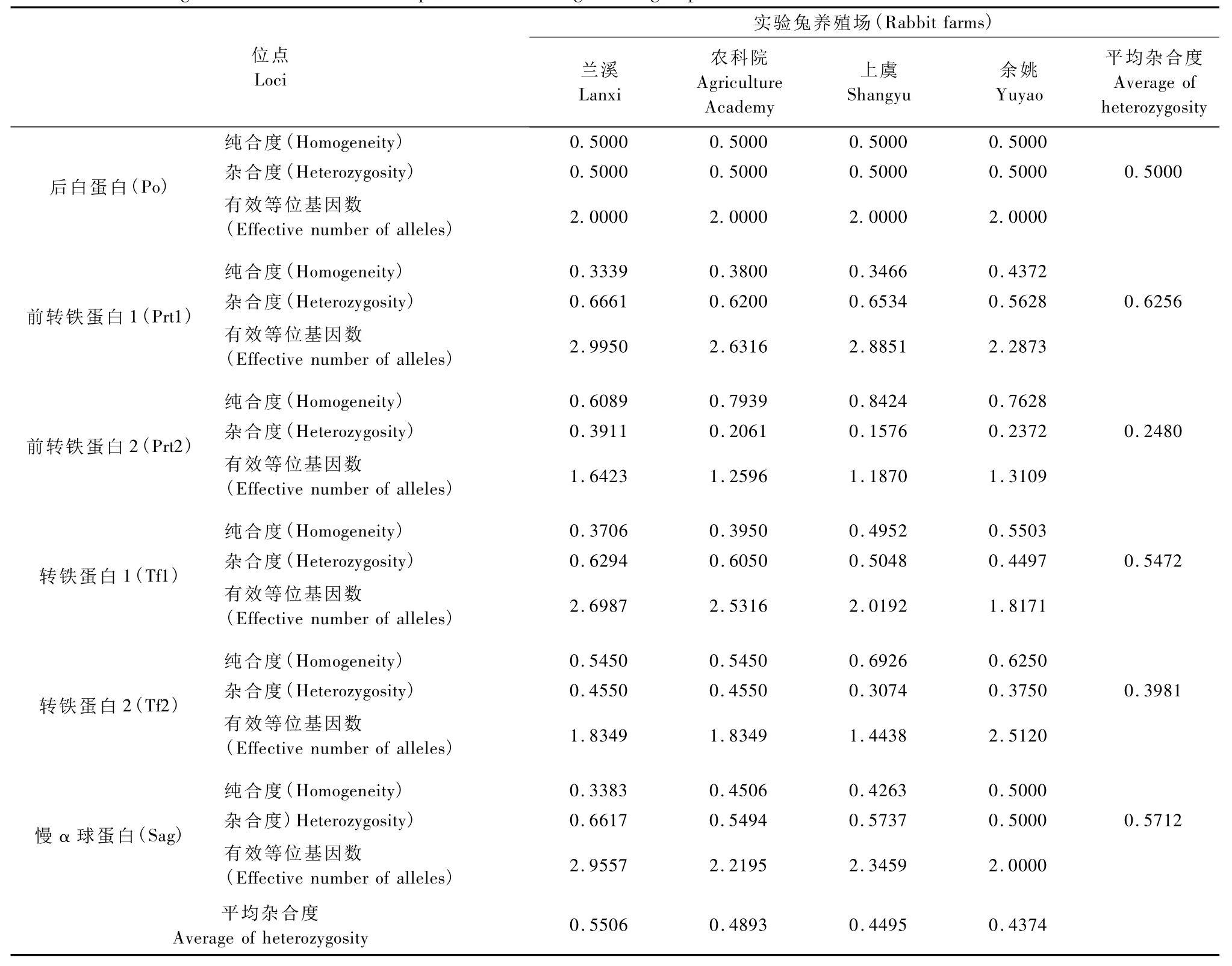
表3 4个养殖场实验兔血液蛋白位点变异程度Tab.3 The genetic variation of serum protein loci among rabbit groups bred in different farms

图4 4个养殖场实验兔间的UPGMA聚类分析Fig.4 Cluster analysis on the similarity values of the four rabbit groups bred in different farms by UPGMA
3 讨论
3.1 基因型频率和基因频率分析
等位基因频率的明显差别从理论上可用于标记品种特征。在本实验的4个产地实验兔群中,Pr、Ptf、Hbα、Hbβ 和 Alb 都表现单态,在长期的进化过程中保持了一种遗传的稳定性。这与其他家兔的研究结果一致[3-5]。已有研究表明,Po受两个共显性等位基因控制,如中国白兔、丹麦兔、比利时兔和加利福尼亚兔[6,7]。本研究发现 Po在兰溪、农科院、上虞和余姚生产的实验兔中均表现为AB表型。Prt在中国白兔、新西兰兔、丹麦兔、比利时兔和加利福尼亚兔中均存在多态性[8,9]。本研究中仅兰溪和农科院生产的实验兔Prtl出现6种表型,其余产地兔群均只出现其中某几种表型。Tf在青紫蓝兔、新西兰兔、家利福尼亚兔、丹麦兔等多数家兔品种中表现出多态性[10,4],仅在少数几个品种中表现单态,如塞北兔[11]。本研究的 Tfl表现出 5种表型,无 AA表型。Sag由A、B和 C这3个等位基因控制,A、B为优势基因,基因型的表现不一样。各实验兔群不同位点的等位基因频率不同,这是由于不同实验兔其遗传背景、选育方法和选育程度不同造成的。我国实验兔除中科院上海实验动物中心1979年从日本引进新西兰兔和2003、2004年相继从美国引进SPF级新西兰兔和日本大耳白兔进行少量饲养外,全国各地极大部分的实验兔来自以特种经济动物引入我国饲养的新西兰兔和日本大耳白兔。这些种群的饲养历史悠久,由于长期在特殊的饲养环境中饲养,以及在繁殖过程中为了获得高繁殖率,相互间有杂交现象,并未保持动物本身的遗传系,造成了血缘杂交和品系间的遗传污染,出现遗传学上的基因突变或漂变。
3.2 多态蛋白位点的Hardy-Weinberg平衡状态分析
χ2适合性检验结果表明,在所检测的实验兔中Po均为高度不平衡位点(P<0.01),Tf1、Prtl位点上也有多个实验兔群为高度不平衡位点,而 Prt2、Tf2和Sag以平衡位点为主。这些不平衡位点的基因频率偏离 Hardy-Weinberg平衡状态,说明这些位点受到了选择、突变等因素的影响。
3.3 群体遗传变异分析
4个产地实验兔群11个蛋白位点的平均杂合度存在差异。其中兰溪兔个体间变异程度最大,其次为农科院兔,上虞和余姚兔个体间变异较小。这表明兰溪和农科院兔的遗传多样性较丰富,个体间差异较大。这是由于兰溪和农科院兔来自以特种经济动物引入,饲养历史悠久,在长期饲养过程中,日本大耳白兔有与新西兰兔种群和中国实验兔的杂交,具有复杂的血缘关系。而上虞和余姚兔种群的饲养时间短,规模比较小,实验兔以封闭繁殖为主,未引进外来血缘,因此个体间的遗传品质相对较纯。Prt1在4个实验兔群中的变异程度均较大,表明该位点的选择潜力大。
3.4 群体遗传相似性
在4个产地的实验兔群中,农科院兔、余姚兔与兰溪兔群间的遗传相似系数均较大,而上虞兔与其他3个产地实验兔的遗传距离均较远,这是由于上虞兔引入的日本大耳白兔,引入时间短,没有外来血缘,品种较纯正。其余3个产地的日本大耳白兔,饲养时间长,已带有新西兰兔种群和中国本兔的血缘,故与其血缘关系较远。因此,血液蛋白位点的多态性较好的反映了各群体的遗传背景。
[1] Grunder AA,Sartore G,Stormont C.Genetic variation in red cell esterase of rabbits[J].Genetics.1965,52(6):1345-1353.
[2] Arana AP,Zaraoza P,Rodeuar C,et al.Evidence for transferrin polymorphism in Spanish wild rabbits[J].Animal Genetics.1987,18(2):125-132.
[3] 周立波,任文陟,张嘉保,等.Vc-獭兔、日本大耳白兔与新西兰白兔血液蛋白多态性研究[J].动物医学进展.2004,25(3):102-105.
[4] 孙杰,赵宗盛,李大全,等.日本大耳白兔、新西兰兔血液蛋白多态性的研究[J].中国畜牧杂志.2002,38(1):7-8.
[5] Ferrand N. Biochemical and genetic studies on rabbit haemoglobin II Eeectrophoretic polymorphism of the α chains[J].Biochem Genetics.1990,21(2):217-219.
[6] 庞有志.家兔血液蛋白多态性研究进展[J].兽医大学学报.1992,12(4):71-37.
[7] 刘若余.家兔血清蛋白遗传多态性[J].贵州农学院学报.1997,16(1):22-24.
[8] Usher DC,Cogbum B,Richard RF.Rabbit linkage group VIII:the alleles of Prt gene[J].Biocheml Genetics.1983,21(4):511-526.
[9] Vieira J, Ferrand N. Fournew allelesatthe mannose-6-phosphate isomerase locus in rabbit[J].Animal Genetics.1995,26(1):37-38.
[10] Markovich LG. Transferrin polymorphism in different rabbits breeds[J].Animal Breed Abst.1977,45(1):70.
[11] 吴淑琴,孙全文,穆秀明,等.塞北兔血液蛋白多态性研究[J].中国养兔杂志.2002,(4):17-21.
Serum Protein Loci Polymorphism in Laboratory Rabbits Bred in Different Regions of Zhejiang Province
ZHAO Wei-Chun1,XU Xiao-Ping2,LI Li1,WANG De-Jun2,YU Qi3,CHEN Min-Li2
(1.College of Bioengineering,Zhejiang Chinese Medical University,Hangzhou 310053,China;2.Laboratory Animal Research Center,Zhejiang Chinese Medical University,Hangzhou 310053,China;3.College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310014,China)
ObjectiveTo study the serum protein loci polymorphism in rabbits bred in different regions of Zhejiang province.Method Eleven blood protein loci of rabbits bred in four regions of Zhejiang province were analyzed by vertical polyacrylamide gel electrophoresis.The rabbits were bred in the Agriculture Academy,in Lanxi,Shangyu and Yuyao,respectively.The proteins included the prealbumin(Pr),postalbumin(Po),pretransferrin 1 (Prt1),pretransferrin 2(Prt2),transferrin 1(Tf1),transferrin 2(Tf2),posttransferrin(Ptf)and slow α-globulin(Sag),respectively.The gene frequency,Hardy-Weinberg balance,genetic variation and similarity coefficient of the four groups of rabbits were analyzed.ResultsPr,Ptf,Hbα,Hbβ and Alb in all rabbits had a monomorphism,while the others were polymorphic.The genetic variation of serum protein loci were Prt1>Sag>Tf1>Po>Tf2>Prt2.The heterozygosity of serum protein loci were Lanxi>Agriculture Academy>Shangyu>Yuyao.The genetic distance between the rabbits bred in Agricultural Academy and Yuyao was the nearest among those four regions.The similarity coefficient was 0.7938.The relationship between the rabbits bred in Shangyu and Lanxi was the farthest,with a similarity coefficient of 0.7687.ConclusionsThe serum protein polymorphism reflects the genetic background of the rabbits bred in different regions of Zhejiang province.It provides an experimental basis for breeding of rabbits.
Rabbits;Serum protein polymorphism;Gene frequency;Heterozygosity;Genetic distance
Q346
A
1005-4847(2010)06-0506-08
10.3969/j.issn.1005-4847.2010.06.013
2010-06-24
浙江省科技厅实验动物公共服务平台项目(No.2008F80017,No.Dwpt-bz-12),浙江省卫生高层次创新人才培养工程项目(2008年)。
赵伟春(1973-),女,副研究员,博士,研究方向:生物工程。E-mail:weichunzhao@hotmail.com
陈民利。E-mail:minlichen01@yahoo.com.cn

