实验性糖尿病心肌病大鼠模型建立及心脏功能和结构相关性分析
董世芬,洪缨,孙建宁,郝颖智,于海食
(北京中医药大学中药学院中药药理系,北京 100102)
实验性糖尿病心肌病大鼠模型建立及心脏功能和结构相关性分析
董世芬,洪缨,孙建宁,郝颖智,于海食
(北京中医药大学中药学院中药药理系,北京 100102)
目的 建立实验性糖尿病心肌病大鼠模型,观察心功能和结构变化,初步分析心脏功能和结构指标相关性。方法 雄性Wistar大鼠随机分为正常对照组、高糖高脂膳食组和糖尿病心肌病模型组,采用高糖高脂膳食12周负荷一次性小剂量STZ腹腔注射建立糖尿病心肌病模型,观察各组动物心脏功能、心脏重量和心重指数、左心室形态和胶原含量等的变化。结果 (1)与正常对照组比较,糖尿病心肌病模型组大鼠左心室舒张末压(LVEDP)和最大舒张速率(-dp/dtmax)值显著升高(P<0.05),心率(HR)、左心室收缩压(LVSP)、左心室最大收缩速率(+dp/dtmax)、每搏输出量(SV)和心排量(CO)明显降低(P<0.05);全心重指数(HW/BW)和左心室重量指数(LVW/BW)明显升高(P<0.01);常规HE染色显示心肌细胞排列紊乱,心肌细胞肥大,细胞核边缘不清等,室间隔和左心室壁厚度明显增加(P<0.001,P<0.05);心肌胶原含量明显增加(P<0.05)。(2)大鼠心脏功能参数 ±dp/dtmax和CO值分别与结构参数HW/BW和LVW/BW呈现明显的相关性(P<0.01或 P<0.05)。结论 大鼠高糖高脂膳食喂养负荷小剂量STZ一次性腹腔注射,可造成心脏舒张和收缩功能紊乱以及心肌结构重塑,心脏功能与结构变化呈显著相关性,可复制实验性糖尿病心肌病模型。
实验性糖尿病心肌病;心脏功能;心脏结构;相关性分析;大鼠
1972年Rubler等[1]对糖尿病患者解剖时发现心肌内出现小血管管腔狭窄、管壁增厚以及间质弥漫性纤维化等病变,在排除酒精、高血压、冠状动脉病变等的情况下提出了糖尿病心肌病(diabetic cardiomyopathy,DC)概念。临床和实验研究均证实,DC发生于糖尿病早期,病变心脏首先出现单纯性的心肌细胞结构变化或者伴随左心室容积、室壁厚度及重量增加,舒张功能下降;随病程发展,心肌细胞出现凋亡、坏死、肥大和纤维化加重,心脏收缩、舒张及射血功能出现明显障碍,最终可能引发心肌缺血和心衰,成为糖尿病患者的重要致死原因之一[2,3]。导致DC发生的病理机制复杂,一般认为与高血糖状态、胰岛素抵抗、脂肪酸含量升高、晚期糖基化终末产物(AGEs)积聚、氧化应激损伤(ROS)、多聚ADP核糖聚合酶(PARP)和蛋白激酶C(PKC)过度激活、Ca2+稳态失衡、低氧诱发因子-1(HIF-1)和血管内皮生长因子(VEGF)下降等有关,除此之外肾素-血管紧张素-醛固酮系统和激肽释放酶-激肽系统也参与到DC疾病发生发展过程[4]。
本研究拟用高糖高脂饲料负荷小剂量链脲佐菌素复制类似临床DC病变的大鼠模型,观察病变模型动物心脏功能和结构的变化,并通过统计分析初步探讨此种方法造成的心脏功能损伤与结构重塑之间的相关性,以期为研究DC病变的病理机制和表现形式以及相关药物的开发提供实验依据。
1 材料和方法
1.1 药品与试剂
高糖高脂饲料(20%蔗糖、10%猪油、2.5%胆固醇、1%胆盐和66.5%基础饲料),北京科澳协力饲料有限公司提供[SCXK(京)2005-2007];链脲佐菌素(streptozotocin,STZ),Sigma公司(美国)提供;柠檬酸,柠檬酸三钠,北京化工厂产品;羟脯氨酸试剂盒,南京建成生物工程研究所提供。
1.2 主要实验仪器
Ohaus天平:TP200型,美国 Ohaus;One Touch Ultra稳豪系列血糖仪,试纸批号 287695,LifeScan Inc.;离心机:Heraeus Instruments,Kendro Laboratory Products,德国;紫外分光光度 计:Agilent 8453,Agilent Techologies,德国;多道生物信号分析系统:Biopac System MP150,Biopac System,Inc. 美国;Nikon生物显微镜(配有偏振光滤光片),日本;Image-ProPlus 5.0专业图像分析软件,美国。
1.3 实验动物分组及处理
SPF级 Wistar大鼠,雄性,45只,体质量 180~200 g,来源于北京维通利华实验动物技术有限公司【SCXK(京)2007-0001】,按照实验动物使用的 3R原则给予人道关怀。大鼠于室温22~25℃,相对湿度65%,12 h明暗交替环境中适应一周后进入实验。动物按体重随机分为3组,正常对照组(n=15)、高糖高脂膳食组(n=15)和糖尿病心肌病模型组(n=15)。正常对照组和高糖高脂膳食组大鼠分别喂饲普通饲料和高糖高脂饲料12周。糖尿病心肌病模型组大鼠喂饲高糖高脂饲料6周后,按30 mg/kg剂量一次性腹腔注射(i.p.)STZ(pH=4.5,4℃配制,随配随用;另外2组动物 i.p.同体积柠檬酸盐缓冲液),72 h后尾静脉取血测空腹血糖,大于7.77 mmol/L者入选实验研究(12只,另外3只剔除),继续喂养高糖高脂饲料6周至实验结束。所有动物均自由饮水,实验过程中未出现动物死亡情况。
1.5 心功能测定
实验至13周,大鼠称重,按35 mg/kg剂量i.p.戊巴比妥钠溶液麻醉,仰位固定。将Biopac SystemMP150生物采集器的心电图和心排量针式电极按照要求插入大鼠四肢皮下,固定阻抗电极间的距离,固定听诊器于大鼠心脏二尖瓣搏动最强处,采集心电图、容积阻抗图和心音图,测心率(HR),计算得到每搏输出量(SV)和心排量(CO)。
心排量测定完毕后,隔日禁食12h,大鼠称重,同上麻醉固定,分离右颈总动脉,将20G静脉套管由颈总动脉插管至左心室,连接生物信号记录仪记录左心室收缩压(LVSP)、左心室舒张末期压力(LVEDP)、左心室最大收缩/舒张速率(±dp/dtmax)。
1.6 心脏重量及心重指数测定
心功能测定完毕后,取大鼠心脏,生理盐水清洗后,滤纸吸取残留血液,剪去血管等,称量全心重量,然后剪去心房和右心室,称取左心室重量,计算全心重指数(全心重/体重,HW/BW)和左心室重量指数(左心室重量/体重,LVW/BW)。
1.7 左心室形态学观察
心脏称重结束后,于左心室赤道面横切,取适量心肌组织,加10倍量甲醛固定,石蜡包埋,切片,厚度4 μm,常规 HE染色。显微镜下观察左心室形态,用Image-ProPlus5.0专业图像分析软件测定左心室前壁和室间隔厚度。每组3~4只动物,每只动物观察2张切片,取平均值。
1.8 左心室胶原含量测定
取约0.1 g左心室组织,按试剂盒要求测定样品中羟脯氨酸含量,按照胶原中羟辅氨酸含量13.4%比例,胶原含量以羟辅氨酸 ×7.46计算,以μg/mg组织表示。
1.9 统计学处理
用SPSS17.0中one-way ANOVA对实验数据进行t检验统计分析,结果用用±s表示,用Pearson correlation对心功能和心脏结构指标进行相关性分析,P<0.05认为是有统计学意义。
2 结果
2.1 大鼠心功能测定
与正常对照组相比,高糖脂膳食组LVEDP值升高(P<0.05),其余指标均没有明显变化(P>0.05),心脏功能改变较温和;糖尿病心肌病模型组大鼠HR、LVSP、+dp/dtmax、SV和CO指标明显降低(P<0.05),同时 LVEDP和-dp/dtmax值升高(P <0.05),大鼠心脏收缩和舒张功能出现明显障碍,心排量下降,结果见表1。
表1 高糖高脂膳食并STZ对大鼠心脏功能的影响(±s)Tab.1The effect of high fat-high sucrose diet and streptozotocin on cardiac function in the rats(±s)
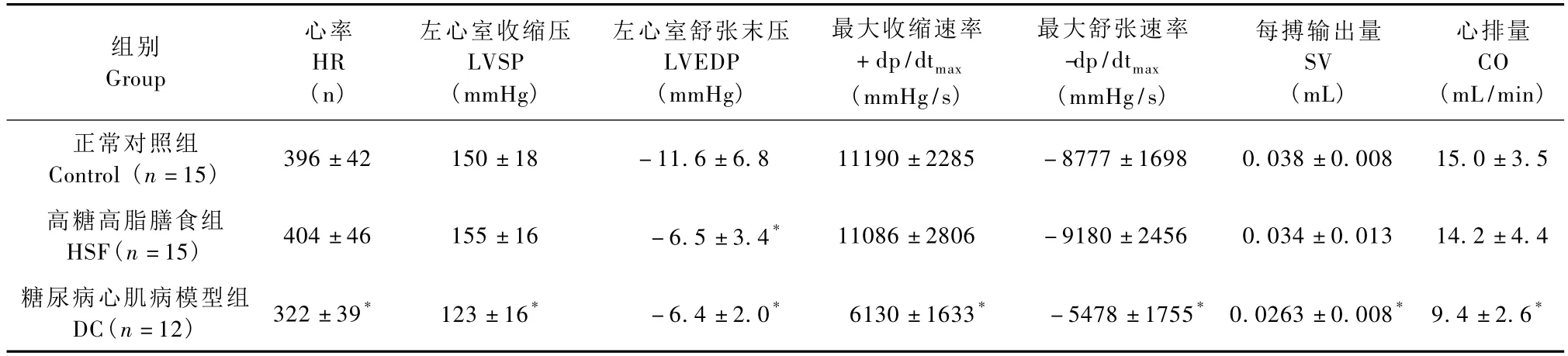
表1 高糖高脂膳食并STZ对大鼠心脏功能的影响(±s)Tab.1The effect of high fat-high sucrose diet and streptozotocin on cardiac function in the rats(±s)
注:与正常对照组相比,* P<0.05Note:* P <0.05,vs.control group
组别Group心率HR(n)左心室收缩压LVSP(mmHg)左心室舒张末压LVEDP(mmHg)最大收缩速率+dp/dtmax(mmHg/s)最大舒张速率-dp/dtmax(mmHg/s)每搏输出量SV(mL)心排量CO(mL/min)正常对照组Control(n=15) 396±42 150±18 -11.6±6.8 11190±2285 -8777±1698 0.038±0.008 15.0±3.5高糖高脂膳食组HSF(n=15) 404±46 155±16 -6.5±3.4* 11086±2806 -9180±2456 0.034±0.013 14.2±4.4糖尿病心肌病模型组DC(n=12) 322±39* 123±16* -6.4±2.0* 6130±1633* -5478±1755* 0.0263±0.008* 9.4±2.6*
2.2 高糖高脂膳食并STZ对大鼠心脏重量和心重指数的影响
大鼠给予高糖高脂膳食并注射 STZ后,体重、全心重量以及左心室重量明显下降(P<0.01或P<0.001),但是全心重指数和左心室肥厚指数明显增加(P<0.01),高糖高脂膳食组大鼠均未有明显变化,见表2。
2.3 高糖高脂膳食并STZ对大鼠左心室形态的影响
光镜下观察左心室纵切片HE染色结果显示,正常对照组大鼠心肌细胞排列紧密,细胞核清晰可见,心肌细胞间有闰盘;高糖高脂组大鼠心肌细胞出现轻微肥大,但未见明显的病理变化;糖尿病心肌病模型组大鼠可见明显的心肌纤维排列紊乱、断裂,心肌细胞肥大,细胞核边缘不清,融合,甚至消失。见图1(封二)。
与正常对照组比较,高糖高脂膳食组大鼠室间隔厚度明显增加(P<0.01),但左心室壁厚度没有明显改变(P>0.05);糖尿病心肌病模型组大鼠室间隔和左心室壁厚度均明显增加(P<0.001,P<0.05),结果见表 3。
表2 高糖高脂膳食并STZ对大鼠心脏重量和心重指数的影响(±s)Tab.2The effect of high fat-high sucrose diet and streptozotocin on heart weight,HW/BW and LVW/BW ratios in the rats(±s)
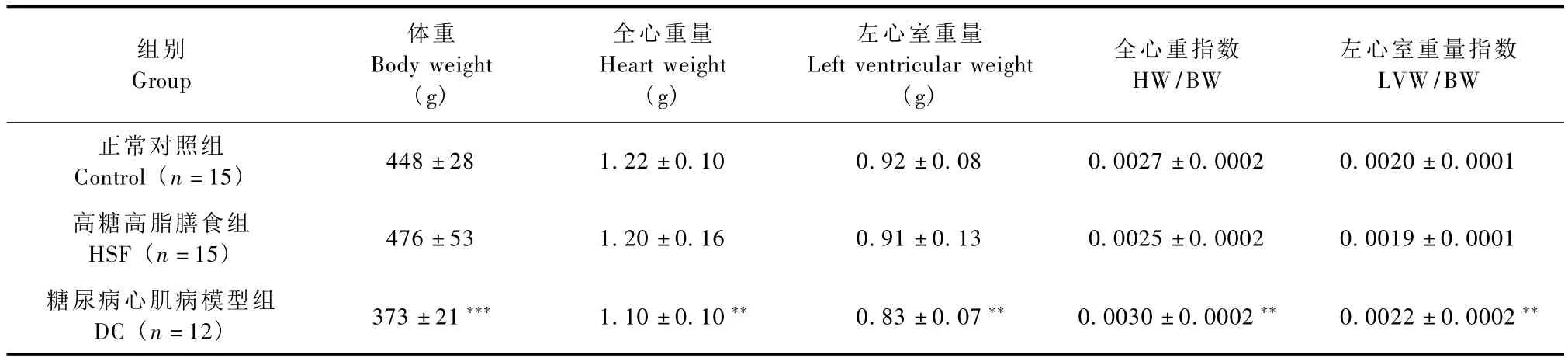
表2 高糖高脂膳食并STZ对大鼠心脏重量和心重指数的影响(±s)Tab.2The effect of high fat-high sucrose diet and streptozotocin on heart weight,HW/BW and LVW/BW ratios in the rats(±s)
注:与正常对照组相比,**P<0.01,***P<0.001Note:**P <0.01,***P <0.001,vs.control group
高糖高脂膳食组HSF(n=15) 476±53 1.20±0.16 0.91±0.13 0.0025±0.0002 0.0019±0.0001组别Group体重Body weight(g)全心重量Heart weight(g)左心室重量Left ventricular weight(g)全心重指数HW/BW左心室重量指数LVW/BW正常对照组Control(n=15) 448±28 1.22±0.10 0.92±0.08 0.0027±0.0002 0.0020±0.0001糖尿病心肌病模型组DC(n=12) 373±21*** 1.10±0.10** 0.83±0.07** 0.0030±0.0002** 0.0022±0.0002**
表3 高糖高脂膳食并STZ对大鼠室间隔厚度和左心室壁厚度的影响(±s)Tab.3 The effect of high fat-high sucrose diet and streptozotocin on interventricular septal thickness and left ventricular wall thickness in the rats(±s)
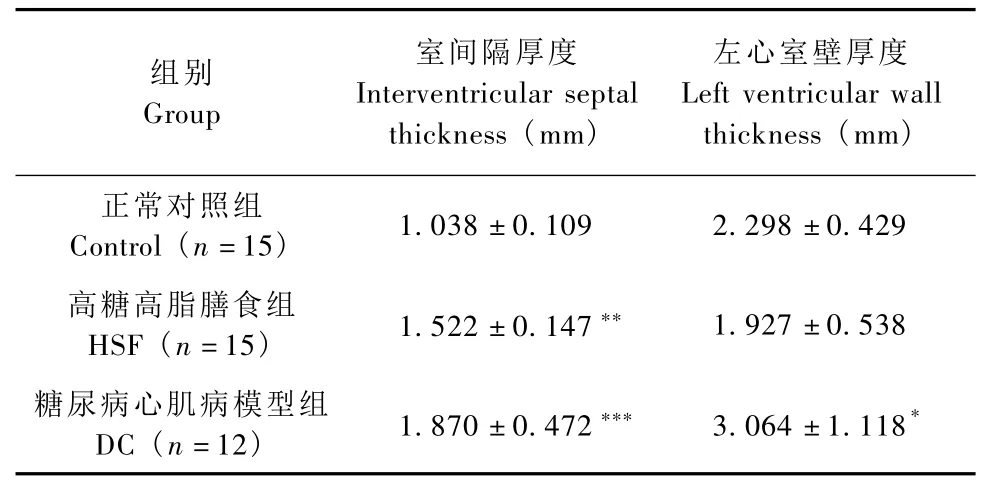
表3 高糖高脂膳食并STZ对大鼠室间隔厚度和左心室壁厚度的影响(±s)Tab.3 The effect of high fat-high sucrose diet and streptozotocin on interventricular septal thickness and left ventricular wall thickness in the rats(±s)
注:与正常对照组相比,*P <0.05,**P <0.01,***P<0.001Note:*P <0.05,**P <0.01,***P <0.001,vs.control group
正常对照组Control(n=15)1.038±0.109 2.298±0.429高糖高脂膳食组HSF(n=15) 1.522±0.147** 1.927±0.538糖尿病心肌病模型组DC(n=12) 1.870±0.472*** 3.064±1.118*组别Group室间隔厚度Interventricular septal thickness(mm)左心室壁厚度Left ventricular wall thickness(mm)
2.4 心脏胶原含量测定
与正常对照组比较,糖尿病心肌病模型组大鼠心脏胶原含量明显增加(P<0.05),高糖高脂膳食组没有明显改变。见图2。
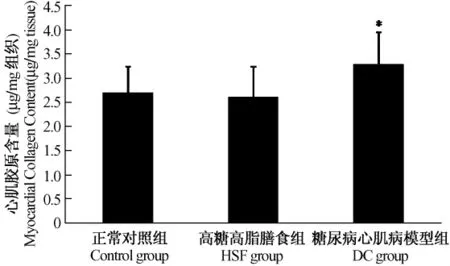
注:与正常对照组相比,*P<0.05图2 高糖高脂膳食并STZ对大鼠心脏胶原含量的影响Note:*P <0.05,vs.control groupFig.2 The effect of high fat-high sucrose diet with STZ injection on cardiac collagen content in the rats
2.5 心脏功能和结构相关性分析
采用Pearson相关分析,对各组动物心功能和结构指标作相关性检验,结果发现表征收缩功能的指标 +dp/dtmax与 HW/BW(r=-0.540,P <0.01)和LVW/BW(r=-0.532,P<0.01)都呈明显的负相关,表征舒张功能的指标-dp/dtmax与HW/BW(r=0.545,P <0.01)和 LVW/BW(r=0.443,P <0.05)呈明显的正相关,心排量(CO)与 LVW/BW(r=-0.386,P<0.05)呈明显的负相关,结果见图3。
3 讨论
实验室常用的DC动物模型包括转基因动物(如db/db糖尿病小鼠、ob/ob肥胖小鼠、CIRKO小鼠、IRS-1 KO 小鼠、Zucker糖尿病肥胖大鼠等)、单纯高脂饲料喂养或者单纯化学试剂诱导(STZ、四氧嘧啶)等。本研究采用高糖高脂膳食喂养负荷STZ诱导,高糖高脂膳食可以一方面诱导胰岛素抵抗状态,另一方面增加外源性的脂肪供给,并负荷小剂量STZ部分破坏胰岛细胞功能,已被证明可以保持持续的高血糖状态和造成糖脂代谢的紊乱,类似临床2型糖尿病患者,并且有建立周期短、死亡率低等优点[5]。本实验也证实,高糖高脂膳食喂养负荷 STZ诱导的糖尿病大鼠血糖值保持了稳定的高水平状态,在心功能测定时间窗下,空腹血糖(FBG)值为(18.8±5.6)mmol/L,明显高于正常对照组(3.6±0.3)mmol/L和单纯高糖高脂膳食大鼠(4.0±0.2)mmol/L(P<0.001)。
外周和心脏糖脂代谢紊乱是糖尿病心脏结构和功能紊乱的重要诱因。高血糖可导致心脏I型和III型胶原沉积诱发心肌间质纤维化;高血糖引发氧化应激可提高AGEs含量和 RAGE表达,激活 NF-κB,导致调控心脏 α-重链肌球蛋白(α-myosin heavychain,α-MHC)转化为 β-MHC 的基因表达,改变心肌的收缩能力;同时AGEs积聚,还可改变结构蛋白升高心肌硬度[6,7]。而心脏能量利用转换导致脂肪酸底物含量、转运和氧化率增高,葡萄糖的利用率下降,心脏耗氧量和做功能力的下降,加重心肌病的损害[8]。
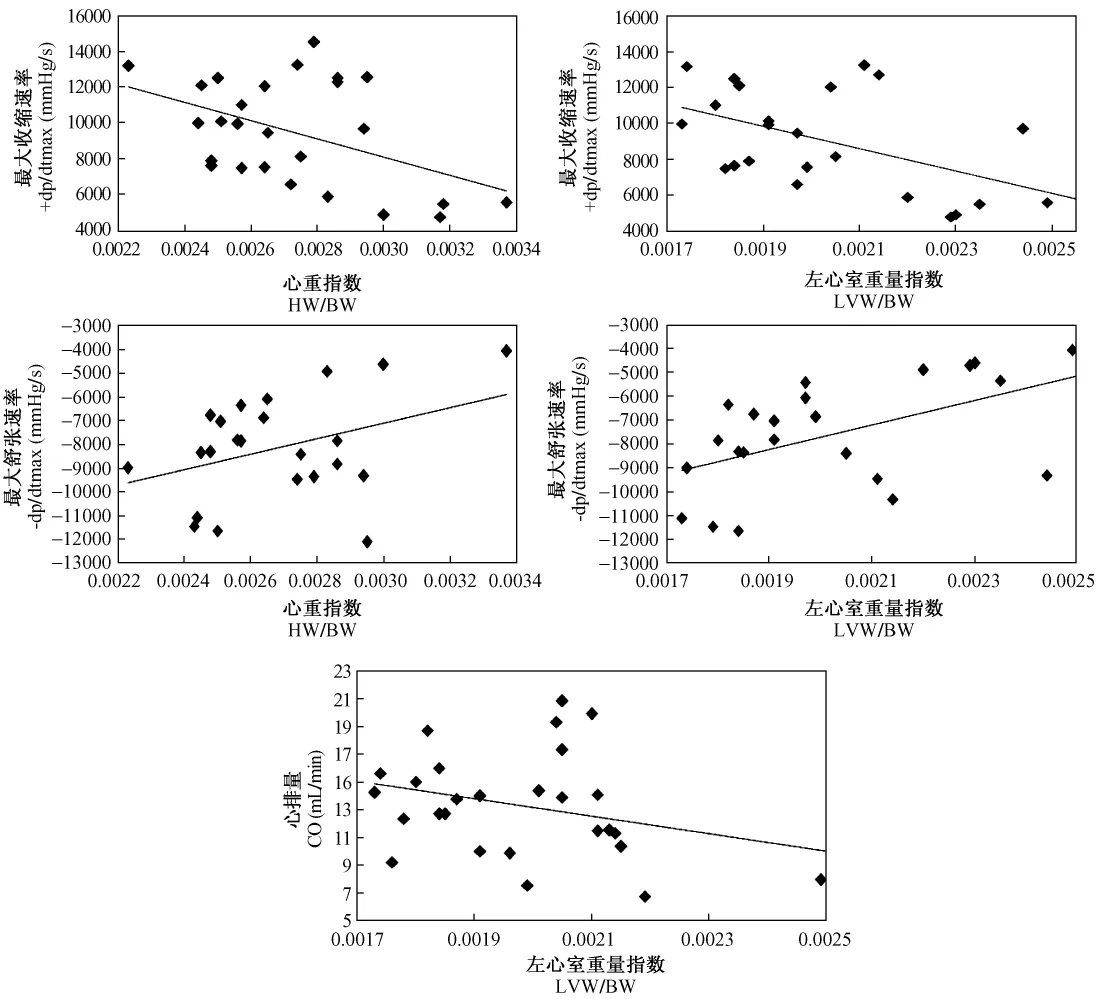
图3 大鼠心脏功能和结构相关性分析Fig.3 Pearson correlation analysis of cardiac functional and structural parameters in the rats
糖尿病心肌病变早期心脏功能障碍以舒张功能异常为主,表现为左心室舒张和被动充盈受损[9,10],最终可发展为心衰(可不伴随射血分数的改变)。组织多普勒成像是检测心衰不伴随射血分数变化患者左右心室长轴局部收缩功能的常用手段,用于判断射血分数预后情况,有临床研究显示对于DC舒张功能紊乱的患者检测结果仅显示出轻度的收缩功能障碍,这可能与 DC 病变发展的阶段有关[11-15]。本研究血流动力学结果提示,大鼠高糖高脂膳食后心脏仅LVEDP值升高,其余指标未见明显变化,提示舒张功能出现一定障碍。负荷小剂量STZ后,除了有明显的舒张功能异常(LVEDP、-dp/dtmax升高)外,还出现收缩功能异常(LVSP、+dp/dtmax值降低),并出现了心排量的明显降低(SV、CO降低)。提示12周的单纯高糖高脂膳食喂养可引起心脏温和的功能异常,主要表现在舒张功能,负荷STZ破坏胰岛细胞后引发的高血糖状态以及触发的一系列能量代谢紊乱才可能是广泛的心脏功能紊乱主要诱因,但是深入机制还需进一步探讨。
心脏结构重塑是导致功能紊乱的重要原因。心肌内膜下纵向纤维受心肌缺血、纤维化和肥厚影响大,糖尿病患者心室长轴收缩能力下降会触发心室径向厚度和重量代偿性增加以维持左心室射血分数,从而引发左心室肥厚[16,17],患者表现为左心室重量、左心室壁厚度、左心室重量指数明显增加[18,19],从而导致舒张功能和收缩功能的障碍,射血分数降低[20]。本研究的结果显示,高糖高脂饲料喂养后,仅显示出室间隔厚度增加和轻度的心肌细胞肥大,其他心肌结构未见明显变化。高糖高脂膳食负荷STZ后,心脏结构出现了明显的变化,表现为胶原沉积,全心重指数和左心室重指数、左心室壁厚度和室间隔厚度增加,显示左心室肥厚。统计学结果显示出心脏血流动力学指标异常与结构重塑之间的显著相关性,其中全心重指数和左心室重量指数在影响心脏功能中占有重要的位置。
综上所述,高糖高脂负荷小剂量STZ腹腔注射可引起心脏舒张和收缩功能障碍和左心室肥厚等结构紊乱状态,功能损伤与结构重塑具明显相关性,与临床糖尿病心肌病患者心脏病变发生相似,可作为建立实验性糖尿病心肌病变动物模型的一种方法。
(本文图1见封二。)
[1] Rubler S,Dlugash J,Yuceoglu YZ,etal. New type of cardiomyopathy associated with diabetic glomerulosclerosis[J].Am J Cardiol,1972,30(6):595- 602.
[2] David S. H. Bell. Heartfailure:a serious and common comorbidity of diabetes[J].Clin Diabetes,2004,22(2):61-65.
[3] Fang ZY,PrinsJB,MarwickTH.Diabeticcardiomyopathy:evidence,mechanisms,and therapeutic implications[J].Endocr Rev,2004,25(4):543-567.
[4] Abe T,Ohga Y,Tabayashi N,et al.Left ventricular diastolic dysfunction in type 2 diabetes mellitus model rats[J].Am J Physiol Heart Circ Physiol,2002,282(1):H138- H148.
[5] Asghar O, Al-Sunni A, Khavandi K, et al. Diabetic cardiomyopathy[J].Clin Sci(Lond),2009,116(10):741-760.
[6] 董世芬,洪缨,樊江波,等.实验性2型糖尿病心肌病大鼠模型的建立与评价[J].中国实验动物学报,2009,17(4):1-7.
[7] Ma H,Li SY,Xu P,et al.Advanced glycation endproduct(AGE)accumulation and AGE receptor(RAGE)up-regulation contribute to the onset of diabetic cardiomyopathy[J].J Cell Mol Med,2009,13(8B):1751- 1764.
[8] Han B,Baliga R,Huang H,et al.Decreased cardiac expression of vascular endothelial growth factor and redox imbalance in murine diabetic cardiomyopathy[J].Am J Physiol Heart Circ Physiol,2009,297(2):H829- H835.
[9] Belke DD,Larsen TS,Gibbs EM,et al.Altered metabolism causes cardiac dysfunction in perfused hearts from diabetic(db/db)mice[J].Am J Physiol Endocrinol Metab,2000,279(5):E1104-E1113.
[10] Zabalgoitia M,Ismaeil MF,Anderson L,et al.Prevalence of diastolic dysfunction in normotensive,asymptomatic patients with well-controlled type 2 diabetes mellitus[J].Am J Cardiol,2001,87(3):320-323.
[11] Boyer JK,Thanigaraj S,Schechtman KB,et al.Prevalence of ventricular diastolic dysfunction in asymptomatic,normotensive patients with diabetes mellitus[J].Am J Cardiol,2004,93(7):870-875.
[12] Sveälv BG,Olofsson EL,Andersson B. Ventricular long-axis function is of major importance for long-term survival in patients with heart failure[J].Heart,2008,94(3):284- 289.
[13] Fang ZY,Schull-Meade R,Leano R,et al.Screening for heart disease in diabetic subjects[J].Am Heart J,2005,149(2):349-354.
[14] Fang ZY,Yuda S,Anderson V,etal. Echocardiographic detection of early diabetic myocardial disease[J].J Am Coll Cardiol,2003,41(4):611- 617.
[15] Yu CM,Lin H,Yang H,etal. Progression ofsystolic abnormalities in patients with“isolated”diastolic heart failure and diastolic dysfunction[J].Circulation,2002,105(10):1195-1201.
[16] Maciver DH,Townsend M.A novel mechanism of heart failure with normal ejection fraction[J].Heart,2008,94(4):446-449.
[17] Aurigemma GP,Zile MR,Gaasch WH.Contractile behavior of the left ventricle in diastolic heart failure:with emphasis on regional systolic function[J].Circulation,2006,113(2):296-304.
[18] Fang ZY,Leano R,Marwick TH. Relationship between longitudinal and radial contractility in subclinical diabetic heart disease[J].Clin Sci,2004,106(1):53- 60.
[19] Ozasa N,Furukawa Y,Morimoto T,et al.Relation among left ventricular mass,insulin resistance,and hemodynamic parameters in type 2 diabetes[J].Hypertens Res,2008,31(3):425- 432.
[20] van Heerebeek L,Hamdani N,Handoko ML,et al.Diastolic stiffness of the failing diabetic heart:importance of fibrosis,advanced glycation end products,and myocyte resting tension[J].Circulation,2008,117(1):43- 51.
Establishment of a Rat Model of Experimental Diabetic Cardiomyopathy and Correlations between Cardiac Functional and Structural Parameters
DONG Shi-fen,HONG Ying,SUN Jian-ning,HAO Ying-zhi,YU Hai-shi
(Department of Traditional Chinese Medicine Pharmacology,School of Chinese Pharmacology,Beijing University of Chinese Medicine,Beijing 100102,China)
ObjectiveThe aim of this study was to establish a rat model of experimental diabetic cardiomyopathy,to observe the changes of cardiac function and structure,and to analyze the correlation between them.MethodsForty-five male Wistar rats(180 g-200 g)were randomly divided into 3 groups:the control group,high fat-high sucrose group(HSF)and diabetic cardiomyopathy model group(DC).The rats in the control group were fed with normal food,rats in HSF and DC groups were fed with high fat-high sucrose diet(consisted of 20%sucrose,10%lard,2.5%cholesterol,1%bile salt and 66.5%normal food)for totally 12 weeks.Rats in the DC group were injected i.p.with a single dose of 30 mg/kg streptozotocin(dissolved in citric acid-sodium citrate buffer,pH=4.5)after 6 weeks’feeding.FBG were tested after 72 hours and FBG≥7.77 mmol/L was considered as the standard for establishment of diabetes mellitus.Rats in the control and HSF groups were i.p.injected with citric acid-sodium citrate buffer(pH =4.5).At the end of experiment(the twelfth week),heart rate(HR),stroke volume(SV),cardiac output(CO),left ventricular systolic pressure(LVSP),left ventricular end diastolic pressure(LVEDP),the maximum rate of myocardial contraction(+dp/dtmax)and the maximum diastolic rate of myocardium(-dp/dtmax)were measured using MP150 polygraph physiological signal recorder to evaluate the cardiac function.The whole heart weight(HW),left ventricular weight(LVW),HW/body weight(HW/BW),LVW/BW,Interventricular septal thickness(IST),left ventricular wall thickness(LVWT) and left ventricular collagen concentration were measured to assess the cardiac structure.ResultsCompared with the control group,rats in the DC group showed significant increase of LVEDP and-dp/dtmax(P <0.05)and decrease of LVSP,+dp/dtmax,HR,SV and CO(P<0.05).It also exhibited significant increase of HW/BW and LVW/BW indexes(P <0.01),IST and LVWT parameters(P<0.001,P<0.05)and collagen concentration(P<0.05).Significant correlations between cardiac functional and structural parameters were also observed.ConclusionsAn experimental diabetic cardiomyopathy model in rats can be established by high fat-high sucrose diet with i.p.injection of streptozotocin,presenting similar clinical manifestation of diabetic cardiomyopathy in humans,and it shows remarkable correlation between the cardiac dysfunction and structural alterations.
Experimental diabetic cardiomyopathy,model;Cardiac function;Cardiac structure;Statistical correlation;Rat
R587.1,R542.2
A
1005-4847(2010)06-0457-06
10.3969/j.issn.1005-4847.2010.06.002
2010-06-03
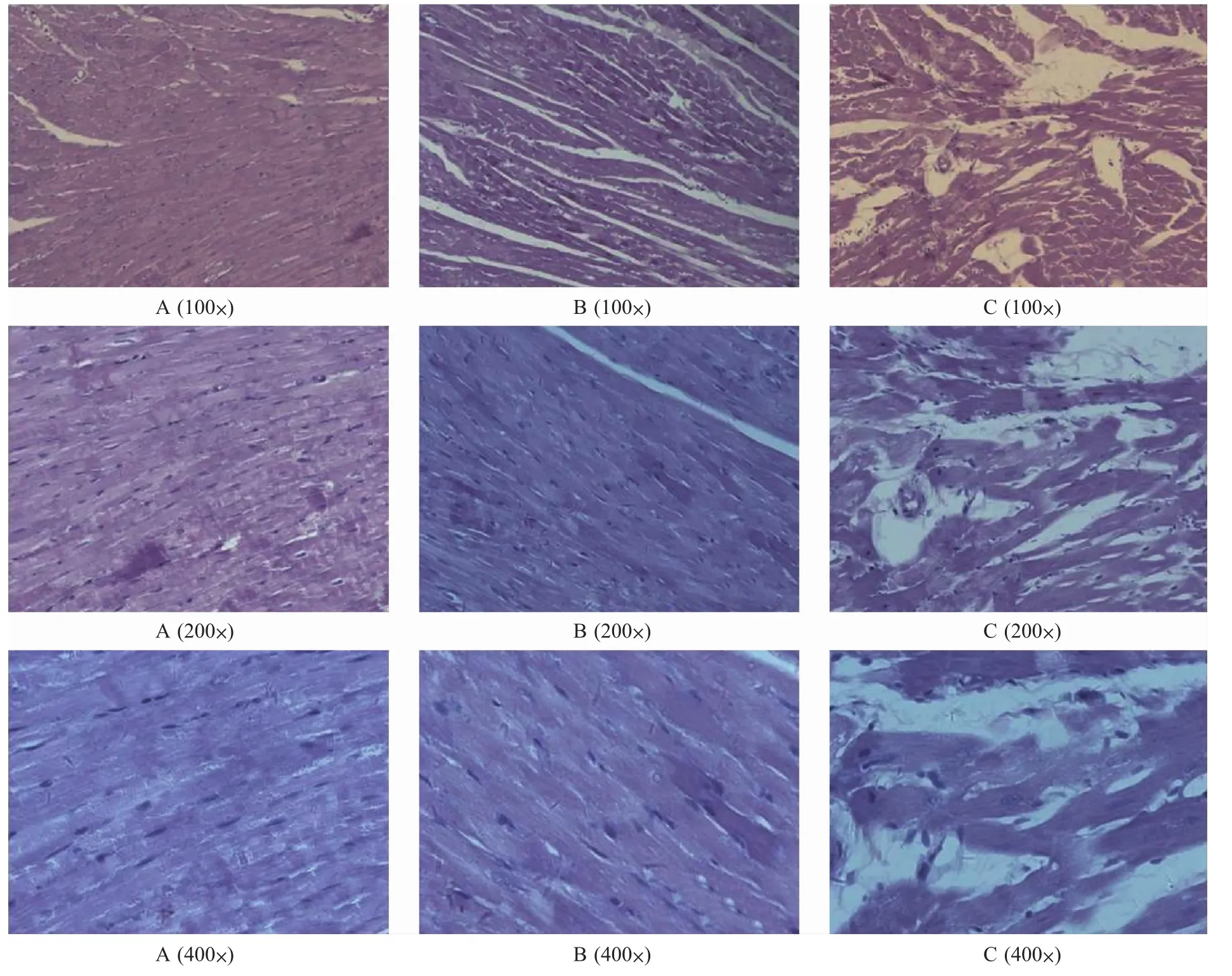
A. 正常对照组;B. 高糖高脂膳食组;C. 糖尿病心肌病模型组
图1 大鼠HE染色病理学观察
A. Control group; B. HSF group; C. DC group
Fig.1 Histopathological changes of the left ventricle (HE staining)
国家自然科学基金资助项目(编号:30840103);北京中医药大学在读研究生资助项目(编号:2009JYBZZ-XS034)。
董世芬(1983-),女,博士研究生,研究方向心血管药理。Tel:010-84738626,E-mail:tedong4444@yahoo.com.cn
孙建宁教授,博士生导师,研究方向中药药理学。Tel:010-84738627,E-mail:jn_sun@sina.com

