1.2%阿维菌素微胶囊悬浮剂防治松材线虫田间药效试验
马力,葛迎春,毕冰,赵杨,杜淑华
(1.黑龙江省平山林业制药厂,哈尔滨 150324;2.东北林业大学;3.哈尔滨市阿城区林业局)
1978年Kitasato研究所从日本Kawana地区(Kawana,Ito City,Shizuoka Prefecture,Japan)的土壤样品中分离到链霉菌菌株MA-4680(NRRL 8165),其发酵液对小鼠(Mice)肠道寄生虫有较高驱虫活性。该菌株经美国Merck Sharp&Dohme Research Laboratories鉴定为新种,定名为Streptomyces avermitilis[1-2]。其产生的驱虫活性物质是一族结构相似的大环内脂类化合物,共有8个主要组份,分别命名为A1a、A1b、A2a、A2b、B1a、B1b、B2a和B2b。其中小 a 组份含量在 80%以上,小b组份含量在20%以下[3-4]。该组化合物被统称为阿维菌素(Avermectins,AVMs)。AVMs通过阻断线虫神经元之间神经冲动传导,使虫体麻痹而死。AVMs具有优异的驱虫活性和安全性。是目前广泛使用的畜禽体内外抗寄生虫药物,也是农业上广泛使用的高效杀虫剂。目前已商品化的有伊维菌素(Ivermectin,IVM)、阿维菌素(Avermectin B1a,AVM 或Abamectin)、多拉菌素(Doramectin,DOR)和 Eprinomectin等[5]。
松材线虫[Bursaphelenchus xylophilus(Steiner&Buhrer 1934)Nikle 1970,同物异名:Aphelenchoides xylophilus Striner&Buhrer Bursaohelenchus lignicolus Mamiya&Kiyohara]引起松树萎蔫病(Pine Wilt Disease),对日本、韩国、欧洲和中国局部地区的松树造成危害[6-7]。可危害57种松属(Pinus)植物及雪松属(Cedrus)、冷杉属(Abies)、云杉属(Picea)、落叶松属(Larix)和黄杉属(Pseudotsuga)等14种非松属针叶树。其传播介体昆虫主要是松墨天牛(Monochamus alternatus)。我国自1982年首次在南京中山陵发现由于松树萎蔫病死亡的黑松,目前松材线虫的疫区已扩展到江苏、安徽、浙江、广东、山东、台湾及香港等15个省(市、区),对森林生态效益造成巨大损失[6]。
1 试验材料
试验地设在松材线虫(B.xylophilus)新疫区山东省荣成市石岛开发区朝阳山。试验地为石山、临海,土层薄,松树长势缓慢。山体为火成岩,土壤pH值为6.5,有机质含量0.91%。松林通风透光较好。选择15~35年生感病黑松(Pinus thunbergii)作为试验对象,病树木屑中线虫分离物经镜检鉴定确认为松材线虫。药害对照选取同龄健康黑松。
试验药剂选用1.2%阿维菌素微胶囊悬浮剂(黑龙江省平山林业制药厂)。对照药剂为市售1.8%阿维菌素乳油。
2 试验方法
2.1 小区安排
随机选取20个试验小区(编号为I-1,2,3,4,5;II-1,2,3,4,5;III-1,2,3,4,5和IV-1,2,3,4,5),每小区中选病树3棵。空白对照区1个(编号CK1),选病树5棵。药害对区 ,照1个(编号CK2),选取健康黑松5棵。
2.2 药剂施用
病树钻孔,每孔取木屑40~50g浅盆法分离线虫计算施药前虫口密度(条/g)。
2008年8月5日开始试验,施药1次。病树钻孔,医用注射器施药,施药后石蜡膜封口。试验药物1.2%阿维菌素微胶囊悬浮剂用药量根据病树胸径计算(mL药量/cm病树胸径)设0.08mL/cm(实验小区I-1,2,3,4,5)、1.0 mL/cm(实验小区 II-1,2,3,4,5)、1.2 mL/cm(实验小区III-1,2,3,4,5)3个处理。对照药剂1.8%阿维菌素乳油用药量(实验小区IV-1,2,3,4,5)。空白对照注射1.2mL/cm清水(空白对照区CK1)。药害对照注射1.2mL/cm清水(药害对照区CK2)。
施药后30d、60d观察记录病树及药害对照树生长情况。并采取木屑分离线虫,计算虫口密度。记录同期相关气象资料。
2.3 数据处理
根据虫口减退率和防治效果确定药效,计算公式如下:

3 结果与分析
试验药物1.2%阿维菌素微胶囊悬浮剂用药量根据病树胸径计算(mL药量/cm病树胸径)设0.08、1.0、1.2 mL/cm 3个处理30d平均防治效果(图1A:1-3)依次为98.85%、99.02%和99.42%;60d平均防治效果(图1B:1-3)依次为73.33%、86.66%和93.33%。对照药剂1.8%阿维菌素乳油30d平均防治效果(图1A:4)为 75.57%,60d平均防治效果(图 1B:4)为46.66%。空白处理CK1组,30d时4棵病树死亡、1棵濒临死亡,60d时全部死亡。试验结束为止,药害处理CK2组5棵黑松均生长正常,未出现药害症状。
30d和60d时试验药物1.2%阿维菌素微胶囊悬浮剂平均防治效果均高于同期对照药剂1.8%阿维菌素乳油平均防治效果。不同浓度的1.2%阿维菌素微胶囊悬浮剂30d时平均防治效果(图1A)差异不明显,60d时(图1B)差异明显。由于病情发展和药物浓度下降,同浓度同种试验药物30d时平均防治效果(图1C:1a 、2a 、3a、4a)均高于 60d时平均防治效果(图1C:1b、2b 、3b 、4b)。
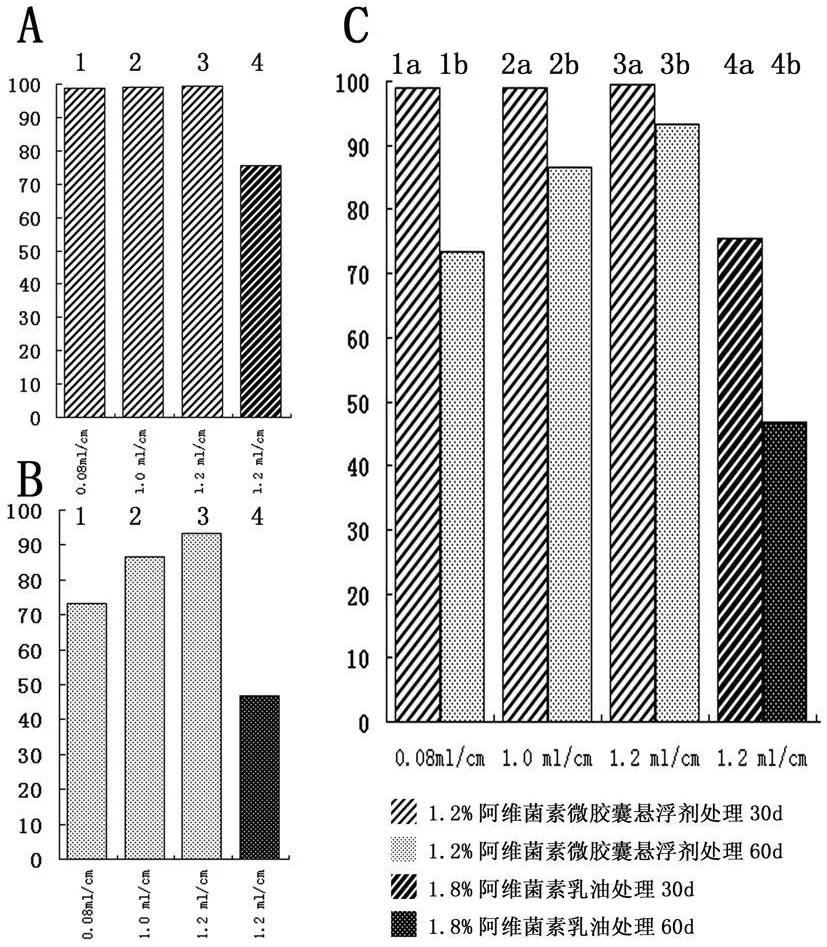
图1 1.2%阿维菌素微胶囊悬浮剂对松材线虫平均防治效果
本试验所有数据均用Microsoft·Excel 2003(Microsoft Company,美国)进行平均数和标准差计算,并用邓肯氏新复极差检验法(Duncan's Multiple Range Test,DMRT)进行检验。结果表明施药后60d,1.2%阿维菌素微胶囊悬浮剂施药量为1.0、1.2 mL/cm2个处理间无显著差异,与1.2%阿维菌素微胶囊悬浮剂施药量为0.08mL/cm、1.8%阿维菌素乳油施药量1.2 mL/cm差异显著。
施药当日天气晴,东北风3~4级,温度23.2℃,相对湿度63%。试验期间,最高气温29.5℃,最高日平均气温 24.5℃,最低气温7.8℃,最低日平均气温12.3℃。期间降雨7次,总降水量127.5mm。
4 讨论
阿维菌素乳油和高渗乳油存在见光易降解[9]、土壤中使用易于被微生物分解等缺点[10]。应用1.2%阿维菌素微胶囊可以避免上述缺点。微胶囊通过选择性的半透膜有控制地释放出农药,发挥相应的药效作用。由于微胶囊化改变了原药剂的表面性质,而使接触毒性、药害、令人不愉快的气味和易燃性等大为降低,减少了对环境的污染。
室内生物活性测定表明,1.2%阿维菌素微胶囊对松材线虫的致死中浓度LD50为13.98mg/kg,95%的置信限为12.82~15.26 mg/kg,LD95为28.41mg/kg。施用该药前可参考该数据根据具体情况做适量调整。
1.2%阿维菌素微胶囊对蜜蜂(Apis mellif era)、家蚕(Bomby x mori)、斑马鱼(Brachydanio rerio)的急性毒性试验与本试验同期进行。根据化学农药环境安全评价试验准则,1.2%阿维菌素微胶囊对蜜蜂急性毒性为“高毒”级,对家蚕急性毒性为“剧毒”级,对斑马鱼急性毒性为“剧毒”级。因此,施用1.2%阿维菌素微胶囊剂应充分考虑对相关农业生产和渔业生产的影响。
黑龙江省平山林业制药厂生产的1.2%阿维菌素微胶囊剂具有防治效果良好、价格适中等优点,适合应用于松材线虫引起的松树萎蔫病防治。
[1] Richard W.Burg,Brinton M.Miller,Edward E.Baker.Avermectins,New Family of Potent Anthelmintic Agents:Producing Organism and Fermentation[J].Antimicrobial Agents and Chemotherapy,1979,15(3):361-367.
[2] Haruo Ikeda,Satoshi Ohmura.Avermectin Biosynthesis[J].Chemical Reviews,1997,97:2591-2609.
[3] 宋渊,曹贵明,陈芝,等.阿维菌素高产菌株的选育及阿维菌素B1的鉴定[J].生物工程学报,2000,16(1):31-35.
[4] G.Albers-Schoenberg,B.H.Arison,J.C.Chabala,A.W.Douglas,Avermectins.Structure determination[J].Journal of the American Chemical Society,1981,103(14):4216-4221.
[5] 孙英健.阿维菌素对土壤微生物的影响及在蚯蚓体内积蓄与消除的研究.硕士论文[D].中国农业大学,2003.
[6] 杨宝君,潘宏阳,汤坚,等.松材线虫病[M].北京:中国林业出版社,2003:1-6.
[7] Mamiya Y.History of pine wilt disease in Japan[J].Journal of Nematology,1988,20(2):219-226.
[8] Macconell J G,Demchak R J,Preiser F A,et al.Relativity Toxicity and Penetrability of Abamectin and Its 8,9-Oxide[J].J Ag-ric Food Chem.1989,37:1498-1501.
[9] Bloomr A,MathesonⅢ.Environmental Assessment of Avermectin by The US Food and Drug Administration[J].Vet Paras-itd,1993,48(1-4):281-294.

