卵巢癌组织中IL-6和IL-8及TNF-α mRNA的表达及其意义
刘淑英 储 平 杨 铎 张玉平
济宁市第一人民医院(272111)
卵巢癌是妇产科常见肿瘤之一,由于起病隐匿,难以早期发现、早期治疗,因而成为妇产科病死率最高的恶性肿瘤[1,2],严重威胁着患者的生命。有研究证实,卵巢癌患者血清、腹水中IL-6、IL-8、TNF-α等细胞因子的表达异常升高[3],但卵巢癌组织中上述因子的表达情况及其在癌症发生、发展过程中的作用机制尚不明确。为此,我们采用荧光定量PCR的方法检测了正常卵巢组织及卵巢癌组织中IL-6、IL-8、TNF-α等mRNA的表达水平,以期通过分析细胞因子转录水平的改变,探讨卵巢癌的内在发病机制。
1 材料与方法
1.1 研究对象
选择山东省济宁市第一人民医院2004年5月至2008年11月收治的原发卵巢癌患者68例为实验组,年龄32~72岁,平均62岁,术前均未接受放化疗治疗。正常对照组卵巢组织取自同期60例子宫肌瘤行全子宫加一侧或双附件切除患者,年龄39~59岁,平均年龄55岁。两组患者年龄差异无统计学意义(P>0.05),所有诊断均经病理检查证实。
1.2 实验方法
1.2.1 标本收集
术中切取标本,用无菌生理盐水冲净血液后迅速置于液氮中冷冻,然后转入- 80℃冰箱保存备用。
1.2.2 引物设计与合成
根据GeneBank数据库提供的IL-6、IL-8、TNF-α基因以及内参β-Actin(ACTB)基因序列,设计跨外显子引物,并采用Blast在线对所设计的引物进行特异性的比对(http://www.ncbi.nlm.nih.gov/BLAST),引物序列见表1。所有引物均由上海博尚公司合成。
1.2.3 组织总RNA的提取及cDNA的合成
将冻存的组织在液氮中研磨,加入Trizol(Invitrogen公司)充分裂解细胞,按照说明书提取总RNA,经过酚和氯仿抽提后溶解到DEPC处理的水中。琼脂糖变性凝胶电泳检测RNA的完整性,紫外线分光光度计测定吸光度值以确定RNA 浓度和纯度。

表1 实时荧光定量PCR的引物序列
1.2.4 cDNA合成
反应体系(20μL)含RNA 2μg、Oligo (dT)1μL、M-MLV逆转录酶 (200U/μL) 1μL、dN TP (10mmol/L)1μL、5×缓冲液4μL及DEPC处理三蒸水。反应条件为42 ℃延伸60min合成cDNA,95℃ 5min 灭活M-MLV逆转录酶,4℃冷却5min,置于- 20℃备用。
1.2.5 实时荧光定量PCR
应用ABI 7500实时荧光定量PCR仪进行半定量检测,反应体系(25μL)含:第一链cDNA 1μL,2×SYBR Green Mix (Takara公
1.3 统计学处理
采用SPSS11.0和Excel统计软件对实验数据统计分析。相对表达率以±s表示,经正态性检验和方差齐性检验后,组间比较采用独立样本t检验,P<0.05为有统计学差异,P<0.01为统计学差异显著。
2 结 果
2.1 PCR扩增特异性
图1 各基因扩增产物的溶解曲线
IL-6、IL-8、TNF-α以及内参基因ACTB扩增产物的溶解曲线均呈现单一峰(图1);琼脂糖电泳结果均显示为单一条带,其片段大小与预先设计的产物大小一致,没有非特异性扩增和引物二聚体的存在。上述结果说明实时荧光定量PCR扩增反应体系具有很好的特异性。司)12.5μL,5μmol/L上下游引物各1μL,三蒸水9.5μL。反应条件为95℃ 5s、95℃ 15s、60℃ 15s、72℃ 35s(收集荧光),40个循环。经溶解曲线和2%琼脂糖电泳,判断扩增产物特异性。溶解曲线反应条件:95℃ 15s,60℃ 1min,95℃ 15s,6o℃ 15s,速度为1.6℃/s。
1.2.6 计算相对表达率
内参基因表达稳定,受实验因素影响小,因而可通过目的基因相对于内参基因ACTB的表达比来表示不同目的基因的表达变化。相对定量分析(2△△CT)公式为:Ratio=2△CT目的(对照一样本)/2△CT内参(对照一样本)。
2.2 IL-6、IL-8、TNF-α在正常和卵巢癌组织中的表达
IL-6、IL-8、TNF-α在所有检测标本中均存在表达,其相对于内参基因ACTB的相对表达比见图2。
分析结果显示,卵巢癌组织中IL-6和IL-8的表达明显高于正常对照组织,分别达到正常组织表达量的(8.78±1.32)和(11.41±1.65)倍,统计学差异非常显著(P<0.01);与其相比,肿瘤组织中TNF-α的表达差异较小,为正常对照组织的(2.19±1.02)倍,但仍具有明显的统计学差异(P<0.05),见表2。

表2 IL-6、IL-8、TNF-α在正常和卵巢癌组织中的表达
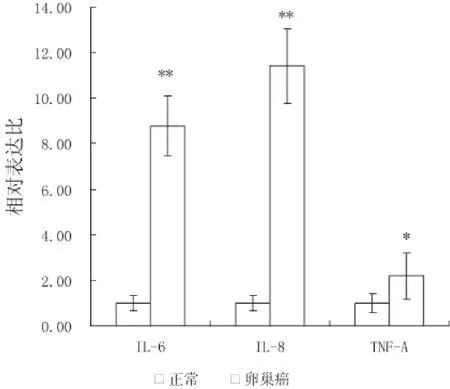
图2 IL-6、IL-8、TNF-α在正常和卵巢癌组织中的表达
3 讨 论
卵巢癌是妇科病死率最高的恶性肿瘤,其发病机制的研究受到了越来越多的重视[4]。近年来,有关于卵巢癌细胞因子的研究取得了可喜的进展,研究发现卵巢癌患者外周血多种细胞因子的表达水平出现明显的异常[5,6],这说明细胞因子的表达与卵巢癌的发生、发展存在着密切的关系。但值得注意的是,外周血细胞因子的表达水平受到机体和外来多种因素的影响,因而不能直接反映肿瘤局部的变化情况。那么卵巢癌肿瘤组织中细胞因子的表达是否也存在着相应的变化呢?这种改变是否发生于细胞因子的转录水平呢?为了解决上述问题,我们采用实时荧光定量PCR的方法检测了卵巢癌组织中IL-6、IL-8、TNF-α等细胞因子mRNA的表达,并与正常卵巢组织对比,分析了上述细胞因子的表达变化与卵巢癌发病之间的关系。
目前实时荧光定量PCR技术不但实现了从定性到定量的飞跃,而且具有高度的敏感性、准确性以及较好的可重复性,目前已逐渐成为检测低丰度mRNA表达的最敏感准确的方法。
IL-6主要来自于单核-巨噬细胞、淋巴细胞以及成纤维细胞的合成分泌,在机体免疫应答过程中发挥着重要的作用[7]。近年来发现肿瘤细胞也可分泌IL-6。我们的检测结果发现,卵巢癌组织中IL-6 mRNA表达明显高于正常组织,两组比较有显著性差异,这说明卵巢癌发病过程中,肿瘤细胞和浸润淋巴细胞合成IL-6水平明显增加。Nilsson等[8]发现体外培养的卵巢癌细胞培养上清中IL-6的活性明显增强,并可进一步刺激肿瘤细胞的增殖、减少癌细胞之间的黏附作用、促进新生血管的生成,进而促进肿瘤的转移和浸润,因此肿瘤细胞分泌IL-6对于肿瘤的发生、发展起到了重要的作用。另一方面,肿瘤局部高表达的IL-6,作为一种免疫抑制因子,可通过旁分泌作用抑制浸润淋巴细胞、单核细胞的肿瘤细胞的增殖和杀伤作用,从而达到使肿瘤细胞逃避免疫监视、免疫杀伤的作用。
IL-8是一种多功能趋化因子和促血管生长因子,可促进肿瘤的生长、新生血管的生成,并通过影响细胞的黏附促进肿瘤细胞的转移[9]。我们的检测结果显示,与IL-6相类似,卵巢癌组织中IL-8的表达水平也明显高于正常卵巢组织。
TNF-α是单核-巨噬细胞产生的一种多功能细胞因子,参与多项免疫应答的调节。我们的实验结果证实卵巢癌组织中TNF-α的转录水平高于正常卵巢组织。有研究认为,肿瘤细胞合成的TNF-α可通过自分泌和旁分泌作用刺激肿瘤细胞自身的增殖,但也有学者的观点恰好相反,认为TNF-α可诱导肿瘤出血、坏死,从而达到抑制肿瘤生长的作用,甚至有望成为治疗肿瘤的生物制剂[10]。
卵巢癌细胞合成、分泌的细胞因子通过自分泌、旁分泌等作用可诱导肿瘤组织中浸润的单核细胞、淋巴细胞等释放的细胞因子发生改变,形成级联放大作用,甚至影响到外周血、腹水中细胞因子的水平,从而达到临床检测的目的。
需要注意的是,机体的细胞因子形成一个复杂的网络系统,相互协调、相互制约,任何一种细胞因子的改变都不可能是孤立的,而且在不同的生理和病理条件下往往发挥不同的免疫学作用。因此,肿瘤环境下细胞因子的变化需要综合分析,才能有助于探讨肿瘤的发生、发展。
[1]Crijns AP,Fehrmann RS,De Jong S,et al. Survival-related profile,pathways,and transcription factors in ovarian cancer[J]. PLoS Med, 2009,6(2):24.
[2]Akeson M,Jakobsen AM,Zetterqvist BM,et al. A population-based 5-year cohort study including all cases of epithelial ovarian cancer in western Sweden: 10-year survival and prognostic factors[J]. Int J Gynecol Cancer,2009,19(1): 116-123.
[3]Darai E,Detchev R,Hugol D,et al. Serum and cyst fluid levels of interleukin(IL)-6,IL-8 and tumour necrosis factor-alpha in women with endometriomas and benign and malignant cystic ovarian tumours[J]. Hum Reprod,2003,18(8):1681-1685.
[4]Jr Bast RC,Hennessy B,Mills GB. The biology of ovarian cancer:new opportunities for translation[J]. Nat Rev Cancer,2009,9(6):415-428.
[5]Yurkovetsky ZR,Linkov FY,E MD,et al. Multiple biomarker panels for early detection of ovarian cancer[J]. Future Oncol,2006,2(6):733-741.
[6]Fields MM,Chevlen E. Ovarian cancer screening: a look at the evidence[J].Clin J Oncol Nurs,2006,10(1):77-81.
[7]Heikkila K,Ebrahim S,Lawlor DA. Systematic review of the association between circulating interleukin-6 (IL-6) and cancer[J]. Eur J Cancer,2008,44(7): 937-945.
[8]Nilsson MB,Langley RR,Fidler IJ. Interleukin-6,secreted by human ovarian carcinoma cells,is a potent proangiogenic cytokine[J]. Cancer Res,2005,65(23): 10794-10800.
[9]Waugh DJ,Wilson C. The interleukin-8 pathway in cancer[J]. Clin Cancer Res,2008,14(21):6735-6741.
[10]Balkwill F. Tumour necrosis factor and cancer[J]. Nat Rev Cancer,2009,9(5): 361-371.

