关于醋酸裂解制乙烯酮反应器
齐福来
(中国石化集团上海工程有限公司,上海 200120)
关于醋酸裂解制乙烯酮反应器
齐福来
(中国石化集团上海工程有限公司,上海 200120)
对于醋酸裂解制乙烯酮的生产作了大概的介绍,主要的目的是从生产实际的数据来研究该反应器,并找到合适的反应速度的各项常数,并由此预计不同规模的反应器大小。采用MATALAB语言进行模拟,计算的结果以图表示,非常直观。所建立的模型可以进行多方案的比较,简单易行。对研究该裂解管道反应器提供了基础。
乙烯酮;管式反应器;设计模型
1 前言
乙烯酮可参与乙酰化、环化……以及多聚反应,是医药,化工的基本原料之一。
它的合成方法主要由醋酸[1,2]或者丙酮[3]的热分解而成。但一般工业上均使用醋酸的裂解法制乙烯酮,除非是丙酮特别便宜时才会使用丙酮裂解法。对于烯酮类的反应和化学合成可以参考更专业的著作[4]。
醋酸在磷酸三乙酯的催化作用下,在不锈钢管内,在500-700℃的温度下,在低压300~500 mmHg的条件裂解制乙烯酮的反应如下:
主要反应:
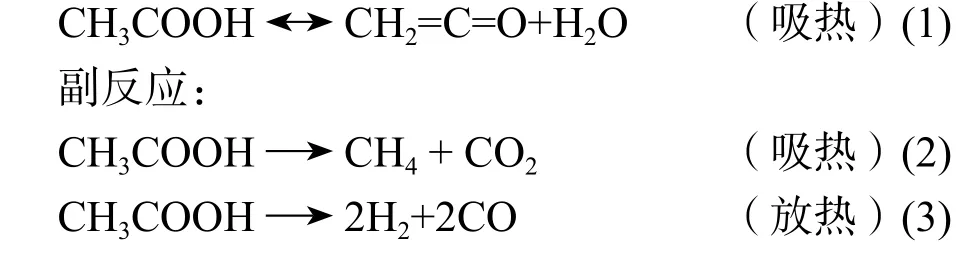

由以上反应(2~5)可知在醋酸裂解反应时会产生氢、甲烷、烯烃、一氧化碳以及二氧化碳等副产物,同时,由于反应(4)会在裂化管的表面产生结焦,因此,在生产中要定时的烧焦。
反应(1)是可逆反应,在反应管的出口处对反应的气相加入氨气,以中和催化剂防止乙烯酮和水再缩合成醋酸。出反应管后应急速冷凝冷却得到粗乙烯酮,粗乙烯酮含有水、醋酸、醋酐,还有7%vol的气体,主要为负反应产生的CO,CO2,乙烯,甲烷等。反应(6)就是醋酐生产的主要反应。
但乙烯酮是很活泼的化合物,很难保存和运输,所以,一般是将它再二聚成双乙烯酮。在生产上是采用冷的双乙烯酮在填料塔中逆流进行对乙烯酮的气体吸收。吸收后的混活液在较大的储罐内进行双聚反应,生成双乙烯酮。吸收并双聚成的粗双乙烯酮含有3~4%的醋酐,8~10%的高聚物,颜色为深咖啡色。要得到较纯的双乙烯酮可以进行蒸馏提纯得到99.5%纯度。更纯的双乙烯酮可以进行冷冻结晶[5]得到99.99%纯度。
在使用时必须将双乙烯酮分解为乙烯酮,分解过程是将双乙烯酮气体在管内加热到350~600oC进行分解。
在工业上一般采用管式加热炉来进行醋酸的裂解反应。加热的方式有两种,一为电加热方式,再就是燃料(气体或液体)加热。采用电加热方式,可采用卧式炉,用低电压高电流的短路加热方式,采用三相电流,三线的负荷应相等。电加热比较干净方便,但是,用电量较大。电加热有它的好处,那就是在整个反应管的表面具有相同的加热强度,也就是等热负荷的裂解状态。燃料加热的裂解炉可以为立式圆筒式,也可是卧式的方箱炉。
反应(1)为吸热反应,反应热为35Kcal/gmol[6],副反应(2)也为吸热反应,但是,其反应速度由于催化剂作用而很小,可以忽略不计。而其余的副反应(3~6)均为放热反应。
目前还未见到关于醋酸裂解制乙烯酮的反应速率方程式的报道。但是,早在1935年时就有Hinsha-elwood & Hutchison[7]发表了丙酮在硅或铜管内的热裂解属于均相一级化学反应,它的反应速度和温度的关系表示如下式:

式中:k—反应速度常数,单位,1/sec ;T-°k;
醋酸的裂解也应该是属于均相一级反应,但不同的应该是式(7)中的频率因子e34.34以及活化能68000Kcal/gmol这两个值。Frost & Pzzeareon[8]整理了大量的均相一级反应数据证明:对于单一分子的裂解反应,当满足过渡状态理论其活化熵等于零时的频率因子一般在1012~10151/sec 之间。而式(7)的频率因子在其范围。估计醋酸裂解的频率因子也应在该范围。而活化能的数据应该根据反应的起始温度来决定。如何决定这两个数据,在没有反应速率实验数据的情况下如何依据实际生产数据进行该反应的模拟,这将是本文的主要目的,在下文予以介绍。
2 由现有生产数据来模拟醋酸裂解反应:
2.1 现有生产数据


2.2 模拟该裂解管式反应器
(1)为了简化模拟该反应器提出如下的假定:
a)管内的反应物沿径向的温度为均一的;
b)管内的传热只考虑对流传热,不考虑辐射传热[9],也不考虑热损失;
c)管内的流动不考虑反混的影响,基本为PFR反应器;
d)只考虑醋酸的裂解反应,不考虑其它的负反应。
(2)由管壁传入的热量:
该反应是吸热反应,不管是电加热还是燃料加热,加载在反应管道上的热负荷设为Q Kcal/m2, h。假如不考虑热损失时,其应该全部传给管内的反应物为而由管壁传入的热量应为反应所需的热量加上反应气体的温升,如下式所示:

将该管式反应器分为n个管段微元,在其中第k个管段微元传入的热量,根据传热原理:

在没有达到反应温度时,加载的热负荷全部变为反应气体的温升。按照式(9)当αk小时,在相同面积S情况下,Q传入是恒定的,那末反应管道的壁温就必须升高。对于在环形管内的传热系数αk计算可采用下式[10]:

(3)第k管段微元的温升,对于反应混合物可由下式计算:

式(13)中的m是化学反应系数,Cp是反应物的定压比热,dHoTo是该反应To=298oC低压时的反应热(由下式计算)。在我们的计算中,反应混合物主要考虑三种物质:反应物醋酸、产物乙烯酮和水。其它负反应产物量很少,而且没有准确的反应数据,再加上大部分负反应均为放热反应,对于热量的计算没有影响,故而暂不予考虑。各组分的标准生成热如下表1[11]:

表1 各组分的标准生成热表 (Kcal/gmol)


表2 各组分的定压比热参数表

A为反应频率因子,E为反应的活化能,这两个数据就是我们要寻找的数据。dτk为反应物在该管段微元的停留时间,由下面式(27)计算。
(5)每管段微元的气体温升和压力降:
由上边的(1)~(4)步计算,得到传入的热量,反应的热量。在本步就应该计算反应混合物在每个管段微元的温升以及压降。
将式(9, 11, 12)代入式(8),就可求得反应物在第k管段微元的温度:

式中的TkW为第k管段微元的壁温。它可以按式(9)依照传入的热量以及传热系数计算而得如下式:

由式(18)求得TkG就可以按照这个温度来计算该管段微元的反应热dHk、以及反应量dCkA。并以这个温度作为该管段微元的定性温度,求得每个管段微元组分的物理性质(混合组分的气体密度、黏度、导热系数)。
混合组分的气体密度按下式计算:

2.3 计算框图
有了以上的计算思路建立如下的计算框图(见图 1)。
2.4 模拟该反应管道反应器应求得的数据
要进行模拟整个反应系统必须要求得以下的几个数据:

第(1)条的频率因子A的值和第(2)条的活化能数据E,必须在模拟现有生产数据后得到。

图1 计算框图
如何来判断这些数据的合理性呢?就是对不同的数据取值,进行整个反应管道的模拟计算,其结果要和实际生产的数据相符合为止。下面就是进行这样的过程。
首先,对反应活化能E和频率因子A的决定:
由于反应的频率因子A在前面已经介绍过,它基本在1012~1015之间,暂时采取与丙酮裂解的频率因子相同的值,按照图1的框图对在固定频率因子A条件,以不同的活化能和加热热负荷为参数,模拟计算每个条件所需要的反应管道的长度标绘在图2上。加热负荷从7000~12000 Kcal/m2·h;反应活化能选择从50000~66000 Kcal/gmol。
由图2看出只有在反应活化能在58000~60000 Kcal/gmol时以及加热负荷在Q=7000Kcal/m2·h,才能和实际的122.5m相符合。提高加热负荷所需要的反应管道长度将缩短。有了以上的模拟计算结果,再来研究频率因子A对所需反应管长的影响来决定它的值。在固定活化能E时频率因子A对反应管长的影响见图3。
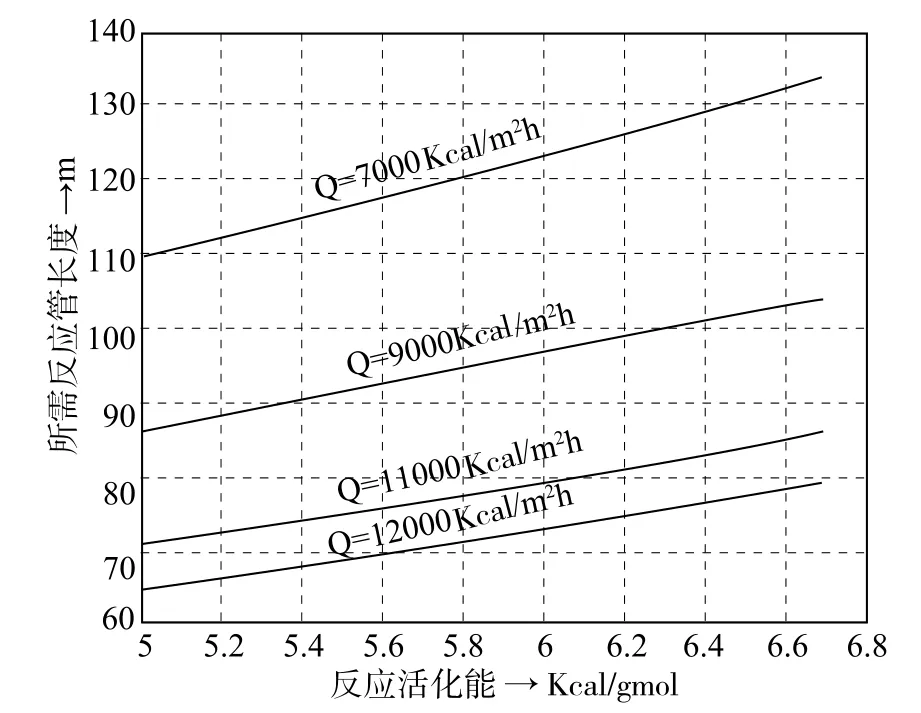
图2 所需反应管长与活化能及加热负荷的关系

图3 反应管长与频率因子的关系图
由图3看出在固定活化能E时,当加热负荷Q=7000Kcal/m2·h 时,频率因子 A=e34=5.83×1014时符合实际的生产数据。
我们知道反应的活化能E主要决定反应在何等能量下才能反应,所以,活化能的决定除了管长的要求以外还必须考虑反应的起始温度。反应的起始温度应该和活化能以及频率因子都有关,在前面的计算中已经知道反应起始温度和活化能的关系,将其列在表3。
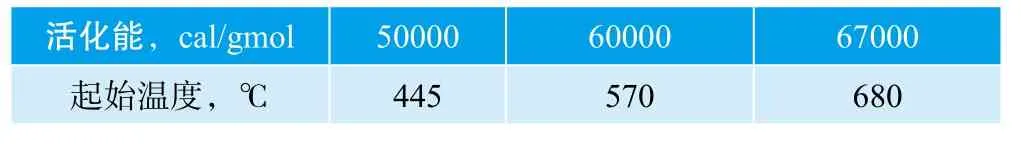
表3 反应活化能与起始温度的关系表
由表3得知只有当活化能E近60000Kcal/gmol时才能和前面文件[1]的数据500~700oC符合。
频率因子A的影响又将如何?建立了在固定加热负荷和活化能时反应的起始温度与频率因子的关系图4。
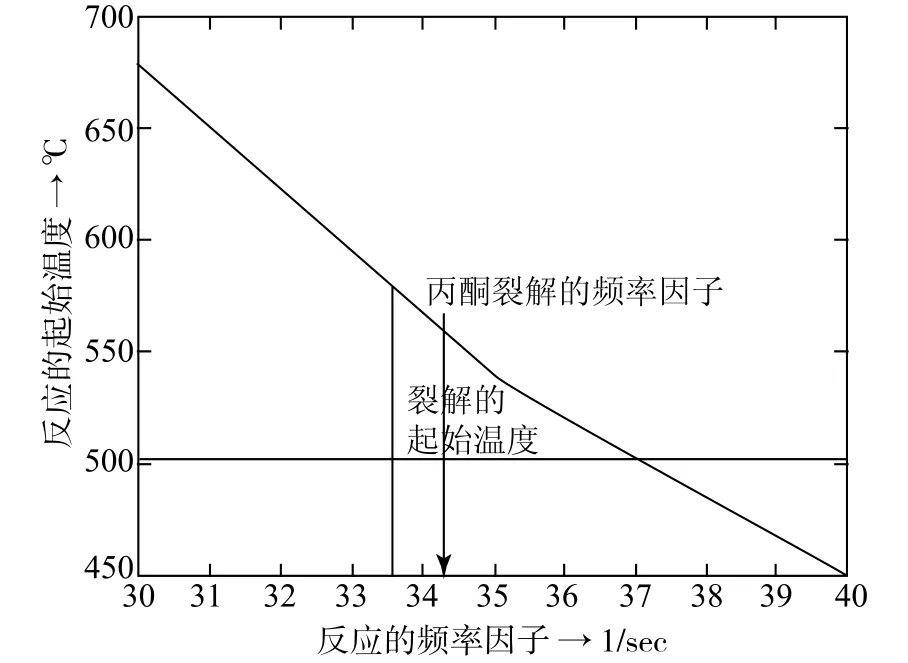
图4 频率因子A在固定加热负荷和活化能E时与反应起始温度
从图4可以看出:频率因子的选择范围很广,可以从e30~e36。而丙酮裂解的频率因子在其当中。
我们结合活化能在60000。Kcal/gmol时的起始温度为570oC,按此条件由图4上就可以找到合适的频率因子A值应为e34。
由以上的计算探讨,就可以从几个方面交叉限制地找到合适的醋酸裂解制乙烯酮反应的活化能E、频率因子A以及适当的加热热负荷值Q。
按决定的这些数据来模拟生产数据,计算的结果标绘如图5。
图5(a)为反应物在反应管内浓度的变化情况。图5(b)为管壁温度与反应物温度延管长的变化情况。图5(c)为反应物在管内的压力变化情况。
由图5(a)看出醋酸在40 m左右的管道处开始反应,同时参考图5(b)可知那时的反应物温度为620°左右。所需反应管的长度为122m,基本符合2.1(1)的条件。由图5(b)知道反应物的出口温度为710oC。基本符合2.1(3)的条件700~750oC。管壁的温度由280oC~800oC。图5(c)表示的反应物在管内的压力变化情况,进口500 mmHg出口为328 mmHg,压降为172 mmHg。基本符合2.1(4)的条件150~200 mmHg。计算得到的耗能为1.418 kW/

图5 模拟计算得到的各参数与反应管长的关系图
kg乙烯酮(理论值)。若考虑反应收得率降低(85%),热损失(10%),以及蒸馏损失(5%),计算的功耗为1.757 kW/kg双乙烯酮。基本符合2.1(6)的条件1.7~2.0度/kg双乙烯酮。有以上的分析来看我们建立的活化能E,频率因子A,以及加热负荷基本上符合生产数据,因而可以认为求得了醋酸裂解制乙烯酮的基本反应速度的常数数据。
3 对于未来规模的研讨
我们求得可用的数据以及建立计算方法的目的是为了对于将来扩建规模的生产设备予以估计。尽管我们在计算时采用了很多的假设以及决策,不是很精确,主要原因还是生产的实际数据比较单一,没有比较性。但毕竟可以为我们研究醋酸裂解制乙烯酮反应器提供了依据。
根据某规模的生产要求和条件如下:

对于这样的产量如何来选择加热负荷以及管径?按照本人建立的反应数据和模拟公式对不同管径以及加热负荷来计算其结果如下。
令加热负荷为12000 Kcal/m2·h时的反应管径与管长和压降的关系图表示在图6。
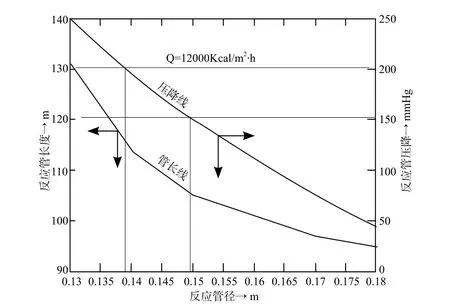
图6 反应管径与所需管径和压降的关系图
令加热负荷在15000Kcal/m2·h时,反应管长与压降的关系图标绘在图7上。
从图6和图7得到这样的结论:
加热负荷的增加在相同管压降(200mmHg)时,所需管长缩短,所需管径也变小。按照题目的要求管内径的选择应该为0.127~0.1357m之间,管长应在116~130m之间。加热负荷应为12000~15000Kcal/m2·h 之间。

图7 反应管径与管长和压降的关系图
假如选定管径为φ150×6的无缝不锈钢管道,加热负荷为15000/Kcal/m2·h,模拟该反应系统:
模拟计算的结果标绘在图8。
由图8可知:
出口反应物温度Tout=728oC;
出口壁温T=871oC;
反应管长为,L=112 m;
反应停留时间t=2.56 s;
管的出口压力P=379 mmHg;
压降dP=121mmHg;
由结果可知管道压降较低,因此,可以选小一点直径的管道。
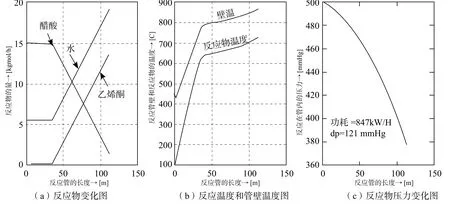
图8 按照要求模拟计算的结果
4 对于加热炉的考虑
上边已经介绍过对于该反应管道的加热方式有两种,一为电加热,另一为燃料加热。燃料加热可为液体燃料也可为气体燃料,这要根据具体情况决定。
(1)电加热方式的工艺计算比较简单,只要决定加热功率,其它的工作就由电工来决定了。不过在大功率时必须使用三相电流,在整个反应管道应保持施加功率相同,并且三相的负载功率应相同。为达此目的,整个反应管道分三段,电源的接法可为星形也可为三角形。
(2)燃料加热炉
在计算加热炉时,对于辐射室一般多采用Lobo-Evance[12]方法,或者 Велоконъ[13]方法。这两种方法都是假定在辐射室内为全混型模型,也成为零为模型。因而没有考虑反应管道在辐射室内的位置,只考虑对于管道的平均热负荷。所以,我们前面计算只考虑加热热负荷的模型仍可应用。对于加热炉的热力计算的介绍将花费更多的篇幅,就不在此累述。对于上边的条件仅将采用Lobo-Evance方法计算的结果呈现如下:

5 说明
(1)首先,用作反应数据决策的这一个生产实例,它的数据的准确性没有去进一步考核,也没有对不同规模的生产数据进行整合,因此,具有片面性和偶然性。
(2)在该反应中采用了磷酸三乙酯作为催化剂,该催化剂的作用方式不祥,该催化剂的用量以及加入方式都会对反应有所影响,因此,求得的以上这些数据仅为参考数据。本文的方法仅为研究该反应器的一种方法,作为介绍而已。
符号说明:


[1] Ger. Pat. 687, 065 (Dec. 28, 1939)J. Sixt and M. Mygdan
[2] Ger. Pat. 734, 439 (1934)
[3] C. N. Hinshelwood, and W. K. Hutchison“ Proc. Roy. Soc. ”A134,340 (1935)
[4] Thomas T. Tidwell “Ketenes”, JONN WILEY & SONS, INC. (1995)
[5] AG CH 423, 754 Lonza 1967
[6] W. Hunter BIOS Field Report 1050 Feb 1, 1949 或者 PB68, 123 US Dept. of Commerce Washigton D. C.
[7] C. N. Hinshaelwood & W. K. Hutchison ‘Proc. Roy. Soc. ’, A149,340, (1935)
[8]A. Frost & R. G. Peareon, ’Kinetics and Mrchanism’ 2nd. Ed. JOHN WILEY & SONS. INC. (1961)
[9] T. Hoble Traslate by А. В. Плисса” ТЕПЛОПЕРЕДАЧА и ТЕПЛООБМЕННИКИ”, ЛЕНИНГРАД, 1961
[10] D. Q. Kern ‘Process Heat Transfer’, (1951)
[11] R. C. Reid, J. M. Prausnitz & T. K. Sherwood, ‘The Properties of Gases and Liquids’, McGraw-Hill Book Company, Third Ed. (1977)
[12] W. E. Lobo and J. E. Evance “Heat Transfer in the Radiant Section of Petroleum Heaters”, “Trans. A. I. Ch. E. ’, (35)743, (1939)
[13] Η. И. Велоконъ. “Аналитические основы теплового расчёта трубчатых печей”, ’Hефтяная Промышленность’, CCCP. NO. 2.104-112. (1941)
Concerning the Reactor of Pyrolyzing Acetic Acide to Ketene
Qi Fulai
( SINOPEC Shanghai Engineering Co., Ltd Shanghai, 200120 )
First Introducing the production process of pyrolyzing acetic acid to ketene briefly. Uppermost objective in this article is search the constants of reaction velosity in this tube-reactor and than predicting the another larg-scale tube-reactor. Modeling the reactor by MATLAB language and showing the calculation results as picture. It is very intuitionistic. Established model of this tube-reactor can be used to compare more condition of this reaction and it is facility. Providing the foundation to research this tube-reactor.
Ketene; Tube-reactor; Design model
TQ018
A
1008-455X(2010)-06-0005-07
2010-08-02
齐福来(1939-)男,高级工程师,主要从事化学工程设计、化工工艺研究开发。
Tel:021-62805356 E-mail:flych@online. sh. cn

