降钙素受体在骨转移瘤中的表达水平及意义
韩 枫
(河南省商丘市第一人民医院骨科,河南商丘 476100)
骨转移瘤已经成为成年人中发病率最高的骨恶性肿瘤[1],骨转移瘤原发疾病多为乳腺癌、前列腺癌及肺癌等,随病情进展常会引起病理性骨折、顽固性疼痛、高钙血症及神经压迫等并发症,严重降低了患者的生活质量。本文探讨降钙素受体(calcitonin receptor,CTR)在骨转移瘤中的表达情况,并探讨其相关性及表达意义,期望能为临床应用降钙素(calcitonin,CT)治疗骨转移瘤提供理论基础和依据,现报道如下:
1 资料与方法
1.1 一般资料
选取2008年1月~2010年12月在我科确诊后行手术切除的骨转移瘤标本18例,同时搜集完整资料(包括患者的基本情况、实验室检查、影像学资料和病理诊断)。18例患者,其中,男性8例,女性10例;年龄35~73岁,平均57岁。肿瘤转移部位,脊柱11例(颈椎1例,胸椎5例,腰椎4例,骶椎1例),骨盆4例,股骨近端2例,股骨远端1例。根据X线表现将18例标本分为两组:成骨表现组4例,溶骨表现组14例。所有患者术后经病理确诊均为骨转移瘤,其中,12例发现原发病灶(肺癌4例,乳腺癌3例,肾癌2例,甲状腺癌1例,前列腺癌1例,胃癌1例),6例经全身检查未发现原发灶。同时选取我科在脊柱手术中切除的多余的正常棘突10例,设为对照组,其中,男性6例,女性4例;年龄35~65岁,平均50岁。取棘突部位:颈椎3例,胸椎3例,腰椎4例。
1.2 实验仪器及试剂
电热恒温干燥箱(上海跃进医疗仪器厂),超低温冰箱(青岛海尔集团公司),倒置相差显微镜(日本Olympus公司),GT16-3A离心机(北京时代北利离心机有限公司),切片机(德国Leitz公司),降钙素受体鼠抗人单克隆抗体(美国Santa Cruz公司),S-P免疫组化染色试剂盒(北京中山金桥生物技术有限公司),PBS缓冲液,抗原修复液。
1.3 方法
1.3.1 取材包埋 切除的标本均置于10%福尔马林溶液中固定15~20 h,然后放入5%硝酸银溶液中脱钙 48~72 h,此时用普通注射器针头即可刺透骨质,然后在自来水下连续冲洗72 h。梯度酒精脱水,二甲苯透明,石蜡包埋,65℃浸蜡,制成蜡块后放入-4℃冰箱中。
1.3.2 连续切片 切片机以4 μm厚度对蜡块连续切片,贴于载玻片上,捞片后置60℃烤箱30~60 min,烤干备用。
1.3.3 HE染色 常规二甲苯脱蜡,酒精脱水,苏木素染色,水洗,分化,反蓝,伊红染色,脱水,二甲苯透明后封片。
1.3.4 免疫组织化学操作 按免疫组织化学常规SP染色方法与免疫组织化学试剂盒说明操作。
1.3.5 对照组设定 PBS液代替一抗为阴性对照。以10例已知CTR阳性表达的正常骨组织作为阳性对照组。
1.3.6 结果判定标准及方法 所取标本免疫组织化学染色结果的判断参照许良中等[2]提出的等级评分方法为标准,切片中细胞核和胞浆内出现棕黄色颗粒为阳性,无棕黄色颗粒者为阴性。
1.3.7 统计学分析 采用阳性率作为统计数据,应用SPSS 13.0软件包进行统计学分析,所得结果用χ2检验或精确概率法进行检验,检验水准α=0.05。
2 结果
免疫组织化学染色结果显示CTR表达于正常骨组织和骨转移瘤细胞浆中。CTR在正常骨组织中表达的阳性率为30.0%,在骨转移瘤中表达的阳性率为83.0%,二者有显著性差异(表1)。CTR在骨转移瘤分组中的表达:溶骨组的阳性率为92.8%,成骨组的阳性率为50.0%,二者有显著性差异(表2)。

表1 降钙素受体在正常骨组织和骨转移瘤中的表达(例)Tab.1 The expression of CTR in normal bone tissue and bone metastases(case)
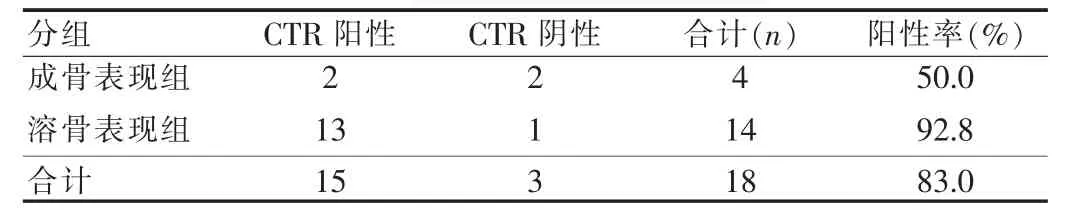
表2 降钙素受体在成骨组和溶骨组中的表达(例)Tab.2 The expression of CTR in osteogenic group and osteolytic group (case)
3 讨论
CT是一种包含有32个氨基酸的多肽类激素,在体内主要由甲状腺C细胞合成、分泌,其在体内存在于多种组织中。CT的生理作用广泛,可以调控受精卵着床与胚胎发育,还可以促进肾脏对 Ca2+的排泄,抑制破骨细胞(osteoclast,OC)的溶骨作用,维持Ca2+的平衡。自1962年Copp等[3]首次报道CT后,人们发现到CT对骨吸收有明显的抑制作用,并由此推测骨组织中可能存在CTR。1980年Warshasky等[4]利用电镜放射自显影的方法首次报道OC表面存在CTR。1986年Nicholson等[5]在体外培养OC时,采用放射配基结合分析证实了在OC及前体细胞上存在大量的CT特异性结合位点。1991年Lin等[6]首次成功克隆出猪的CTR cDNA,它翻译的蛋白包括482个氨基酸,分子量为55 kD。人与猪CTR结构相似,包含490个氨基酸,分子量8~9 kD,拥有7个跨膜结构及连接跨膜结构的4个胞外功能区(e1~4)和4个胞内功能区(i1~4),目前已证明N-端的e2功能区是CT的结合位点。种种研究证实了OC和前体细胞表面存在大量的CTR,CT和CTR结合后,能抑制OC的骨吸收作用,促进成骨,增加骨量。CTR是包含490个氨基酸并拥有7个跨膜结构G蛋白耦联受体。
近年来随着研究的不断深入,发现CTR在体内多种组织中广泛存在。1980年Martin等[7]在克隆的人乳腺癌细胞系(MCF-7)中发现CTR表达。1987年Silvestronil等[8]在人精原细胞上发现CTR表达。1997年Gellisple等[9]在原发性乳腺癌中发现CTR表达,同时还发现这些表达CTR的癌组织表达骨桥蛋白。2005年张艳萍等免疫组化检测不同发育阶段小鼠胚胎和植入期子宫内膜,发现CTR在小鼠胚胎和植入期子宫内膜都有表达。2008年张豪伟等[10]发现骨巨细胞瘤和骨软骨瘤中也有CTR表达。以上研究表明CTR可以在乳腺癌、前列腺癌、肺癌等恶性肿瘤中表达,而在乳腺、前列腺、肺等正常组织中则无表达,说明CTR可能与CTR阳性的恶性肿瘤骨转移有关。目前已证明CTR在骨组织主要存在于OC膜上,CT和OC膜上的CTR结合后,通过一系列的信号转导机制,抑制OC的骨吸收作用。目前对于CT和CTR结合后在OC中的信号转导机制已明确:一种信号转导途径以Ca2+为第二信使,CT和CTR结合后激活Gp,Gp再激活磷脂酶C(PLC),激活状态的PLC将细胞膜中的磷脂酰肌醇-4,5-二磷酸(PIP2)水解为 IP3和二酰基甘油(DG),IP3和胞膜内的IP3受体结合,促进胞内Ca2+的释放,提高胞内Ca2+水平,DG可以激活胞膜上的蛋白激酶C(PLC),相关的蛋白发生磷酸化,增加Ca2+的通透性,使胞内Ca2+浓度升高,产生相应的生物学效应;另一种是以cAMP为第二信使的信号转导途径,其转导机制为:CT和CTR结合后激活霍乱敏感蛋白(Gs),进而激活腺苷酸环化酶,在Mg2+存在的条件下催化ATP生成cAMP,以cAMP为第二信使激活蛋白激酶A,启动级联反应,产生最终生物学效应。CT和CTR结合后在肿瘤细胞中的转导机制尚不清楚,需进一步研究。本研究通过对18例骨转移瘤标本免疫组化检测发现:CTR阳性表达15例,CTR阴性表达3例,CTR阳性率为83.0%;而对照组10例正常骨组织中,CTR阳性表达3例,CTR阴性表达7例,CTR阳性率为30.0%,经Fisher精确概率检验发现二者阳性率有显著性差异。本研究中发现CTR在骨转移瘤中高度表达,而在正常骨组织中低表达,说明骨转移瘤的形成可能与其细胞表面的CTR有关,CTR在骨转移瘤中高表达,可能是骨转移瘤的一种新标志物。正常骨组织中CTR存在于OC上,骨转移瘤中CTR可能存在于肿瘤细胞上,对骨转移瘤中CTR进行检测,将有助于骨转移瘤的早期诊断和预后评估。骨转移瘤的转移途径主要为血液循环途径,少数经淋巴循环系统,由于多数恶性肿瘤细胞表面表达CTR,为下一步应用CT治疗恶性肿瘤提供了可能,但是CT和肿瘤细胞表面CTR的结合机制以及结合后的生物学效应尚不清楚。
骨肿瘤根据X线表现可以分为成骨型、溶骨型和混合型。骨转移瘤在X线表现上成骨型和混合型少见,多为溶骨型表现。前列腺癌、肺癌、胃癌和近半数的乳腺癌的骨转移瘤X线表现为成骨型,而肾癌、甲状腺癌、肺癌、结肠癌的X线表现多为溶骨性破坏。目前认为骨转移瘤的溶骨作用与OC的骨吸收有关,OC的溶骨活性可被肿瘤细胞释放的调节因子增强,从而加速骨的分解代谢,同时还可以抑制转移灶的成骨作用,最终产生溶骨性病灶。其中较为重要的调节因子有甲状腺素相关蛋白[11]与细胞核因子κB受体活化因子配基(RNAKL)。有文献报道RNAKL在多种肿瘤细胞中大量表达,能导致OC活化和大量骨质溶解破坏[12]。而某些骨转移瘤表现为成骨性改变,这可能是由于转移灶释放的成骨因子促进成骨细胞的增殖和分化所致。研究发现由前列腺癌细胞产生的TGF-β是一种活性较强的成骨因子,能提高前列腺癌骨转移灶中成骨细胞的活性,因此前列腺癌骨转移中成骨型比较常见。同时前列腺癌细胞还能分泌成纤维细胞生长因子(FGF),它能刺激成骨细胞的增殖和成骨活性。CTR在溶骨型骨转移瘤中高表达,CTR可能与上述细胞因子相互作用共同调节骨转移瘤的溶骨性或成骨性破坏有关。本研究18例患者,根据X线表现分为两组:成骨表现组4例,CTR 阳性表达 2例(50.0%);溶骨表现组 14例,CTR 阳性表达13例(92.8%),经Fisher精确概率检验发现二者阳性率有显著性差异。研究结果表明溶骨型骨转移瘤中CTR表达水平高于成骨型,CTR的表达水平与转移瘤的溶骨性破坏有关。CTR高表达的骨转移瘤溶骨破坏比较明显,而CTR低表达的骨转移瘤成骨作用比较明显。当然,在骨转移瘤溶骨和成骨过程中还有其他细胞因子的参与,同时与原发肿瘤的性质有关。因此,CTR并不是调节骨转移瘤溶骨的唯一因素,可能有其他因素相互作用共同调节骨转移瘤的溶骨作用。
本研究证实了CTR在骨转移瘤中的表达水平高于正常骨组织,而且在溶骨型骨转移瘤中的表达水平高于成骨型骨转移瘤,为临床进一步应用CT诊断、治疗骨转移瘤溶骨性破坏提供了相关的理论基础及思路。
[1]Unni KK.Dahlin′s bone tumors∶general aspects and data on 11087 cases[M].5th ed.Philadelphia∶Lippincott-Raven,1996∶369-375.
[2]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4)∶229-231.
[3]Copp A,Sexon PM,Pondel M.Calcitonin and its physiological role in human[J].Science,1962,81(6)∶405-419.
[4]Warshasky H,Golizman D,Rouleau MF,et al.Direct in vivo demonstration by radioautography of specific binding sites for calcitonin in skeletal and renal tissue of the rat[J].J Cell Biol,1980,85(3)∶682-694.
[5]Nicholson GC,Mosciey JM,Sexton PM,et al.Abundant calcitonin receptor in isolated rat osteoclasts∶biochemical and autoradiographic characterization[J].Clin Invest,1986,78∶355.
[6]Lin HY,Harris TL,Flanery MS,et al.Expression cloning and characterization of a porcine renal calcitonin receptor[J].Science,1991,254∶1022-1024.
[7]Martin TJ,Findlay DM,Maclntyre L,et al.Calcitonin receptors in a cloned human breast cancer line (MCF-7)[J].Biochem Biophys Res Commun,1980,96(1)∶150-156.
[8]Silvestroni L,Menditto A,Frajese G,et al.Identification of calcitonin receptors in human spermatozoa[J].Clin Endocrin Metab,1987,65(4)∶742-746.
[9]Gellisple MT,Thomas RJ,Pu ZY,et al.Calcitonin receptors bone sialoprotein and osteopontin are expressed in primary breast cancer[J].Int J Cancer,1997,73∶812-815.
[10]张豪伟,王卫东,赵亮,等.降钙素受体在骨巨细胞瘤中的表达及与Jaffe分级的关系[J].中国实用医刊,2008,35(11)∶7-8.
[11]Powell GJ,Southby J,Danks JA,et al.Localization of parathyroid hormone-related protein in breast cancer metastasis∶Increased incidence in bone compared with other sites[J].Cancer Res,1991,51∶3059-3061.
[12]Zawa S,Kitazawa R.RANK ligand is a prerequisite for cancer-associated osteolytic lesions[J].Pathol,2002,198∶228-236.

