红芪多糖对实验性大鼠糖尿病胰岛素抵抗瘦素的影响1)
金智生,汝亚琴,李娟娥,高 妍,周 强,楚惠媛,师 霞
胰岛素抵抗(insulin resistance,IR)是心血管疾病、血脂代谢紊乱、2型糖尿病等多种疾病的共同发病机制,是这些疾病最重要的危险因素。近年来研究表明,瘦素等脂肪因子在2型糖尿病及并发症的发病机制中的作用备受关注,其可能影响体内多种能量代谢,在IR中起着重要的作用[1]。我们以往研究表明,红芪多糖(HPS)及其复合物能改善糖尿病模型大鼠血脂、血糖等指标[2]。但对糖尿病胰岛素抵抗大鼠模型血脂和瘦素的关系及HPS对其的干预作用尚未见文献报道。本研究将观察HPS对糖尿病胰岛素抵抗大鼠血脂、血清瘦素和脂肪瘦素的影响,探讨HPS对糖尿病及并发症治疗作用和可能机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 Wistar大鼠 60只,体重(200±20)g,雌雄各半。由甘肃中医学院SPF级动物实验中心提供。合格证号:0001510。
1.1.2 药物与试剂 HPS:精选甘肃宕昌县产红芪,由我院药学系进行药物鉴定并根据有关工艺提取;盐酸二甲双胍肠溶片:贵州天安药业股份有限公司,批号:20041222;链脲佐菌素(Streptozotocin,STZ):美国Sigma公司 ,批号 :015K 1279;碘[125I]-胰岛素(INS)放射免疫分析药盒[125I-Insulin Radioimmunoassay Kit],北京科美东雅生物技术有限公司,批号:050625;总胆固醇(TC)测定试剂盒,浙江东瓯生物工程有限公司,批号:2005010157;三酰甘油(TG)测定试剂盒,浙江东瓯生物工程有限公司,批号:2005050024;碘[125I]-消脂素(Leptin)放射免疫分析药盒,北京科美东雅生物技术有限公司,批号:050725。
1.2 实验方法
1.2.1 造模方法 大鼠在适应喂养1周后,造模大鼠均喂以高糖高脂饲料[3](其中含10.0%猪油,20.0%蔗糖,2.5%胆固醇,1.0%胆酸盐,66.5%常规饲料)1个月,以使其诱发胰岛素抵抗。第6周按文献[4]造模以低剂量(25 mg/kg)STZ(溶于0.1 mmol/L柠檬酸缓冲液,pH4.4,配制成浓度为1%的溶液),一次性左侧下腹部注射,诱发胰岛素代偿性分泌障碍,使之产生高血糖症。高糖、高脂饮食继续喂养,大鼠出现高胰岛素血症和胰岛素抵抗。第9周,大鼠禁食12 h后,按 2 g/kg体重灌胃20%D-葡萄糖溶液,做口服糖耐量试验,凡0 min和120 min血糖分别≥7.8 mmol/L或葡萄糖负荷后2 h血糖≥11.0 mmol/L的大鼠为造模成功[5]。
1.2.2 分组及给药 除正常对照组(A组)外,将造模成功大鼠称重编号以随机数字表法分为模型对照组(B组)、二甲双胍治疗组(C组)、HPS低剂量治疗组(D组)和 HPS高剂量治疗组(E组)。A组、B组灌胃等体积的生理盐水,每日1次;C组每日灌胃二甲双胍70 mg/kg;D组灌胃HPS 50 mg/kg,E组每日灌胃HPS 150 mg/kg,均每日1次。A组动物给正常饲料,其余各组均继续喂以高脂饲料4周,并每周称体重。
1.2.3 标本采集 第13周,末次给药后禁食12 h,腹腔注射2%戊巴比妥钠生理盐水溶液40 mg/kg麻醉,行股动脉取血加入装有40 000 U/mL抑肽酶20 μ L的冰冷试管中混匀,以3 500 r/min离心10 min,分离血清,于-25℃冰箱内保存以检测有关指标。处死动物,分离肾周围脂肪组织,称重后制成10%匀浆,以3 500 r/min离心10 min,取上清液测定瘦素。
1.3 检测指标及方法 空腹血糖(FPG)测定:在大鼠麻醉取血前取尾静脉血一滴,用血糖仪和试纸条测定;血清、脂肪组织瘦素、空腹胰岛素(FINS):按放免分析试剂盒说明书测定;计算胰岛素敏感性指数(ISI):ISI为FPG与INS乘积的倒数,即ISI=ln(1/FINS×FPG)[6];血脂测定:TC用CHOD-PAP法测定,TG用GPO-PAP法测定,HDL-C用磷钨酸钠-镁沉淀法(PTAMg2+法)测定。
1.4 统计学处理 采用SPSS 13.0统计软件处理。计量资料均用均数±标准差(±s)表示。组间比较采用单因素方差分析,P<0.05为有统计学意义。
2 结 果
2.1 HPS对糖尿病胰岛素抵抗大鼠血糖的影响(见表1) 治疗组血糖均下降,与模型组相比均有统计学意义(P<0.01)。二甲双胍组血糖下降最为明显,与空白组相比无统计学意义(P>0.05);HPS高、低剂量组血糖与二甲双胍组相比有统计学意义(P<0.01),HPS高剂量组与低剂量组血糖相比有统计学意义(P<0.05),表明HPS降糖效果较二甲双胍差,但有一定的降糖作用,HPS高剂量组降糖作用强于低剂量组。
表1 各组治疗前后大鼠FPG比较(±s) mmol/L

表1 各组治疗前后大鼠FPG比较(±s) mmol/L
组别 鼠数 剂量(mg/kg) 治疗前 治疗后空白组 8 生理盐水 2.462±0.888 2.212±0.677模型组 8 生理盐水 17.750±2.4801) 18.587±1.9971)二甲双胍组 8 70 18.162±2.2311) 4.412±3.0492)HPS低剂量组 8 50 17.862±2.7721) 14.612±4.0321)2)3)HPS高剂量组 8 150 17.812±3.2521) 10.812±3.1261)2)3)4)与空白组比较,1)P<0.01;与模型组比较,2)P<0.01;与二甲双胍组比较,3)P<0.01;与HPS低剂量组比较,4)P<0.05
2.2 HPS对糖尿病胰岛素抵抗大鼠血脂的影响(见表2) 模型组TC、TG升高,HDL-C降低,与空白组相比较有统计学意义(P<0.01),提示模型组存在脂代谢紊乱。用药后各治疗组HDL-C升高,TC、TG下降,与模型组比较均有统计学意义(P<0.05或P<0.01);HPS低剂量组与二甲双胍组相比有统计学意义(P<0.05或P<0.01),HPS高剂量组与二甲双胍组比较无统计学意义(P>0.05),HPS高剂量组与低剂量组相比差异有统计学意义(P<0.05),说明中药高剂量对大鼠HDL-C、TC、TG的治疗有和西药相似的作用,而中药低剂量的作用较差。
表2 各组大鼠间血脂的比较(±s) mmol/L
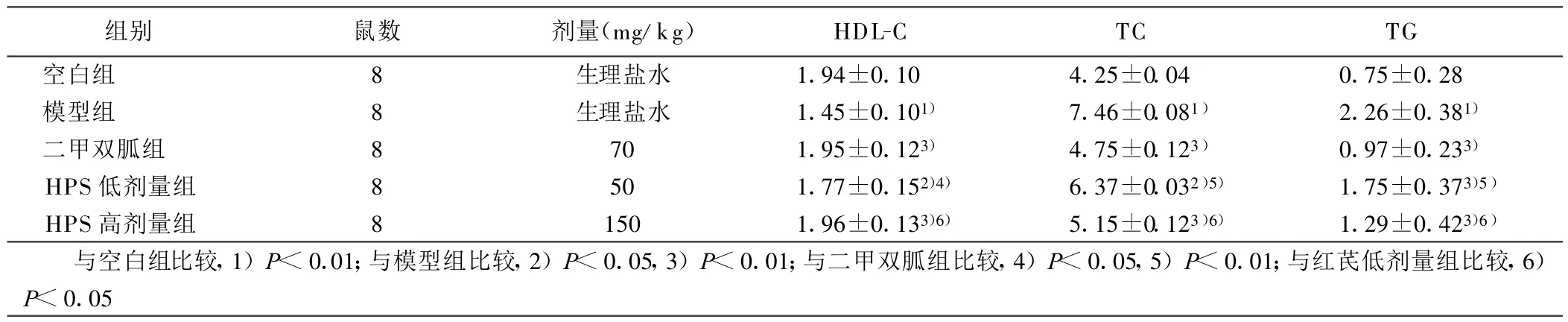
表2 各组大鼠间血脂的比较(±s) mmol/L
组别 鼠数 剂量(mg/kg) HDL-C TC TG空白组 8 生理盐水 1.94±0.10 4.25±0.04 0.75±0.28模型组 8 生理盐水 1.45±0.101) 7.46±0.081) 2.26±0.381)二甲双胍组 8 70 1.95±0.123) 4.75±0.123) 0.97±0.233)HPS低剂量组 8 50 1.77±0.152)4) 6.37±0.032)5) 1.75±0.373)5)HPS高剂量组 8 150 1.96±0.133)6) 5.15±0.123)6) 1.29±0.423)6)与空白组比较,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01;与二甲双胍组比较,4)P<0.05,5)P<0.01;与红芪低剂量组比较,6)P<0.05
2.3 HPS对糖尿病胰岛素抵抗大鼠血清INS、ISI的影响(见表3) 与空白组相比,模型组大鼠血清INS升高,ISI降低(P<0.01)。各治疗组与模型组相比,胰岛素抵抗大鼠血清INS降低,ISI升高(P<0.05或P<0.01)。HPS高、低剂量组与二甲双胍组比较无统计学意义(P>0.05),说明对于改善大鼠高血清胰岛素血症及改善胰岛素敏感性方面HPS治疗组与西药有相似的治疗效果。
表3 各组大鼠间INS、ISI的比较(±s)

表3 各组大鼠间INS、ISI的比较(±s)
组别 鼠数 剂量mg/kg INS pmol/L ISI U/mL空白组 8 生理盐水 73.0±11.1 -3.967±0.199模型组 8 生理盐水 129.1±20.71) -4.892±0.3311)二甲双胍组 8 70 87.0±15.82) -4.156±0.2382)HPS低剂量组 8 50 102.7±15.23) -4.551±0.1913)HPS高剂量组 8 150 96.1±12.43) -4.241±0.4443)与空白组比较,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01
2.4 HPS对糖尿病胰岛素抵抗大鼠血清、脂肪瘦素的影响模型组中血清、脂肪瘦素水平升高,与空白组相比有统计学意义(P<0.01)。与模型组相比,各治疗组瘦素水平降低(P<0.01)。与二甲双胍组相比,HPS高剂量组治疗作用相当,而HPS低剂量治疗作用弱于二甲双胍(P<0.01)。说明HPS上述作用呈明显量效关系。详见表4。
表4 HPS对糖尿病IR模型大鼠血清、脂肪瘦素的影响(±s) ng/mL

表4 HPS对糖尿病IR模型大鼠血清、脂肪瘦素的影响(±s) ng/mL
组别 鼠数 剂量mg/kg 血清瘦素 脂肪瘦素空白组 8 生理盐水 5.1±1.1 7.2±1.92模型组 8 生理盐水 14.8±2.61) 15.5±2.71)二甲双胍组 8 70 6.4±1.42) 8.4±1.42)HPS低剂量组 8 50 10.5±2.52)3) 11.4±1.22)3)HPS高剂量组 8 150 7.1±1.412)4) 8.9±1.52)4)与空白组比较,1)P<0.01;与模型组比较,2)P<0.01;与二甲双胍组比较,3)P<0.01;与HPS低剂量组比较,4)P<0.01
3 讨 论
红芪为豆科植物多序岩黄芪(Hedysaryum Polbotrys)的干燥根,以甘肃产多序岩黄芪为红芪的主要品种,药源充足,价格低廉,质量为最佳。最早记载于《神农本草经》黄芪项下,列为上品。红芪的应用已有较长的历史。陶弘景曰:“有赤色者,可作膏贴,用消痈肿,俗方多用,道家不须”。《神农本草经》记载:“补丈夫虚损,五劳赢瘦、止渴、腹痛泻痢,益气,利阴气”,历代医家均用之治“消渴”。
2型糖尿病中普遍存在胰岛素抵抗,而且在多数情况下胰岛素抵抗可能是2型糖尿病的原发性起病原因。脂质代谢紊乱对细胞具有毒性作用,即所谓“脂毒性”,脂质代谢紊乱与IR具有共同的生物学基础[7]。高脂血症是IR的病理生理基础,不仅会加重高血糖还可以引起糖尿病一系列并发症[8]。而IR可使肝脏合成和分泌极低密度脂蛋白(VLDL)和TG的量增加并使其清除减少,产生高脂血症,IR与高脂血症二者互为因果,形成恶性循环。本实验选用小剂量链脲佐菌素加高脂饲料成功诱发的糖尿病胰岛素抵抗大鼠模型[9]。通过检测模型大鼠血糖、血脂、胰岛素、胰岛素敏感性等相关指标,结果表明糖尿病合并胰岛素抵抗模型成功。该模型具有高血糖、血脂异常、高胰岛素血症和胰岛素敏感性下降等,与2型糖尿病IR的特征相似。
瘦素是由脂肪细胞分泌的一种肽类激素,也是第一个被发现的脂肪因子,具有多种生物活性,能够调节脂肪组织和其他组织的功能,尤其在调节胰岛素敏感性方面的作用更为突出[10]。作为由脂肪组织产生并作用于下丘脑调节摄食和能量代谢的瘦素,其分泌量由脂肪组织量决定,脂肪增加则合成瘦素也增加,反馈至下丘脑抑制摄食、增强能量代谢,反之则刺激摄食、降低代谢[11]。瘦素还能抑制胰岛素的分泌,调节胰岛素在靶组织的敏感性,而胰岛素亦能促进瘦素的表达。临床研究结果显示,2型糖尿病患者存在糖代谢紊乱、脂代谢异常,且胰岛素敏感性下降,瘦素水平增高[12]。上述代谢紊乱变化可能是瘦素通过下述机制引起胰岛素抵抗:其一,体内可能存在“瘦素-脂肪-胰岛素”轴[13],瘦素在脂肪细胞和胰岛素之间起负反馈的信号传递作用。在病理状态下正常的“瘦素-脂肪-胰岛素”轴反馈机制受到破坏,瘦素敏感性下降,产生“瘦素抵抗”,瘦素不能有效抑制胰岛B细胞胰岛素的分泌,导致高胰岛素血症、胰岛素抵抗及B细胞的凋亡。其二,瘦素抵抗使机体减弱对摄食与脂肪代谢的调控。摄食增加、脂肪氧化分解降低可造成高脂血症,高脂血症又在外周器官影响胰岛素的功能,促进IR。同时过多的脂肪分泌更多的瘦素,使瘦素抵抗加剧[14]。
本实验表明:HPS降糖作用明确,其降糖作用机制可能是在促进组织器官对葡萄糖利用的同时也促进了胰岛素分泌。HPS高剂量对大鼠 HDL-C、TC、TG的调节作用,其机制可能是促进胰岛B细胞的修复,增加胰岛素的敏感性,增加组织对葡萄糖的利用,减轻IR;调节脂质的分解,减轻其对胰岛素分泌的抑制;使合成 TG、TC及VLDL的原料减少,促进VLDL和CM 分解,增加载脂蛋白(Apo),使合成 HDL的原料增加;提高脂蛋白脂酶活性,使富含TG的脂蛋白清除加快,从而产生了降低TC、TG,升高 HDL-C,减轻IR效果。HPS能够降低血清胰岛素,升高胰岛素敏感指数,改善大鼠胰岛素抵抗,可能是通过修复受损的胰岛B细胞,增加其数量和质量,恢复胰岛B细胞功能,改善INS的利用,降低血糖,同时在调节脂代谢紊乱的基础上,提高了胰岛素的敏感性,改善了糖尿病IR。
本实验结果显示:HPS可降低胰岛素抵抗大鼠血清、脂肪中瘦素,红芪高剂量组优于红芪低剂量组。考虑其可能通过以下几个途径实现:通过“瘦素-脂肪-胰岛素”轴,通过其调脂作用,调节脂质分解,脂肪减少,血脂下降,则瘦素水平下降;减轻脂毒性对胰岛素受体的破坏,增加胰岛素敏感性,血清胰岛素水平下降,则瘦素水平下降;HPS可能改善了神经内分泌系统,加强瘦素的利用,减轻瘦素抵抗,使瘦素水平下降。但HPS降低瘦素的深层机制有待进一步研究。
综上所述,HPS对实验性大鼠糖尿病胰岛素抵抗模型的影响是多方面的,但不管是降低血糖、调节血脂,还是降低血清、脂肪瘦素等相关指标,均最终通过改善胰岛素抵抗达到减轻病情,阻止或延缓相关并发症出现的目的。
[1]陈芳建,胡朝晖,胡雅国,等.2型糖尿病患者脂联素、瘦素及其比值与血脂、胰岛素抵抗的相关性[J].浙江检验医学,2008,6(4):28-29.
[2]金智生,汝亚琴,李应东,等.红芪多糖对不同病程糖尿病大鼠血脂的影响[J].中西医结合心脑血管病杂志,2004,2(5):278-280.
[3]郭啸华,刘志红,李恒,等.高糖高脂饮食诱导的2型糖尿病大鼠模型及其肾病特点[J].中国糖尿病杂志,2002,10(5):290-294.
[4]郭洁文,潘竞镪,邱光清,等.荔枝核增强2型糖尿病胰岛素抵抗大鼠胰岛素敏感性作用[J].中国新药杂志,2003,12(7):527.
[5]赵宝珍,白秀平,荣青峰.实验性2型糖尿病大鼠模型的研究[J].中国药物与临床,2002,2(6):383.
[6]李光伟,潘孝仁,Lillioja S,等.简测人群胰岛素敏感性的一项新指数[J].中华内科杂志,1993,32(10):656.
[7]吴正,姜月华.脂毒性和2型糖尿病关系探讨[J].现代中西医结合杂志,2004,13(20):2793-2794.
[8]孔树佳,付继华.胰岛素抵抗与糖、脂代谢紊乱[J].中国老年医学杂志,2009,29(18):2403-2405.
[9]司晓晨,尚文斌,潘杨,等.胰敏胶囊治疗2型糖尿病胰岛素抵抗的实验研究[J].时珍国医国药,2003,14(12):721.
[10]Sunsaneevithayakul P,Boriboohirunsam D,Sutanthsvibul A,et al.Risk factorbased seleetive screening program for gestational diabetes melltus in siriraj Hopsital:Result from chinical practice guideline[J].J M ed Assoc Thai,2003,86(8):708-714.
[11]窦京涛,母义明,陆菊明,等.血管紧张素Ⅱ受体拮抗剂对大鼠脂肪分泌瘦素、脂联素和 TNF-α的影响[J].解放军医学杂志,2006,31(2):138-140.
[12]高珊,黎明,陆菊明,等.2型糖尿病一级亲属血清脂联素、瘦素及其比值与胰岛素抵抗的相关性研究[J].中国糖尿病杂志,2007,15(3):149-151.
[13]雒晓春,乔晓娟,石秀换.瘦素和代谢综合征的研究现状[J].医学综述,2009,15(12):1870-1872.
[14]史东萍.瘦素在糖尿病发病中的作用[J].中国医药导报,2009,6(30):123-124.

