塑料增塑剂对凡纳滨对虾存活、生长和免疫的影响
王兴强,曹梅,阎斌伦,马甡
1.淮海工学院 江苏省海洋生物技术重点实验室,连云港222005
2.中国海洋大学 教育部海水养殖重点实验室,青岛266003
塑料增塑剂对凡纳滨对虾存活、生长和免疫的影响
王兴强1,*,曹梅1,阎斌伦1,马甡2
1.淮海工学院 江苏省海洋生物技术重点实验室,连云港222005
2.中国海洋大学 教育部海水养殖重点实验室,青岛266003
研究了塑料增塑剂邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二辛酯(DOP)对凡纳滨对虾(Litopenaeus vannamei)存活、生长和免疫的影响.96h急性毒性实验表明,在助溶剂Tween 20的安全浓度范围内,随着DMP、DEP、DBP和DOP水平的升高,凡纳滨对虾存活率呈下降趋势,24h、48h、72h和 96h的 LC50分别为 40.33、35.29、25.48、19.14mg·L-1,30.52、23.45、16.96、15.38mg·L-1,7.51、6.97、6.57、6.06mg·L-1和6.85、5.87、5.01、4.47mg·L-1;DMP、DEP、DBP和DOP对凡纳滨对虾的安全浓度随塑料增塑剂碳链的增加呈下降趋势,分别为8.11、4.15、1.80和1.29mg·L-1.90d慢性毒性实验表明,凡纳滨对虾存活率、特定生长率、血清蛋白含量、血清酚氧化酶和超氧化物歧化酶活性均以对照组和0.0400mg·L-1助溶剂Tween 20处理组最高,而且显著高于1/100倍DMP、DEP、DBP和DOP安全浓度处理组(p<0.05).
凡纳滨对虾;塑料增塑剂;存活;生长;免疫
Received 27 February 2009 accepted 18 March 2009
Abstract:The experiments were designed to determine the effects of plastic plasticizers on survival,growth and immune factors of Litopenaeus vannamei.The four commonly used plasticizers were dimethyl phthalate(DMP),diethyl phthalate(DEP),di-n-butyl phthalate(DBP)and dioctyl phthalate(DOP).The result of acute toxicity test for 96h indicated that the survival rate of Litopenaeus vannamei exhibited decreased trend with increasing DMP,DEP,DBP and DOP levels within the safety concentration of co-solvent Tween 20,and LC50at 24h,48h,72h and 96h were 40.33,35.29,25.48 and 19.14mg·L-1;30.52,23.45,16.96 and 15.38mg·L-1;7.51,6.97,6.57 and 6.06mg·L-1;6.85、5.87,5.01 and 4.47mg·L-1,respectively.The safety concentration of DMP,DEP,DBP and DOP decreased with increasing carbon chain,and were 8.11,4.15,1.80 and 1.29mg·L-1,respectively.The result of chronic toxicity test for 90d indicated that the survival rate, specific growth rate,serum protein content,polyphenol oxidase activity and superoxide dismutase activity were high in the control and 0.0400mg·L-1co-solvent Tween 20 treatment,which were significantly higher than the treatments of 1/100 safety concentration of DMP,DEP,DBP and DOP.
Keywords:Litopenaeus vannamei;plastic plasticizer;survival;growth;immune factors
1 引言(Introduction)
邻苯二甲酸酯类化合物(Phthalic Acid Easters,PAEs)又称酞酸酯,其中有8种在工业上用作增塑剂,以增加塑料及橡胶制品的可塑性.在塑料中,PAEs与聚烯烃类塑料分子之间由氢键或范德华力连接,彼此保留各自相对独立的化学性质,随着时间的推移,可由塑料中迁移到外环境,造成对空气、水和土壤的污染(Ching et al.,1981).有关PAEs对水生生物毒性的研究,国内外已有比较多的报道,但主要集中于PAEs对浮游动物、鱼类等敏感生物的生长、繁殖等生理功能的影响,对虾类的报道相对较少(Vivian,1986;Warren et al., 2003;Horn et al.,2004).塑料制品在对虾养殖中广泛应用,如在苗种生产上常用塑料薄膜缠裹培育池中的加热管道,在苗种和养殖生产上常用塑料管道输水等.塑料制品在高温条件下可产生有毒物质,对对虾危害很大.马甡等(1997)研究发现,在水中加热塑料薄膜后水中的化学需氧量显著上升,推测可能与有大量恶化化学物质溶出有关.凡纳滨对虾(Litopenaeus vannamei)是我国海水养殖业重要种类之一,但近年来,由于水质污染,其种质出现退化,疾病流行,对虾养殖业损失重大.鉴于此,本文探讨了几种常用塑料增塑剂对凡纳滨对虾存活、生长和免疫的影响.
2 材料与方法(Materials and methods)
实验于2008年5月至11月份在江苏省海洋生物技术重点实验室进行.凡纳滨对虾(Litopenaeus vannamei),平均湿体重(0.625±0.386)g,购自赣榆县海洋源育苗厂.对虾在一个玻璃纤维水槽(200cm×200cm×100cm)中暂养,水温23.5~25.0℃,盐度31.
2.1 急性毒性实验
实验采用单因素设计,助溶剂Tween 20、邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二辛酯(DOP)设计梯度见表1.每个水族箱(30cm× 40cm×50cm,养殖水体50L)放养5尾对虾,每个处理设3个重复,盐度31,水温(25.0±0.1)℃,实验周期96h.

表1 急性毒性实验浓度梯度Table 1 Concentration gradient of acute experiment
2.2 慢性毒性实验
在急性毒理实验结果的基础上,实验设6个处理,分别为盐度31海水对照组、0.0400mg·L-1助溶剂 Tween 20处理组、1/100倍塑料增塑剂 DMP、DEP、DBP和DOP安全浓度处理组(1/100 DMP处理组:1/100倍 DMP安全浓度+0.0400mg·L-1Tween 20,即0.0811mg·L-1DMP+0.0400mg·L-1Tween 20;1/100 DEP、1/100 DBP和1/100 DOP处理组同 DMP处理,即 0.0415mg·L-1DEP+ 0.0400mg·L-1Tween20、0.0180mg·L-1DBP+ 0.0400mg·L-1Tween 20、0.0129mg·L-1DOP+ 0.0400mg·L-1Tween 20),每个水族箱(30cm× 40cm×50cm,养殖水体50L)放养5尾对虾,每个处理设6个重复.
实验前停食24h,用电子天平称其初始体重.饲料为福建马尾生产的“海马”牌人工配合饲料,其粗蛋白、脂肪、灰分和含水量分别为(38.07± 0.37)%、(9.81±0.24)%、(12.21±0.32)%和(4.45± 0.57)%.日投饵两次(06:00和18:00),过量投饵;投饵2.5h后从每个水族箱收集残饵和粪便.为维持实验期间水族箱内所设塑料增塑剂浓度的稳定性,每隔3d,水族箱彻底换水一次,实验周期90d.实验期间,盐度保持在31,溶解氧6.0mg·L-1以上,pH 7.7~8.2,水温(25.0±0.1)℃.
实验结束后,对每个水族箱中的凡纳滨对虾再次进行计数和称重;每个水族箱取3~5尾对虾,取血时用1mL无菌注射器,按照血淋巴与抗凝剂(0.01mol·L-1Tris-HCl,0.25mol·L-1蔗糖,0.1mol·L-1柠檬酸三钠;pH 7.6;780mOs·kg-1)1:2的比例,自对虾头胸甲后插入心脏抽取血液,合并置于无菌Eppendorf管.所取抗凝血,一部分离心10min(700×g,4℃)(MIKR022R,德国HEYYICH公司),所得的上清液一部分用于血清酚氧化酶(PO)活力的测定,另一部分于-20℃冰箱中保存,用于血清蛋白含量和超氧化物歧化酶(SOD)的测定.
2.3 免疫指标的测定
2.3.1 血清蛋白含量
应用总蛋白定量测试盒(南京建成生物工程研究所生产),反应于96孔酶标板中,用酶标仪测量各反应体在595nm波长下OD值.
2.3.2 PO活力的测定
以L-DOPA为底物,采用改进的Ashida方法(雷质文等,2001;Ashida,1971)在96孔酶标板中进行.把10μL血清加入96孔酶标板中,然后向各孔中加入 200μL 0.1mol·L-1pH 6.0磷酸盐缓冲液,最后向各孔中加入10 μl的L-DOPA(Sigma公司)(0.01 molμL-1)在酶标仪(BIO-TEKSYNERGE,美国Bio公司)中振荡4次,每隔4min读取490nm处的吸光值,酶活力以试验条件下,OD490每分钟增加0.001为一个酶活力单位.
2.3.3 超氧化物歧化酶(SOD)的测定
应用超氧化物歧化酶(SOD)测试盒(南京建成生物工程研究所生产),反应于96孔酶标板中,用酶标仪测量各反应体在550nm波长下OD值.
2.4 数据处理与计算
所得数据用单因素方差分析、Turkey’s多重比较,以p<0.05作为差异显著水平.安全浓度(Sc)以下式计算:
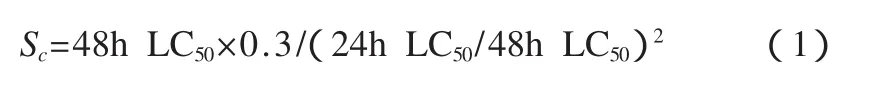
式中:LC50为半致死浓度.特定生长率(SGR)的计算公式为:
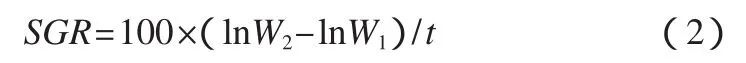
式中W1和W2分别为凡纳滨对虾的初体重和末体重(湿重);t为实验周期.
3 结果与分析(Results and analysis)
3.1 急性毒性实验
Tween 20是一种非离子表面活性剂,因为PAEs在水中的溶解度很小,利用表面活性剂的两亲性性质和乳化作用,增大PAEs在水中的溶解度.张春荣等(2004)研究发现,适量的Tween 20有利于提高细胞某些酶的稳定性和催化能力,但高浓度的Tween 20可抑制细胞的活力.由表2可以看出,随着Tween 20水平的升高,凡纳滨对虾存活率呈下降趋势;在24h、48h、72h和96h,LC50分别为129.62、110.08、80.47、70.21mg·L-1,安全浓度为23.82mg·L-1,表明Tween 20对凡纳滨对虾有一定的毒性.
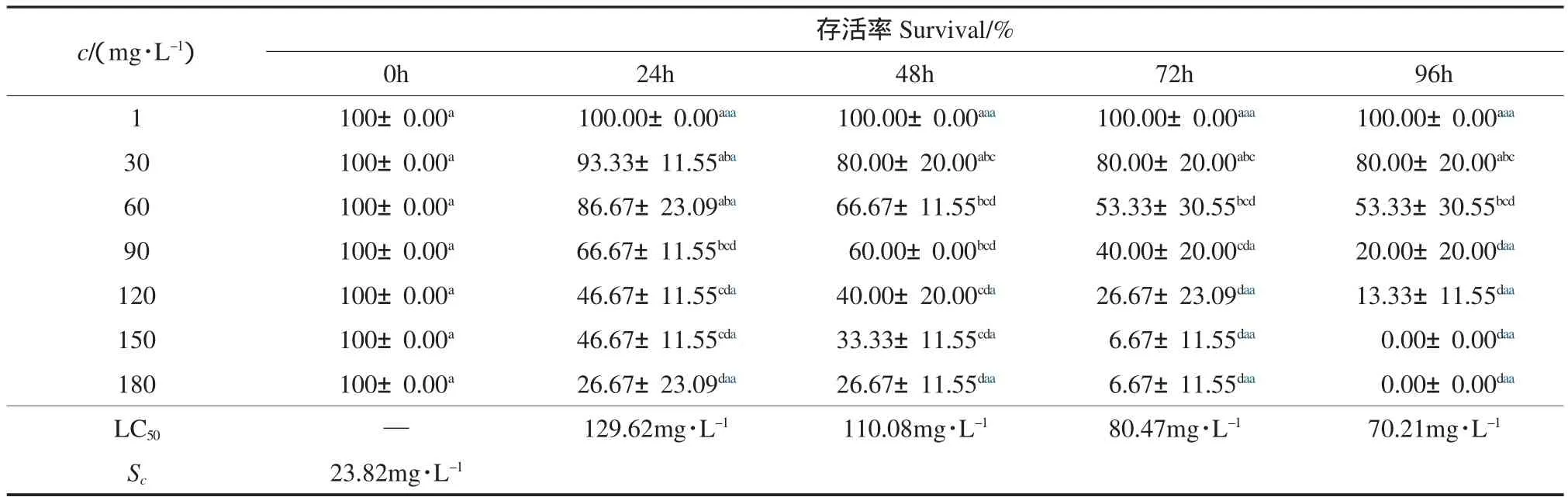
表2 Tween 20对凡纳滨对虾存活率的影响(Mean±SD)Table 2 The effect of Tween 20 on survival of Litopenaeus vanname(iMean±SD)
由表3~表6可以看出,在助溶剂Tween 20的安全浓度范围内,随着DMP、DEP、DBP和DOP水平的升高,凡纳滨对虾存活率呈下降趋势,24h、 48h、72h和96h的LC50分别为40.33、35.29、25.48、19.14mg·L-1,30.52、23.45、16.96、15.38mg·L-1,7.51、6.97、6.57、6.06mg·L-1和 6.85、5.87、5.01、4.47mg·L-1;安全浓度分别为 8.11、4.15、1.80和1.29mg·L-1,表明随碳链的增加,塑料增塑剂对凡纳滨对虾的急性毒性呈增大趋势.与本研究相似,Call等(2001)研究发现,DMP、DEP和 DBP对 Hyalella azteca的LC50分别为28.1、4.21和0.63mg·L-1,而对Chironomus tentans的LC50分别为68.2、31.0和2.64mg·L-1,与本研究结果具有可比性.

表3 邻苯二甲酸二甲酯对凡纳滨对虾存活率的影响(Mean±SD)Table 3 The effect of dimethyl phthalate on survival of Litopenaeus vannamei(Mean±SD)
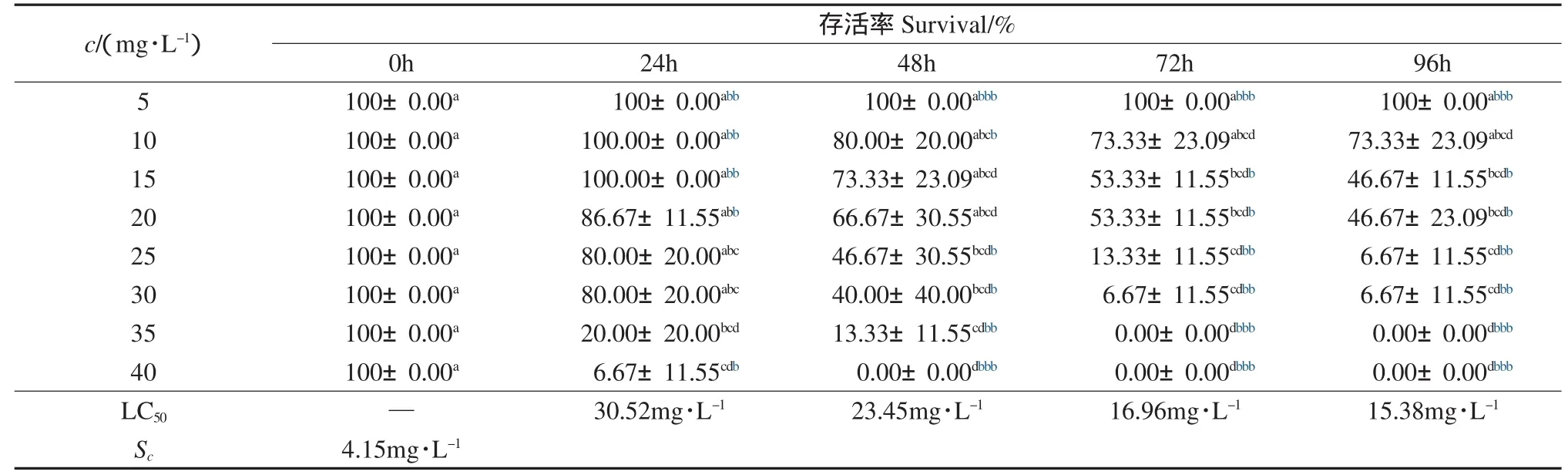
表4 邻苯二甲酸二乙酯对凡纳滨对虾存活率的影响(Mean±SD)Table 4 The effect of diethyl phthalate on survival of Litopenaeus vannamei(Mean±SD)
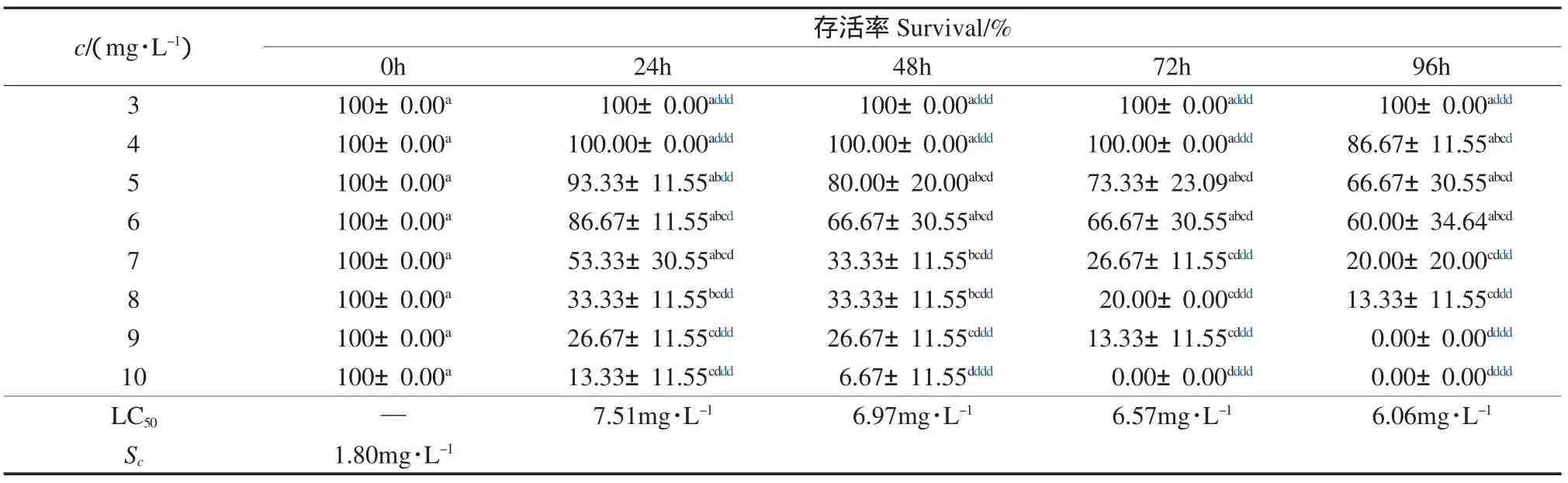
表5 邻苯二甲酸二丁酯对凡纳滨对虾存活率的影响(Mean±SD)Table 5 The effect of di-n-butyl phthalate on survival of Litopenaeus vannamei(Mean±SD)
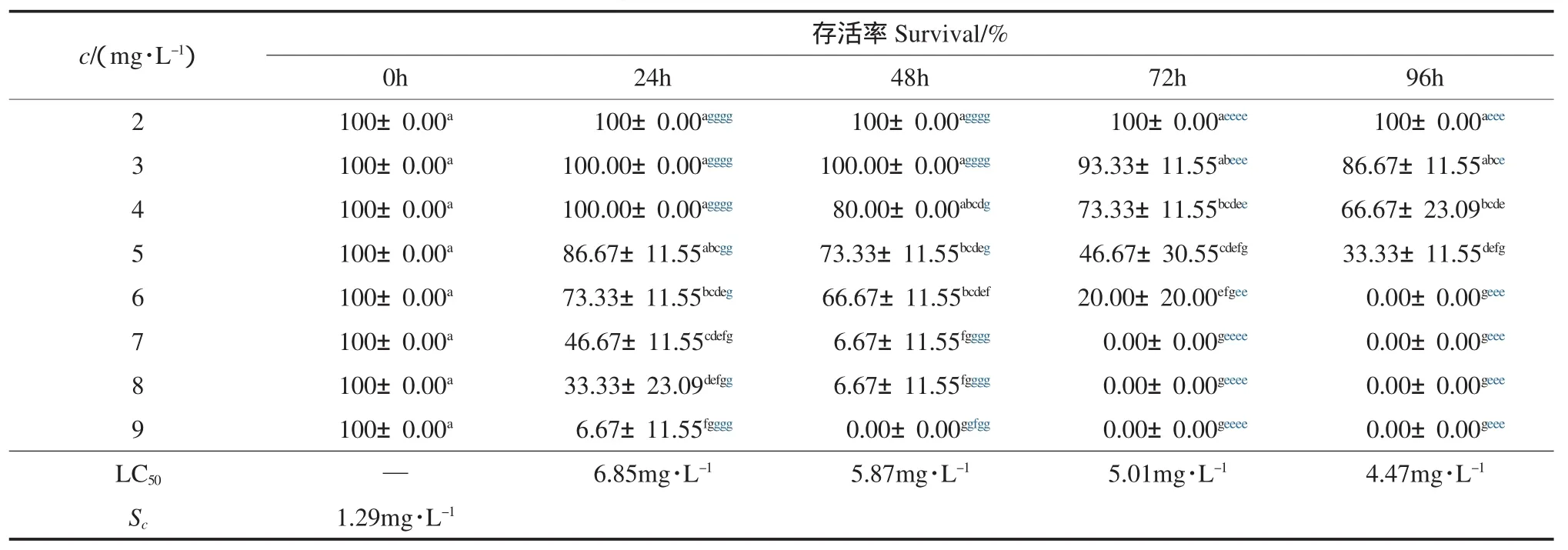
表6 邻苯二甲酸二辛酯对凡纳滨对虾存活率的影响(Mean±SD)Table 6 The effect of dioctyl phthalate on survival of Litopenaeus vannamei(Mean±SD)
3.2 慢性毒性实验
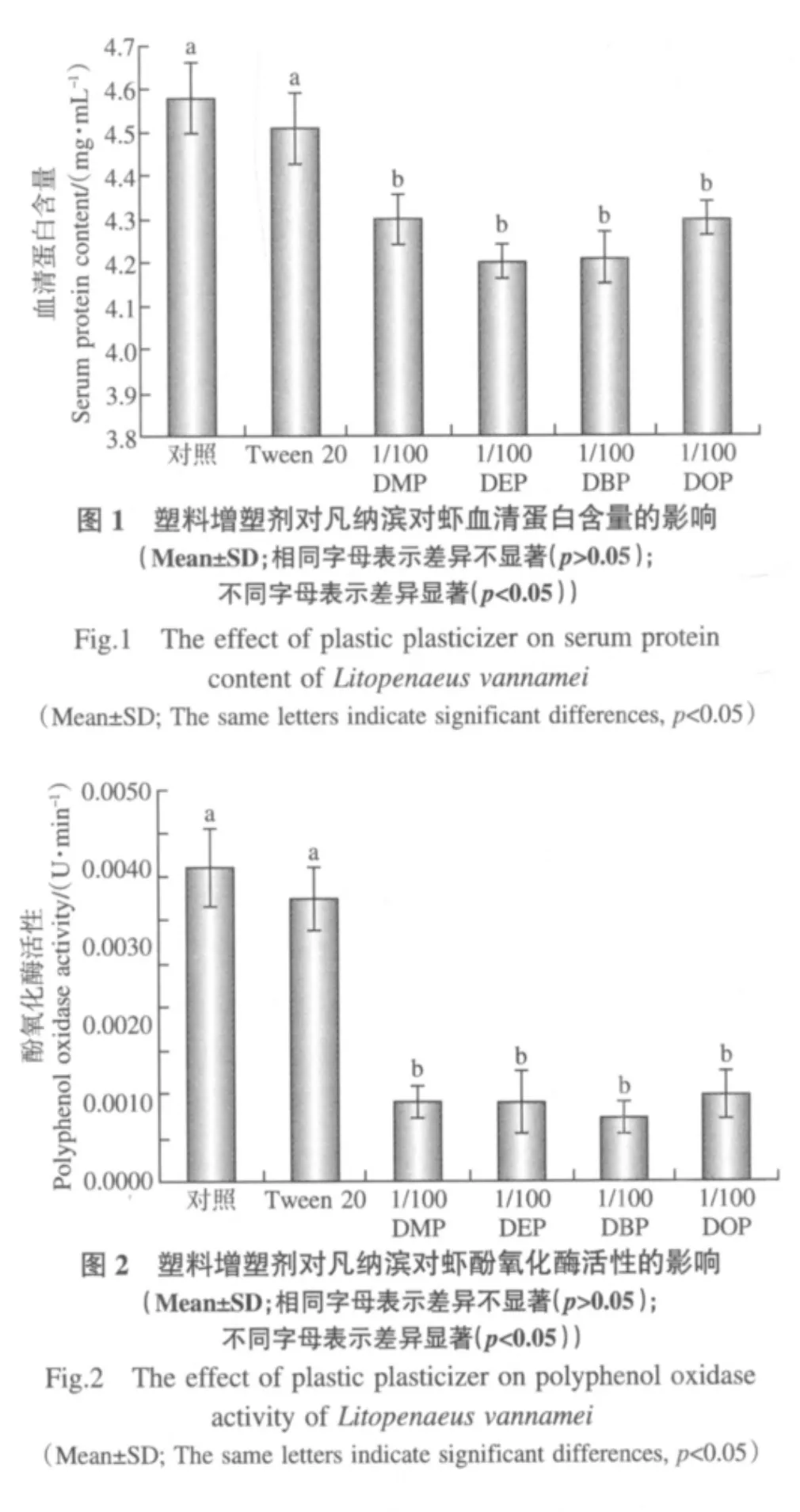
据2000年的一项调查显示,国外的海洋表层水和淡水中PAEs含量在0.1~300.0 μg·L-1之间,我国大的江河湖泊、水库、饮用水、大气、土壤底泥中也均不同程度地检出PAEs(Warren et al.,2003; Vivian,1986).PAEs易溶于脂肪和有机溶剂,有较强的生物富集作用和一定强度的抗降解能力,而某些水生物对PAEs有惊人的浓缩作用.例如,虾在含邻苯二甲酸二异辛酯0.11μg·L-1的水中生活两周后,体内邻苯二甲酸二异辛酯的含量可高达1.34mg·L-1,浓缩了大约12000倍;水体幼虫在浓度为0.18μg·L-1的DBP中暴露7d后,体内DBP浓缩了大约 6000倍(Sung et al.,2003;Defoe et al.,1990);李潇等(2008)研究发现,DBP在珠江三角洲地区鲫鱼、草鱼和罗非鱼3种鱼类体内的含量在3~10mg·kg-1之间.生物富集是造成慢性毒害、引起器质性病变和影响生理机能的重要因素(李学彬等,2008;Thurén and Woin,1991).在含邻苯二甲酸二异辛酯剂量为3、10和30μg·L-1的水体中,大型蚤在两周内的繁殖量比正常情况分别减少60%、70%和80%(战宇明,2004).本研究中,经过90d的养殖实验发现:凡纳滨对虾存活率和特定生长率以对照组和0.0400mg·L-1助溶剂Tween 20处理组最高,而且显著高于 1/100倍 DMP、DEP、DBP和DOP安全浓度处理组(p<0.05;表7).同样,林玲等(2008)研究了DBP对斑马鱼胚胎发育毒性的影响,发现625μg·L-1以上剂量的DBP染毒能导致斑马鱼胚胎发育迟缓.如果这些有害物质,通过生物的吸收,并由食物链进一步传递和富集,最终将会影响到人类健康.
PAEs还会影响水生生物的免疫系统(Chen and Sung,2004).李文英等(2007)等对数浓度差设置4个质量浓度0.38、0.85、1.90和4.25mg·L-1进行20d慢性染毒,发现随DBP浓度增大和暴露时间延长,斑马鱼肝脏、鳃中SOD和ATPase活性均显著受到抑制.血清蛋白含量、PO、SOD等是表征对虾免疫状态的重要指标.对虾生活在一个具有潜在危害的水体环境中,由于其尚不具备特异性的免疫系统,为保护自身免受伤害,机体形成了各种非特异性的免疫保护体系,但是当环境剧烈变化时,免疫系统崩溃,会造成对虾大规模死亡.已有许多研究表明,在环境胁迫条件下,对虾的血细胞数量减少,与抗病力有关的酶活力降低,对病原体的易感性提高(Chen and Chang,1993; Perazzolo et al.,2002).90d的慢性毒理实验表明,凡纳滨对虾血清蛋白含量、血清酚氧化酶和超氧化物歧化酶活性均以对照组和0.0400mg·L-1助溶剂Tween 20处理组最高,而且显著高于1/100倍DMP、DEP、DBP和DOP安全浓度处理组(p<0.05)(图1~图3).这可能是由于对虾处于应激状态,一方面需要消耗对虾体内的免疫因子,从而导致免疫因子活力下降,血清蛋白含量、血清酚氧化酶和超氧化物歧化酶活性降低;另一方面对虾生理机能失调,从而使得虾体对病原菌的易感性提高,对虾存活率降低,生长速度减缓.

表7 塑料增塑剂对凡纳滨对虾存活和生长的影响(Mean±SD)Table 7 The effect of plastic plasticizer on survival and growth of Litopenaeus vannamei(Mean±SD)

综合以上研究得到如下结论:
1)在助溶剂Tween 20的安全浓度范围内,随着DMP、DEP、DBP和DOP水平的升高,凡纳滨对虾存活率呈下降趋势;随碳链的增加,塑料增塑剂对凡纳滨对虾的急性毒性呈增大趋势.
2)凡纳滨对虾长期处于DMP、DEP、DBP和DOP低浓度条件下,可导致对虾处于应激状态,一方面需要消耗对虾体内的免疫因子,从而导致免疫因子活力下降,血清蛋白含量、血清酚氧化酶和超氧化物歧化酶活性降低;另一方面对虾生理机能失调,从而使得虾体对病原菌的易感性提高,对虾存活率降低,生长速度减缓.
Ashida M. 1971.Purification and characterization of prephenoloxidase from hemolymphofthesilkworm Bombyxmori[J].Archives of Biochemistry and Biophysics,144(2):749-762
Call D J,Markee T P,Geiger D L,Brooke L T,Van de Venter F A,Cox D A,Genisot K I,Robillard K A,Gorsuch J W,Parkerton T F,Reiley M C,Ankley G T,Mount D R. 2001.An assessment of the toxicity of phthalate esters to freshwater benthos.1.Aqueous exposures[J].Environmental Toxicology& Chemistry,20(8):1798-1804
ChenJC,ChangS Y.1993.Studiesonhaemocyaninand haemolymph protein levels of Penaeus japonicus based on sex, size and moulting cycle[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,106(2):293-296
Chen W L,Sung H H.2005.The toxic effect of phthalate esters on immune responses of giant freshwater prawn(Macrobrachium rosenbergii)via oral treatment[J].Aquatic Toxicology,74(2):160-171
Ching N P H,Jham G N,Subbarayan C,Grossi C,Hicks R, Nealon T F Jr.1981.Gas chromatographic quantitation of two plasticizers contaminating intravenous fluids stored in plastic containers[J].Journal of Chromatography B:Biomedical Sciences and Applications,225(1):196-201
Defoe D L,Holcombe G W,Hammermeister D E,Biesinger K E.1990.Solubility and toxicity of eight phthalate esters to four aquatic organisms[J].Environmental Toxicity and Chemistry,9(5):623-636
Horn O,Nalli S,Cooper D,Nicell J.2004.Plasticizer metabolites in the environment[J].Water Research,38(17):3693-3698
Lei Z W,Huang J,Yang B,Yu K K.2001.Immune factors in haemolymph supernatant of Penaeus chinensis infected by WSSV[J].Journal of Fishery Sciences of China,8(4):46-51(in Chinese)
Li W Y,Xiong L,Liu R,Jiang Y,Hu Q Q,Wang L M.2007. Effects of DBP on physiological and biochemistrical characteristics of Brachydanio Rerio[J].Asian Journal of Ecotoxicology,2(1):117-122(in Chinese)
Li X B,Chen L,Wu D,Li Y,Ding S M,Yang X,Yuan J L.2008.Oxidation damage of di-(2-ethylhexyl)phthalateto brain and didney cells of gold larval fishes[J].Chemistry& Bioengineering,25(4):57-59(in Chinese)
Li X,Nie X P,Pan D B,Li G Y.2008.Analysis of PAEs in muscle tissue of freshwater fish from fishponds in Pearl River Delta[J].Journal of Environment and Health,25(3):202-205(in Chinese)
Lin L,Wang Y Z,Ding X C,Song W M,Zhang Y H.2008. Embryotoxicity of di-n-butyl phthalate to zebrafish(Brchydanio rerio)embryos[J].Journal of Hygiene Research,37(3):278-280(in Chinese)
Ma S,Qu Y Q,Wang D J.1997.The effect of inhibiting matter on feeding shrimp larvae(Penaeus chinensis)[J].Marine Sciences,(2):1-3(in Chinese)
Perazzolo L M,Gargioni R,Ogliari P,Barracco M A A.2002. Evaluation ofsome hemato-immunologicalparametersin the shrimp Farfantepenaeus paulensis submitted to environmental and physiological stress[J].Aquaculture,214(1-4):19-33
Sung H H,Kao W Y,Su Y J.2003.Effects and toxicity of phthalate esters to hemocytes of giant freshwater prawn,Macrobrachium rosenbergii[J].Aquatic Toxicology,64(1):25-37
Thurén A,Woin P.1991.Effects of phthalate esters on the locomotoractivity ofthefreshwateramphipodGammaruspulex[J].Bulletin of Environmental Contamination and Toxicology,46(1):159-166
Vivian C M G.1986.Tracers of sewage sludge in the marine environment:A review[J].Science of The Total Environment, 53(1-2):5-40
Warren N,Allan I J,Carter J E,Houseb W A,Parker A.2003.Pesticidesand othermicro-organic contaminantsin freshwater sedimentary environments-a review[J].Applied Geochemistry,18(2):159-194
Zhang C R,Li L,Chen G.2004.Influences of DMSO,Tween-20 and Triton X-100 on production ofisoflavones in cell suspension cultures in Pueraria lobata[J].Biotechnology,14(5):60-63(in Chinese)
中文参考文献
雷质文,黄倢,杨冰,俞开康.2001.感染白斑综合症病毒(WSSV)对虾相关免疫因子的研究[J].中国水产科学,8(4):46-51
李文英,熊丽,刘荣,蒋园,胡芹芹,王黎明.2007.邻苯二甲酸二丁酯(DBP)对斑马鱼(Brachydanio rerio)生理生化特性的影响[J].生态毒理学报,2(1):117-122
李潇,聂湘平,潘德博,李桂英.2008.养殖鱼体邻苯二甲酸酯含量与分布特征[J].环境与健康杂志,25(3):202-205
李学彬,陈莉,吴丹,李艳,丁书茂,杨旭,袁均林.2008.邻苯二甲酸二乙基己酯对金鲫鱼脑组织和肾脏的氧化损伤作用[J].化学与生物工程,25(4):57-59
林玲,王玉柱,丁训诚,宋伟民,张蕴晖.2008.邻苯二甲酸二丁酯对斑马鱼胚胎发育毒性的研究[J].卫生研究,37(3):278-280
马甡,曲永琪,王敦江.1997.中国对虾幼体厌食现象的观察与分析[J].海洋科学,(2):1-3
战宇明.2004.增塑剂对水环境的污染及防治方法[J].应用能源技术,(2):25-26
张春荣,李玲,陈刚.2004.DMSO、Tween-20和Triton X-100对野葛悬浮细胞异黄酮生产的影响[J].生物技术,14(5):60-63
EffectsofPlasticPlasticizersonSurvival,Growth and Immune Factors of Litopenaeus vannamei
WANG Xing-qiang1,*,CAO Mei1,YAN Bin-lun1,MA Shen2
1.Jiangsu Key Laboratory of Marine Biotechnology,Huaihai Institute of Technology,Lianyungang 222005
2.Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003
1673-5897(2010)1-069-07
X174,S968.22
A
王兴强(1975—),男,博士,副教授,主要从事水生动物生理生态研究.
2009-02-27 录用日期:2009-03-18
“十一五”国家科技支撑计划重大项目(No.2006BAD09A01;No.2006BAD09A06);江苏省自然科学基金项目(No.BK2006548);江苏省教育厅“青蓝工程”项目(No.QN07008)
王兴强(1975—),男,副教授,博士;*通讯作者(Corresponding author),E-mail:xqwangcaomei@yahoo.com.cn

