脱脂乳发酵过程中β-乳球蛋白和α-乳白蛋白抗原性变化规律*
张颖,布冠好,2,郑喆,罗永康
1(中国农业大学食品科学与营养工程学院,北京,100083) 2(河南工业大学粮油食品学院,河南郑州,450052)
脱脂乳发酵过程中β-乳球蛋白和α-乳白蛋白抗原性变化规律*
张颖1,布冠好1,2,郑喆1,罗永康1
1(中国农业大学食品科学与营养工程学院,北京,100083) 2(河南工业大学粮油食品学院,河南郑州,450052)
选择 8株乳酸菌对脱脂乳进行发酵,通过间接竞争 EL ISA法测定了不同菌种、发酵时间、冷藏时间下发酵乳中β-乳球蛋白(β-LG)和α-乳白蛋白(α-LA)的残留抗原性。结果表明,经不同乳酸菌发酵 12 h后,发酵乳中β-LG和α-LA的抗原性均出现不同程度的下降,且菌株间差异显著。随着发酵时间的延长,β-LG和α-LA的抗原性在 3~12 h内迅速下降,下降速度为瑞士乳杆菌 >保加利亚乳杆菌 >嗜热链球菌,复合菌株发酵对降低抗原性具有协同效果;继续发酵至 48h,抗原性变化缓慢。瑞士乳杆菌发酵乳在 4℃冷藏 7 d后,与冷藏前相比,α-LA的抗原性下降 5%左右,而β-LG的抗原性无显著变化。
抗原性,发酵,乳酸菌,β-乳球蛋白,α-乳白蛋白
牛乳是较易引起过敏的食物之一,大约有 2%~6%的婴幼儿对乳蛋白质有不同程度的过敏。乳蛋白中主要过敏原为乳清蛋白中的β-乳球蛋白(β-LG)和α-乳白蛋白(α-LA)。牛乳蛋白过敏可引起过敏性鼻炎、哮喘、湿疹、腹泻、胃肠出血等疾病,甚至会导致过敏性休克,严重影响婴幼儿的健康成长[1]。近年来研究发现,发酵乳制品具有改善消化、降低血中胆固醇、抗菌、抗癌等多种功能,日常膳食中食用发酵乳还能预防、减轻过敏症状[2-3]。Majamaa[4]研究表明,牛奶过敏婴儿食用乳酸菌水解的乳清蛋白 1个月后,婴儿的肠道炎症可得到有效缓解。
关于采用乳酸菌发酵来降低乳清蛋白过敏原的研究国外已有一些报道。W róblewska[5]证明,牛乳经乳酸菌发酵后,β-LG和α-LA的抗原性降低 99%以上;Kleber[6]用乳酸菌发酵脱脂乳、甜乳清后,β-LG抗原性分别降低了 90%和 70%;Maier[7]研究指出,酸乳中β-LG的消化率比生牛乳提高 30%,不同发酵方式酸乳中蛋白的抗原性降低程度存在差异。而Britt[8]用瑞士乳杆菌对脱脂乳发酵 113 h后,β-LG含量虽逐渐减低,但 IgE介导的β-LG抗原性却没有显著变化。可以看出,目前关于通过乳酸菌发酵来降低乳清蛋白抗原性的研究结果差异较大,同时对发酵过程中乳清蛋白抗原性的变化规律也缺乏系统的研究。
本实验选择 8株乳酸菌对脱脂乳进行发酵,研究了不同菌种、发酵时间、冷藏时间对发酵乳中β-LG和α-LA抗原性的影响,并通过测定发酵乳的 pH值和游离氨基酸含量,初步探讨了导致发酵过程中乳清蛋白抗原性变化的原因,从而为低致敏牛乳制品的开发提供一定的实验依据和理论基础。
1 材料与方法
1.1 乳酸菌菌种
乳酸菌菌种共 8株:德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckiisubsp.bulgaricus)S-5、S-7、S-7*,干酪乳杆菌(Lactobacillus casei),来自中国农业大学食品学院功能乳品实验室。瑞士乳杆菌(Lactobacillus helveticus),干酪乳杆菌 Zhang(Lactobacillus casei),嗜酸乳杆菌(Lactobacillus acidophilus),嗜热链球菌(Streptococcus ther m ophilus),来自吉林农科院和内蒙古农业大学。
1.2 试剂
β-乳球蛋白(编号 L3908)、α-乳白蛋白(编号L5385)、羊抗兔 IgG-HRP(1:10000,编号 A6154)、三硝基苯磺酸(编号 P2297),均为 Sigma公司;抗体为兔抗β-LG血清,兔抗α-LA血清,自制;L-亮氨酸,上海蓝季科技发展有限公司;脱脂奶粉,新西兰进口,其中水分3.8%,蛋白质 33.4%,脂肪 0.8%,灰分 7.9%。
1.3 仪器与设备
96孔酶标板(聚苯乙烯),Costar;Thermo Multiskan MK3酶标仪,Ther mo Electron公司;YT-CJ-1ND超净工作台,北京亚泰科隆实验技术开发中心;YXQLS-18SI高压蒸汽灭菌锅,上海博讯实业有限公司;Merttle Toledo酸度计;UV-2600紫外可见分光光度计,尤尼柯(上海)仪器有限公司;W201电热恒温水浴锅,上海申生科技有限公司;LRH-250生化培养箱,上海一恒科技有限公司。
1.4 实验方法
1.4.1 乳酸菌的活化及传代[9]
在无菌超净工作台中,挑取少量菌种冻干粉,转移到 10%脱脂乳培养基(115℃,15 min灭菌)中,传代培养 2~3次,使各菌株活力充分恢复。菌株活化好后,划线培养于 MRS或 M17固态培养基的平板上,置于培养箱中培养至长出合适大小的菌落。挑单菌落镜检观察所得菌株是否为纯菌。若菌株已经为纯菌,则进行下步实验。
1.4.2 发酵乳样品的制备
将脱脂乳粉按照 12.5%的质量比复原为脱脂乳,经 90℃,5 min热处理后,冷却至 45℃,在无菌超净工作台中进行乳酸菌接种。按 2%(v/v)的接种量接入单株或复合菌株发酵剂,摇匀后于 37℃(杆菌)或 42℃(球菌和复合菌)生化培养箱中进行发酵。分别于 0,3,6,9,12,18,24,36,48 h取样,搅拌均匀后在 4℃下、8000 r/min离心 10 min,取上清液分装于小管,-20℃冻藏待测。发酵乳凝乳后放 4℃冷藏,分别于 0,0.25,0.5,1,2,3,4,5,6,7 d取样,以下步骤同上。
1.4.3 发酵乳 pH值的测定
用Merttle Toledo酸度计测定 pH值。
1.4.4 发酵乳中游离氨基酸含量的测定
采用三硝基苯磺酸(trinitrobenzene sulfonic acid,TNBS)法测定发酵乳中游离氨基酸含量[10],以衡量发酵乳中蛋白水解程度。
1.4.5 发酵产物抗原性测定
采用间接竞争 EL ISA方法测定发酵乳中β-LG和α-LA的残余抗原性[11]。
间接竞争 EL ISA中被测物和包被抗原竞争与抗体结合,因此包被抗原与抗体生成复合物的量与被测物中抗原量成反比。被测物的抗原性大小可用抗原残留量表示,按下式计算:
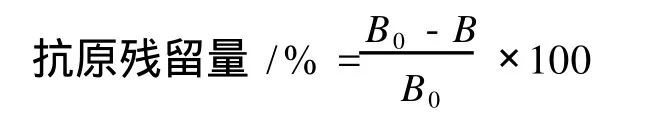
其中,B表示各被测样品的 OD值,B0为无竞争体系的OD值。
1.4.6 数据分析
实验数据利用 SAS9.0软件(SAS Institute Inc.,Cary,NC,USA)进行单因素方差分析(ANOVA),用邓肯氏多变域检测法确定数据间的差异,P<0.05表示统计学上差异显著。
2 结果与讨论
2.1 乳酸菌菌种对发酵乳中乳清蛋白抗原性的影响
8株乳酸菌发酵脱脂乳 12 h后,发酵乳中β-LG和α-LA抗原性、pH值、游离氨基酸浓度见表 1。脱脂乳经 90℃,5 min处理后,β-LG和α-LA的抗原性有所升高,这主要是因为热处理使蛋白质变性,较多隐藏的抗原表位暴露出来[12]。发酵 12 h后,脱脂乳中β-LG和α-LA的抗原性均出现不同程度的降低,不同菌株间差异显著,以瑞士乳杆菌效果为最佳,β-LG和α-LA抗原性分别降低了 47.23%和 33%,而嗜热链球菌效果最差,β-LG和α-LA抗原性仅分别降低了 16.93%和 16.77%。W róblewska[5]对灭菌乳(110℃,10 min)采用嗜温和嗜热乳酸菌或复合菌进行发酵,凝乳后乳清蛋白的抗原性比生乳降低 99%以上。Kleber[6]的研究表明,90℃,40 min热处理的脱脂乳经不同乳酸菌发酵 24 h后,β-LG抗原性降低了 84%~98%。这或许说明发酵前热处理的温度对抗原性的变化有一定的影响,或者是菌株来源的不同导致上述差异[13-14]。表 1也表明,脱脂乳经 3株不同来源的保加利亚乳杆菌发酵后,β-LG和α-LA的抗原残留量、pH值及游离氨基酸浓度有一定差别。
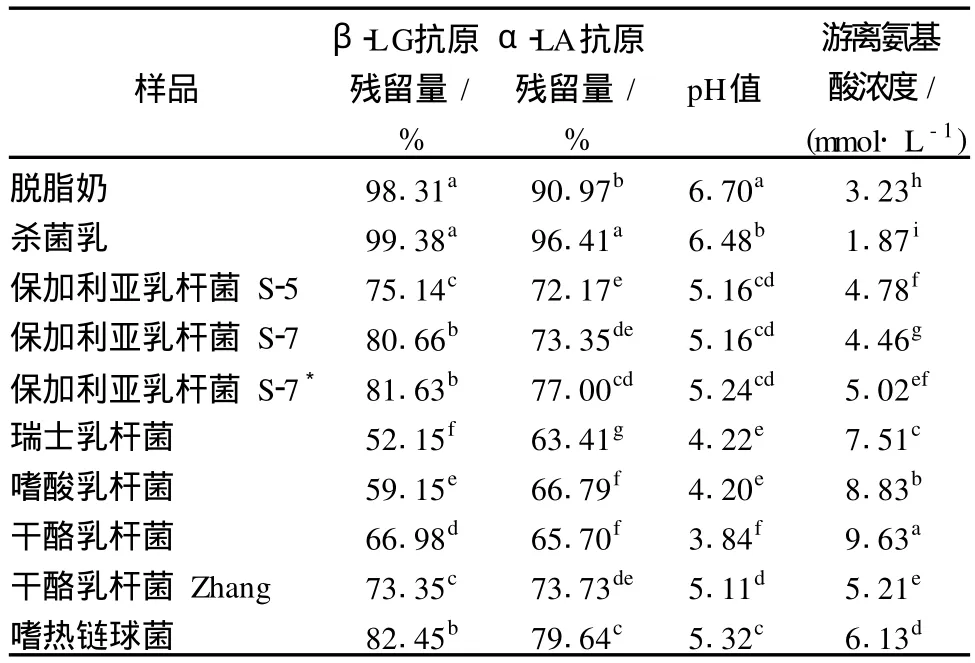
表1 脱脂乳经不同乳酸菌发酵 12 h后β-LG和α-LA抗原性、pH值、游离氨基酸浓度
另外,从表 1可知,瑞士乳杆菌、干酪乳杆菌、嗜酸乳杆菌发酵乳的 pH较低,游离氨基酸浓度较高,对应发酵乳中β-LG和α-LA的抗原性低;而嗜热链球菌发酵乳的 pH较高,游离氨基酸浓度较低,其β-LG和α-LA的抗原性比较高。这或许说明发酵乳的酸度、游离氨基酸含量及蛋白抗原性 3者之间存在一定的关联性。
2.2 发酵时间对发酵乳中乳清蛋白抗原性的影响
选取保加利亚乳杆菌、嗜热链球菌、瑞士乳杆菌及杆菌与球菌以 1∶1比例复合菌株对脱脂乳进行发酵,于不同发酵时间取样,测定发酵样品中 pH值、游离氨基酸浓度及β-LG和α-LA的抗原性。
乳酸菌在乳中生长时将乳糖转化为乳酸使酸度上升,pH值下降。从图 1可知,发酵前 12 h,发酵乳的 pH值下降很快,如瑞士乳杆菌和嗜热链球菌复合菌发酵 12 h后,pH由 6.55下降至 3.78;继续发酵pH值下降变化缓慢。
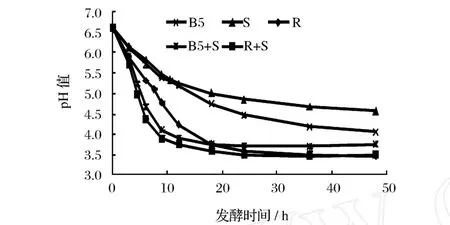
图1 发酵时间对不同乳酸菌发酵乳中 pH的影响
发酵乳中游离氨基酸的浓度反映了在一定条件下菌体蛋白酶活力的强弱,即菌体水解乳蛋白能力的大小。从图 2可知,发酵 0~12 h,发酵乳中游离氨基酸浓度大幅提高,特别是瑞士乳杆菌的蛋白酶水解活力较高,发酵 12h时游离氨基酸浓度达到 8.84 mmol/L,可能此阶段乳酸菌数量增长快,活力高,产生了较多的蛋白酶来水解乳蛋白[13];继续发酵,除保加利亚乳杆菌发酵乳中游离氨基酸含量仍逐渐增加外,其它菌株及复合菌变化不大。目前关于乳酸菌降低乳致敏性机理,被广为接受的理论有 2个:一是乳酸菌可产生 I型及 II型干酪素,通过免疫调节机制防止过敏;另一种,可能是乳酸菌在发酵过程中产生了水解乳蛋白的蛋白酶,进而水解乳蛋白造成[15]。

图2 发酵时间对不同乳酸菌发酵乳中游离氨基酸浓度的影响
图3和图 4分别是不同乳酸菌发酵乳中β-LG和α-LA抗原性随发酵时间的变化规律。可以看出,β-LG、α-LA抗原性变化和菌体发酵过程是密切相关的。发酵 3~12 h,脱脂乳中β-LG和α-LA的抗原性迅速下降,下降速度快慢依次为瑞士乳杆菌 >保加利亚乳杆菌 >嗜热链球菌,保加利亚乳杆菌发酵脱脂乳12 h后,其β-LG抗原残留量由 99.85%下降至71.68%,α-LA抗原残留量由 96.35%下降至72.78%。此阶段发酵乳中的游离氨基酸含量也在大幅提高,说明β-LG和α-LA抗原性的显著下降与乳酸菌产生的蛋白酶水解其抗原表位有关。据报道,不同乳酸菌菌种产生的蛋白酶具有特异性,杆菌对乳蛋白的肽链内切酶活性要远高于球菌,而嗜热链球菌仅有有限的蛋白水解酶活性[16-18]。从图 3和图 4也可以看出,复合菌株发酵乳中乳清蛋白的抗原性下降速度更快,脱脂乳发酵6h后,瑞士乳杆菌中β-LG和α-LA抗原残留量为 90.77%和 80.90%,嗜热链球菌中β-LG和 α-LA抗原残留量则为 99.68%和95.78%,而瑞士乳杆菌和嗜热链球菌复合菌中β-LG和α-LA抗原残留量仅为 59.64%和 66.95%,说明复合菌株发酵对降低乳清蛋白抗原性具有协同效果,这与 Kleber的研究结果相一致[6]。
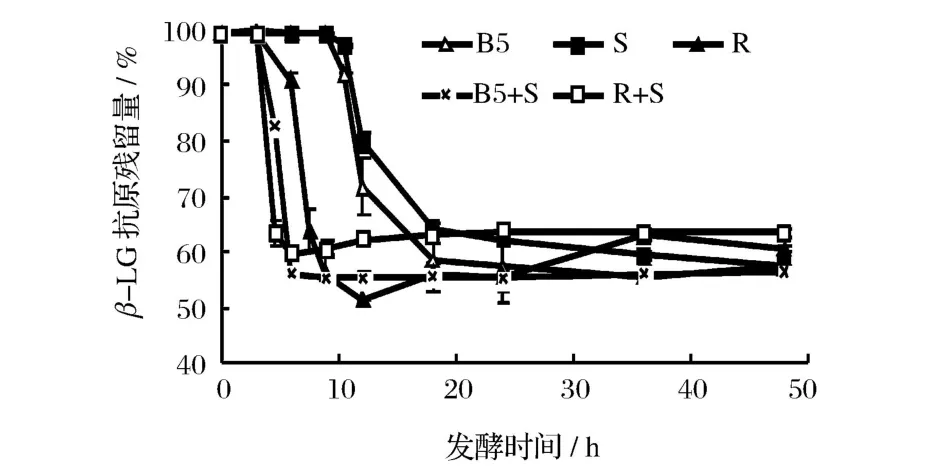
图3 发酵时间对不同乳酸菌发酵乳中β-乳球蛋白抗原性的影响
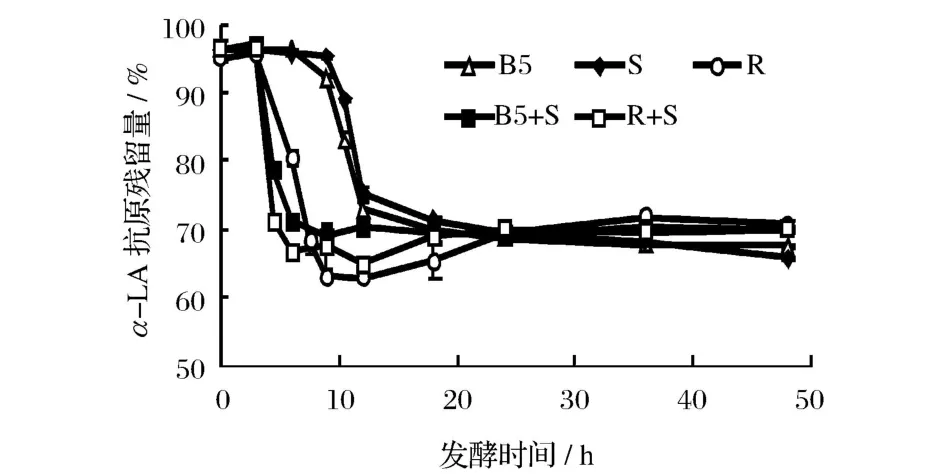
图4 发酵时间对不同乳酸菌发酵乳中α-乳白蛋白抗原性的影响
继续发酵至 48 h,发酵乳中乳清蛋白抗原性变化减缓,其中保加利亚乳杆菌和嗜热链球菌发酵乳的抗原性继续缓慢下降,可能是菌体产生的蛋白酶继续酶解所致;而瑞士乳杆菌及其复合菌发酵乳抗原性则缓慢升高,则可能是因为乳清蛋白经蛋白酶水解为大肽后,菌株产生的肽酶又将大肽进一步水解,产生了更小的肽段和氨基酸,导致一些隐性表位或线性表位的暴露。这种差异与不同乳酸菌产生的蛋白酶具有特异性有一定关系[19-20]。
另外,图 3和图 4表明,各乳酸菌发酵对于β-LG和α-LA抗原性影响呈正相关,并且β-LG的抗原性较α-LA降低效果更好。可能是由于发酵前剧烈的热处理使β-LG变性程度较大,空间结构充分展开,更易于蛋白酶的水解[7,17]。
2.3 冷藏时间对发酵乳中乳清蛋白抗原性的影响
脱脂乳经瑞士乳杆菌发酵凝乳后,放入 4℃冷藏,于不同冷藏时间取样进行测定。图 5显示的是冷藏不同时间后瑞士乳杆菌发酵乳中β-LG和α-LA抗原性的变化情况。随冷藏时间延长,发酵乳的α-LA的抗原性缓慢下降,与冷藏前相比,冷藏 7 d后α-LA抗原性下降 5%左右,但β-LG抗原性的变化不显著。从图 6可以看到,在冷藏期间,瑞士乳杆菌发酵乳的pH仍在缓慢下降,游离氨基酸浓度仍在缓慢升高,说明虽然冷藏期间乳酸菌生长和代谢变得缓慢,但乳酸菌产生的蛋白酶仍在水解蛋白质,只是可能由于温度低、pH不适宜等因素造成蛋白水解酶活力下降,从而导致发酵乳中β-LG和α-LA抗原性变化幅度不大。
3 结论
脱脂乳经保加利亚乳杆菌、瑞士乳杆菌、干酪乳杆菌、嗜酸乳杆菌、嗜热链球菌发酵 12 h后,其β-LG和α-LA的抗原性均出现不同程度的降低,不同菌株间差异显著,以瑞士乳杆菌效果为最佳。

图5 瑞士乳杆菌发酵乳 4℃冷藏下β-LG和α-LA抗原性随冷藏时间的变化
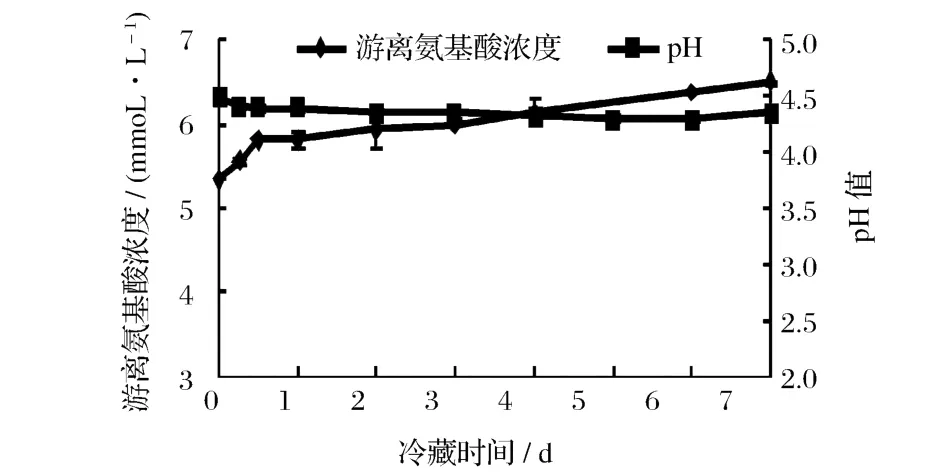
图6 瑞士乳杆菌发酵乳 4℃冷藏下游离氨基酸浓度和 pH随冷藏时间的变化
随发酵时间延长,发酵乳中β-LG和α-LA的抗原性均先迅速下降后变化缓慢,抗原性下降速度依次为:瑞士乳杆菌 >保加利亚乳杆菌 >嗜热链球菌,复合菌株发酵对降低β-LG和α-LA的抗原性具有协同作用;但继续发酵至 48 h,发酵乳中蛋白抗原性变化缓慢,变化趋势具有菌种特异性。瑞士乳杆菌发酵乳在 4℃冷藏 7d后,与冷藏前相比,α-LA的抗原性下降 5%左右,但β-LG的抗原性无显著变化。
发酵乳中β-LG、α-LA抗原性变化和菌体发酵过程密切相关,乳酸菌产生的蛋白水解酶对降低乳清蛋白抗原性起着重要的作用。但发酵乳作为一个非常复杂的体系,其β-LG和α-LA抗原性的变化可能受多种因素的影响,发酵前热处理温度、发酵过程中生成的乳酸和牛乳体系中酪蛋白等对β-LG和α-LA抗原性的影响都有待进一步研究。
[1]Wal J M.Cow’s milk allergens[J].Allergy,1998,53:1013-1022.
[2]Salminen S,Ouwehand A C,Solauri E.Clinical applicationsof probiotic bacteria[J].InternationalDairyJournal,1998,8:563-72.
[3]Macfarlane G T,Cummings J H.Probiotics and prebiotics:can regulating the activities of intestinal bacteria benefit health?[J].British Medical Journal,1999,318:999-1003.
[4]Majamaa H,Isolauri E.Probiotics:A novel approach in themanagementof food allergy[J].JournalofAllergy and ClinicalImmunology,1997,99(2):179-185.
[5]Lucjan J,BarbraW.Reduction of the antigenicity ofwhey proteins by lactic acid bacteria fer mentation[J].Food and AgriculturalImmunology,1999,11:91-99.
[6]Kleber N,Weyrich U,Hinrichs J.Screening for lactic acid bacteria with potential to reduce antigenic response of β-lactoglobulin in bovine skim milk and sweet whey[J].InnovativeFood Science and Emerging Technologies,2006,7:233-238.
[7]Maier I,OkunV M,Pittne F,et al.Changes in peptic digestibility of bovineβ-lactoglobulin as a result of food processing studied by capillary electrophoresis andimmunochemicalmethods[J].Journal of ChromatographyB:Analytical Technologies in the Biomedical and Life Sciences,2006,41(8):160-167.
[8]EhnB M,Allmere T,Telemo E.Modification of IgEBinding toβ-Lactoglobulin by fer mentation and proteolysis of cow’smilk[J].Journal of Agricultural and Food Chemistry,2005,53(9):3743-3748.
[9]李平兰,贺稚非主编.食品微生物学实验原理与技术[M].北京:中国农业出版社,2005:238.
[10]Nissen J N.Deter mination of the degree of hydrolysis of food protein hydrolysis by trinitrobenzenesulfonic acid[J].Journal ofAgricultural and Food Chemistry,1979,27(6):1256-1263.
[11]沈小琴,郑海,罗永康,等.酶解对乳清蛋白抗原性影响的研究[J].中国乳品工业,2006,34(6):12-15.
[12]KleberN,Hinrichs J.Antigenic response ofβ-lactoglobulin in thermally treated bovine skim milk and s weetwhey[J].Milchwissenschaft,2007,62:121-124.
[13]吕加平,骆承庠,刘凤民.乳酸菌蛋白水解力的测定及研究[J].东北农业大学学报,1999,30(1):68-74.
[14]郭鸽,任大喜,张英华,等.发酵生产低致敏乳源蛋白基料的研究[J].食品与发酵工业,2007,33(10):81-84.
[15]CrossM L,Stevenson L M,Gill H S.Anti-allergy properties of fermented foods:an importantimmunoregulatory mechanis m of lactic acid bacteria?[J].InternationalImmunopharmacology,2001,1:891-90.
[16]Tzvetkova I,DalgalarrondoM,Danova S,et al.Hydrolysis ofmajor proteins by lactic acid bacteria from Bulgarian yogurts[J].Journal of Food Biochemistry,2007,31:680-702.
[17]Bertrand H C,Ivanova IV,DalgalarrondoM,et al.Evolution ofβ-lactoglobulin andα-lactalbumin content during yoghurt fer mentation[J].International Dairy Journal,2003,13:39-45.
[18]Rapp M.On the ability of lactic acid bacteria to degrade proteins[J].Milchwissenschaft,1969,24:208-211.
[19]Hromraksa P P,Nagano H,Boonmars T.Identification of proteolytic bacteria from Thai traditional fermented foods and their allergenic reducing potentials[J].Journal of Food Science,2008,4(73):189-195.
[20]Matar C,AmiotJ,SavoieL,et a1.The effectofmilk fermentation byLactobacillus helveticuson the release of peptides duringin vitrodigestion[J].Journal of Dairy Science,1996,79(6):971-979.
ABSTRACTIn this study,skim milk was fermented with eight lactic acid bacteria and the residual antigenicity of β-lactoglobulin(β-LG)andα-lactalbumin(α-LA)was determined bymeansof indirect competitive EL ISA at different fer mentation and storage time.The results showed that lactic acid bacteria fer mentation can reduce antigenicity of β-LG andα-LA significantly.Fermenting for 3-12h,antigenicity ofβ-LG andα-LA decreased rapidly and the descending speed was Lactobacillus helveticus>Lactobacillus bulgaricus>Streptococcus ther mophilus;Multi-bacteria fer mentation had collaborative effect.However,antigenicity changed slowly with further fer menting.Compared with pre-refrigeration,theα-LA antigenicity in Lactobacillus helveticus fer mented milk decreased by 5%after storage at 4℃ for 7d,while no significant variationswere found inβ-LG.
Key wordsantigenicity,fer mentation,lactic acid bacteria,β-lactoglobulin,α-lactalbumin
Research on the Antigen icity ofβ-LG andα-LA in the Process of Sk im Milk Fermentation
Zhang Ying1,Bu Guan-hao1,2,Zheng Zhe1,Luo Yong-kang1
1(College of Food Science and Nutritional Engineering,China AgriculturalUniversity,Beijing 100083,China)
2(College of Cereal and Food Science,Henan University of Technology,Zhengzhou 450052,China)
硕士研究生(罗永康教授为通讯作者)。
*国家自然科学基金项目(30871817,30471224)
2010-04-01

