主动脉夹层及壁内血肿的MSCT诊断
钱林清,周建春
(1.苏州市吴中人民医院放射科,江苏 苏州 215128;2.苏州大学附属第一人民医院影像中心,江苏 苏州 215002)
主动脉夹层(Aortic dissection,AD)是累及主动脉最常见的急性病症,而主动脉壁内血肿 (Aortic intramural hematoma,AIH)是一种不典型主动脉夹层,可继续发展成为主动脉夹层或自行吸收,被认为是一种变异的AD及AD的早期阶段,与AD相似,也有很高的危险性和致死率[1],两者的病理及典型影像表现不同,临床症状及间接征象相似。本文旨在探讨两者MSCT表现的异同点,浅析两者的鉴别诊断,以提高对上述疾病的认识及诊断水平。
1 材料和方法
1.1 一般资料
收集苏州大学附属第一医院2005年6月~2009年8月经MSCT确诊的AD 43例及AIH 7例,其中男44例,女6例,AD患者年龄21~76岁,<60岁29例,有2例仅21岁,AIH病例均超过60岁。全部病例均有急性胸背部疼痛病史,呈刀割样或撕裂样剧痛,伴有上腹痛18例,10例触及上腹部搏动性包块。
1.2 检查方法
采用西门子Sensation 64层螺旋CT扫描机,扫描参数120kV,200mAs,准直 0.6mm,螺距 0.7,层厚 5mm,使用高压注射器经肘静脉以3.5~4ml/s的速度注入非离子造影剂优维显(300mgI/ml)100ml,采用团注追踪扫描技术,扫描范围自主动脉弓上2~3cm至髂总动脉分叉以下3cm处。扫描结束后将重建图像数据传至工作站进行图像后处理,采用冠状位、矢状位多平面重建(MPR)及容积再现技术(VR)。
2 结果
根据Stanford分型,本组AD病例A型11例,B型32例,AIH病例A型1例,B型6例。
AD的MSCT表现:全部病例均显示真假双腔、内膜片,41例显示内膜破口(图1);内膜钙化斑块内移16例;假腔附壁血栓12例;25例AD主动脉重要分支受累,共累及46支血管,其中髂总动脉18支,头臂干7支,左锁骨下动脉4支,左颈总动脉3支,腹腔干5支,肠系膜上动脉4支,肾动脉5支,3例Ⅰ型AD主动脉弓3大分支及双侧髂总动脉全部累及;重要脏器动脉起自假腔8例,单侧肾动脉起自假腔6例(左侧5例,右侧1例),其中2例合并腹腔干起自假腔,1例仅腹腔干起自假腔,1例右侧髂总动脉由假腔分出,增强动脉期CT值较对侧低30HU,静脉期CT值相仿;胸腔积液22例(10例为双侧胸腔积液,12例为左侧胸腔积液);心包积液6例。
AIH的MSCT表现:全部病例均表现为主动脉壁新月形或环形增厚,其中5例表现为环形增厚,假腔包绕真腔1/2~3/4,2例为环形增厚,增厚范围在5.8~16.3mm;血肿CT值45~71HU,平扫呈等密度3例,高密度4例,增强后7例均显示散在的点状渗漏,5例显示穿透性溃疡(图2)。全部病例均在20天后复查,3例显示血肿厚度变小,2例溃疡变小 (图3~5);4例血肿无明显变化,但其中1例溃疡增大,呈动脉瘤样扩张,1例出现内膜片。胸腔积液4例(双侧2例,左侧2例),内膜钙化内移2例,均为多发点状钙化,内移距离6.4~9.6mm。
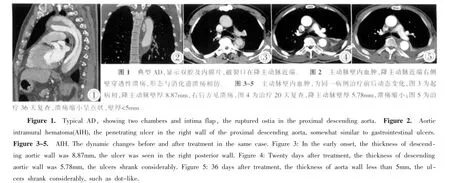

表1 主动脉夹层与壁内血肿其他影像表现
3 讨论
主动脉夹层是由于各种原因导致主动脉内膜破裂,血液进入内膜下之中膜,导致中膜破裂、剥脱形成管套[2]。主动脉壁内血肿是指主动脉内膜破溃或溃疡、血液在主动脉中层形成血肿;另一种情况是主动脉中层或外膜滋养血管破裂出血而形成壁内血肿[3]。
目前AD主要分型有2种,一种是Stanford分型:A型包括累及升主动脉的AD,B型指夹层只累及降主动脉;另一种是Debakey分型,将主动脉夹层分为3型,即将Stanford A型分为Ⅰ型和Ⅱ型,Ⅰ型内膜撕裂口在升主动脉,夹层累及升主动脉、主动脉弓及降主动脉,Ⅱ型内膜撕裂口位于升主动脉,夹层仅累及升主动脉,Ⅲ型即Stanford B型;AIH也参照上述分型[4]。由于Stanford分型简洁明了,而且A、B两型治疗方式不同,所以Stanford分型逐渐被影像学及临床医生所接受。本组资料采用Stanford分型。
典型的AD为主动脉壁内膜撕裂,血流通过裂口进入管壁中膜,沿主动脉长轴方向扩展形成一管腔,真假腔之间为内膜片,真假腔和内膜片是诊断主动脉夹层的直接征象。国内对AD研究很多,多数文献报道AD真假腔和内膜片显示率均为100%,在内膜破口显示率方面,各文献的统计有所差异[5-7];本组资料真假腔及内膜片均显示,横轴位结合MPR重建,共有41例显示内膜破口,且28例显示2个及以上破口,破口大小在0.25~3.1cm之间。
AIH被认为是一种不典型AD,是因为主动脉内膜破溃或溃疡,血液进入主动脉壁中层形成血肿,无内膜破裂,近端、远端均与主动脉无沟通。AIH直接征象是主动脉壁新月形或环形增厚≥5mm。CT平扫主动脉壁内血肿密度可为高密度、等密度或低密度,本组资料高密度4例,等密度3例,增强扫描血肿均无强化,表现为新月形或环形低密度,轴位上病变环绕管腔半周至全周,纵向范围内从局限至累及全程。增强后的另一表现是内膜渗漏及穿透性溃疡,本组7例增强后均显示散在的点状渗漏,5例显示穿透性溃疡表现,呈现“狭颈征”。有文献报道[8],穿透性粥样硬化性主动脉溃疡(PAU)都合并AIH。PAU是始于动脉粥样硬化斑块的溃疡,穿透内膜,进而可形成中膜壁内血肿,可继发形成AD,尤其是B型和血栓化AD[9];伴随PAU产生的AIH,由于动脉粥样硬化的存在,多为局限性,广泛纵形扩展者少见。不伴有PAU的AIH多较稳定,有PAU的则容易进展,因此对后者一定要随访观察,当患者出现疼痛加重、血流动力学不稳定及主动脉管径迅速扩大及有破裂倾向时,应及早手术或介入治疗[9]。本组资料中,1例复查时发现溃疡增大,呈动脉瘤样扩张;另1例则出现内膜片,形成真假双腔,转变成AD,该2例随即进行腔内隔绝治疗。
AD与AIH的其它影像表现及鉴别诊断:AD与AIH其它影像表现情况见表1。典型AD与AIH鉴别不难,当AD内膜破口封闭,假腔血栓机化形成慢性血肿时,鉴别诊断就会遇到困难。笔者就本组资料,对两者的鉴别诊断,总结如下:①发病年龄不同,本组AD患者年龄<60岁的有29例,有2例仅21岁,平均年龄51.9岁;AIH全部病例均>60岁,平均年龄69.3岁;②平扫CT值不同,本组资料12例假腔内血栓CT值在18~30HU,呈低密度,而AIH平扫CT值45~71HU,呈高密度或等密度;增强后两者均为低密度,鉴别意义不大;③病变发生范围不同,43例AD中有19例夹层延伸至腹主动脉分叉,6例至肾动脉水平,4例至腹腔干分叉,仅1例局限在降主动脉;而7例AIH中3例局限在降主动脉,3例至腹腔干分叉,A型仅1例;④动态观察,AIH短期复查,血肿可有变化,本组中3例20天后复查,血肿厚度变薄,而AD很难吸收。⑤本组AIH无累及分支血管及脏器血管起自假腔,AD则较为常见。
AD与AIH均为急性主动脉综合症,及时的正确诊断是治疗的关键。MSCT是一种快速、无创的检查方法,能够清晰显示AD和AIH的直接、间接征象,鉴别AD与AIH,为临床医生制定合理的治疗方案提供重要信息。MSCT可作为AD和AIH的首选及随访的检查方法。
]
[1]Nienber CA,Sievers HH.Intramural hematoma in acute aortic syndrome more than one variant of dissection?[J].Circulation,2002,106:284.
[2]李松年.现代全身CT诊断学[M].北京:中国医药科技出版社,2002.554-555.
[3]戴如平.心血管病CT诊断学[M].北京:人民卫生出版社,2000.158.
[4]Castaner E,Andreu M,Gallardo X,et al.CT in nontraumatic acute thoracic aortic disease:typical features and complications[J].Radiographics,2003,23:S93-S110.
[5]郑海军,罗学军,周海军,等.16层CT血管造影对主动脉夹层的诊断价值[J]. 实用放射学杂志,2008,24(6):756-758.
[6]高红,徐文坚,郝大鹏,等.64层螺旋CT血管成像技术对主动脉夹层的显示能力[J]. 中国医学影像技术,2007,23(7):1012-1015.
[7]姚凤明,董海波,王波,等.多层螺旋CT血管成像技术诊断主动脉夹层动脉瘤的临床价值 [J].医学影像学杂志,2007,17(5):526-528.
[8]郑秀敏,孙立军,葛雅丽,等.主动脉壁内血肿——一种不典型夹层的电子束CT诊断 [J].中国临床医学影像杂志,2003,14(3):173-176.
[9]Hayashi H, Matsuoka Y, Sakamoto I, et al. Penetrating atherosclerotic ulcer of the aorta;imaging and disease concept[J].RadioGraphics,2000,20:995-1005.

