常规实验操作对Wistar大鼠的影响
吴剑平,杨斐,胡樱
(复旦大学实验动物科学部,上海 200032)
研究报告
常规实验操作对Wistar大鼠的影响
吴剑平,杨斐,胡樱
(复旦大学实验动物科学部,上海 200032)
目的常规实验操作对W istar大鼠的影响。方法采用W istar大鼠,分别进行腹腔注射、肌内注射、灌胃、尾静脉切割采血、剪尾采血和固定操作,连续处理7 d后,测定各组大鼠神经内分泌、免疫、血液系统主要指标及肝脏hsp72 mRNA表达量,并与对照组比较,分析这些操作的影响。结果与对照组相比,腹腔注射组、肌内注射组和灌胃组的皮质酮(CORT)、γ-干扰素(IFN-γ)、γ-干扰素/白介素-4(IFN-γ/IL-4)比值极显著升高,白细胞总数(WBC)、中性粒细胞比例(WLCR)、C-反应蛋白(CRP)、β-内啡肽(β-EP)及白介素-2(IL-2)有不同程度的显著降低。与对照组相比,尾静脉切割采血组的CORT、IFN-γ、IFN-γ/IL-4比值极显著升高,WBC、β-EP有不同程度的显著降低;剪尾采血组的CORT、IFN-γ、IFN-γ/IL-4比值有不同程度的显著升高,β-EP、IL-2、CRP极显著降低;固定组的CORT、IFN-γ/IL-4比值、IL-2、CRP极显著升高,WBC、β-EP、IL-4有不同程度的显著降低。与对照组相比,所有实验操作均使热休克蛋白(HSP)hsp72 mRNA表达极显著升高。此外,与对照组相比,肌内注射组的红细胞数(RBC)和血红蛋白含量(HGB)显著升高,尾静脉切割和剪尾采血组的HGB和红细胞压积(HCT)极显著降低,固定组的RBC、HGB和HCT均极显著升高。结论本研究中涉及的常规实验操作均引起了大鼠极显著的应激反应,并造成了大鼠神经内分泌系统的紊乱及免疫功能的抑制,从而对动物造成了恶性应激。同时这些操作可能会对涉及的神经内分泌及血液学指标的相关研究产生背景性干扰。
W istar大鼠;常规实验操作;神经内分泌;免疫;背景性干扰
动物实验中,经常要对动物进行各种常规实验操作(如给药、采血等)。这些常规实验操作对动物来说也是一种应激[1],因此可能会对动物的健康和福利产生不利影响,甚至会干扰科学研究的结果。Gartner等[2]的研究证明仅在实验室里对大鼠进行短距离的搬动即会造成其心率、皮质酮等多项指标的显著变化。我们之前的实验也曾研究证明短途运输会显著影响大鼠的代谢、神经内分泌及免疫功能[3]。可见实验动物很容易受到各种常规实验处理的影响,导致其生理平衡的紊乱。因此,确切地评价常规实验操作对动物的影响是很有必要的。但在国内外,有关各种具体实验操作对动物的影响研究仍然较少见。根据这一情况,本实验选取给药、采血和固定这几种动物实验中最常用到的操作,观察这些操作本身对W istar大鼠神经内分泌、免疫及血液学主要指标的影响,并分析这些指标的变化对大鼠的影响及对动物实验研究可能会造成的背景性干扰。
1 材料和方法
1.1 实验动物
清洁级近交系雄性W istar大鼠80只,体质量(200±10)g,由中国科学院上海实验动物中心提供[SCXK(沪)2007-0005]。
1.2 仪器设备
Bio-Tek Elx800 USA酶标仪(美国),pocH-100iv Diff全自动动物血液分析仪(日本),ABI7300荧光定量PCR仪(美国)。
1.3 主要试剂
大鼠血清皮质酮(CORT)、β-内啡肽(β-EP)、C-反应蛋白(CRP)、γ-干扰素(IFN-γ)、白介素-2(IL-2)、白介素-4(IL-4)测定试剂盒为美国RB公司产品。M-MLV、M-MLV 5×reaction buffer,Recombinant RNAsin系Promega公司产品。dNTPmix,FQ-PCR Premix Kit为Transhold公司产品。Trizol试剂、Oligo dT18和引物为Invitrogen公司产品。各引物5'-3'的序列分别为:
hsp72(上游):5′-TTTCTGGCTCTCAGGGTGTT-3′;
hsp72(下游):5′-CTGTACACAGGGTGGCAGTG-3′;
β-actin(上游):5′-CCTCTATGCCAACACAGT-3′;
β-actin(下游):5′-AGCCACCAATCCACACAG-3′。
1.4 饲养条件
W istar大鼠饲养在我部屏障环境[SYXK(沪) 2007-0002]中,根据国标GB14925-2001的要求,控制有关环境参数,并先给予3d的健康适应期,自由饮食。
1.5 分组处理与指标测定
1.5.1 实验A:测定三种给药方式对大鼠的影响,共分4组,即A1组、A2组、A3组和AC组,每组10只动物。具体实验处理如下:①A1组:腹腔注射生理盐水,2次/日,每次1 m L,操作时间分别为am 9:00~10:00,pm15:00~16:00。②A2组:肌内注射生理盐水,2次/日,每次0.02 m L,处理时间同A1组。③A3组:生理盐水灌胃,2次/日,每次1 m L,处理时间同A1组。④AC组:为空白对照,常规饲养,不予任何实验处理。所有实验组非实验处理时间的饲养管理与对照组一致。各实验组均连续处理7d。对照组和所有实验组最后一次实验处理结束后15 m in,从尾静脉切割采血,用于血常规的测定,从心脏采血用于激素、免疫因子和CRP的测定。之后动物颈椎脱臼处死,并采集肝脏组织用于hsp72转录水平的测定。指标测定方法:外周血血常规由自动血球仪测定,激素、免疫因子及CRP的测定均采用ELISA法。hsp72转录水平的测定采用实时荧光定量PCR法,以RATβ-actin为内参,采用2-ΔΔct法对hsp72表达相对定量。
1.5.2 实验B:测定两种采血和固定操作对大鼠的影响,共分4组,即B1组、B2组、B3组和BC组,每组10只动物。具体实验处理如下:①B1组:第1天处理从距大鼠尾尖3 cm左右的一侧尾静脉做一小切口,采血40 μL,用无菌干棉球轻微按压止血。以后1次/日,后1 d采血部位选择大鼠另一侧尾静脉,切口从尾尖到尾根逐次向上,相邻切口间隔2 mm左右,采血量均为40 μL。每天处理时间均为am9:00~10:00。②B2组:剪尾采血,从大鼠尾尖到尾根部逐次向上,每次剪去大鼠尾尖2 mm左右,采血量均为40 μL,1次/日,处理时间同B1组。③B3组:将大鼠固定在常规大鼠固定器中,每次固定15min,2次/日,处理时间分别为am9:00~10:00,pm15:00~16:00。④BC组:为空白对照,常规饲养,不予任何实验处理。所有实验组非处理时间的饲养管理与对照组一致。各实验组均连续处理7d,采样和各指标测定同实验A。
1.6 统计学处理
结果以均值±标准差表示,应用STATA软件进行统计分析,采用one way ANOVA和Bonferroni法检验组间差异,检验水准α=0.05,α=0.01。
2 结果
2.1 实验A结果
2.1.1 各组血常规指标测定结果:见表1。WBC测定显示,与AC组相比,A1、A3组均显著降低(P<0.05),A2组极显著降低(P<0.01);RBC测定显示,与AC组相比,A2组有显著性升高(P<0.05); HGB测定显示,与AC组相比,A2组有显著性升高(P<0.05);WSCR测定显示,与AC组相比,A1组极显著升高(P<0.01),A2组有显著性升高(P<0.05);WLCR测定显示,与AC组相比,各实验组均有显著性降低(P<0.01)。
2.1.2 各组β-EP、CORT、IFN-γ、IL-4、IL-2、IFN-γ/ IL-4及CRP的测定结果:见表2。CORT测定显示,与AC组相比,A1组和A3组均极显著升高(P<0.01),A2组有显著性升高(P<0.05);IFN-γ和IFN-γ/IL-4测定显示,与AC组相比,各实验组均极显著升高(P<0.01);β-EP、IL-2和CRP测定显示,与AC组相比,各实验组均降低且差异有显著性(P<0.01)。
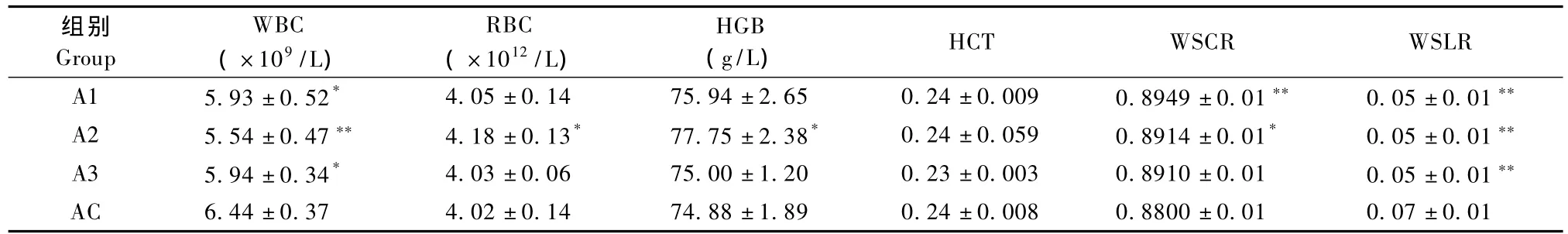
表1 各组血常规的测定结果(n=10)Tab.1 Results of routine blood tests(n=10)

表2 各组CORT、β-EP、IFN-γ、IL-4、IL-2、IFN-γ/IL-4及CRP的测定结果(n=10)Tab.2 Results of measurements of CORT,β-EP,IFN-γ,IL-4,IL-2,IFN-γ/IL-4 and CRP(n=10)
2.1.3 各组hsp72 mRNA表达的测定结果:见图1。各实验组hsp72 mRNA的表达量经β-actin校正后,均用相对于对照组的倍数值表示。如图1所示,与AC组相比,各实验组大鼠肝脏的hsp72 mRNA表达均有显著性升高(P<0.01)。
2.2 实验B结果
2.2.1 各组血常规指标测定结果:见表3。WBC测定显示,与BC组相比,B1、B3组均降低且差异有显著性(P<0.01);RBC的测定显示,与BC组相比,B3组升高且差异有显著性(P<0.01);HGB测定显示,与BC组相比,B1、B2组均降低,B3组升高,差异均有显著性(P<0.01);HCT测定显示,与BC组相比,B1、B2组均降低,B3组升高,差异均有显著性(P<0.01);WSCR测定显示,与BC组相比,B1组有显著性降低(P<0.05),B2组有极显著性降低(P<0.01);WLCR测定显示,与BC组相比,B2组有显著性升高(P<0.05)。

注:与AC组比较,**P<0.01。图1实验A hsp72mRNA相对表达量测定结果Note:compared with group AC,**P<0.01Fig.1 Experiment A,the results of measurements of the relative hsp72 mRNA expression
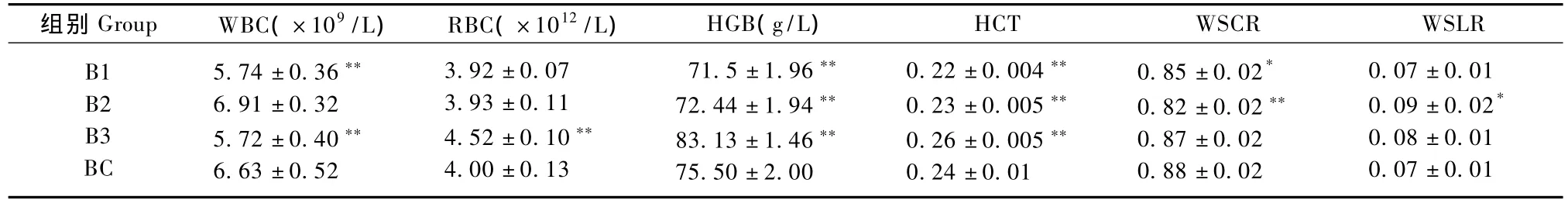
表3 各组血常规的测定结果(n=10)Tab.3 Measurements of routine blood tests in the rats(n=10)
2.2.2 各组CORT、β-EP、IFN-γ、IL-4、IL-2、IFN-γ/ IL-4及CRP的测定结果:见表4。CORT测定显示,与BC相比,B1、B2和B3组均极显著升高(P<0.01);β-EP测定显示,与BC组相比,B1、B2组均有显著性降低(P<0.05),B3组极显著降低(P<0.01);IFN-γ测定显示,与BC组相比,B1、B2组均极显著升高(P<0.01);IL-4测定显示,与BC组相比,B3组降低且差异有显著性(P<0.05);IFN-γ/ IL-4比值测定显示,与BC组相比,B1、B2和B3组均有显著性升高(P<0.01);IL-2测定显示,与BC组相比,B2组降低,B3组升高,差异均有显著性(P<0.01);CRP测定显示,与BC组相比,B2组降低,B3组升高,差异均有显著性(P<0.01)。

表4 各组CORT、β-EP、IFN-γ、IL-4、IL-2、IFN-γ/IL-4及CRP的测定结果(n=10)Tab.4 Results of measurements of CORT,β-EP,IFN-γ,IL-4,IL-2,IFN-γ/IL-4 and CRP(n=10)
2.2.3 各组hsp72mRNA表达的测定结果:见图2。
各实验组hsp72 mRNA的表达量经β-actin校正后,均用相对于对照组的倍数值表示。如图2所示,相对BC组各实验组大鼠肝脏的hsp72 mRNA表达均有显著性升高(P<0.01)。
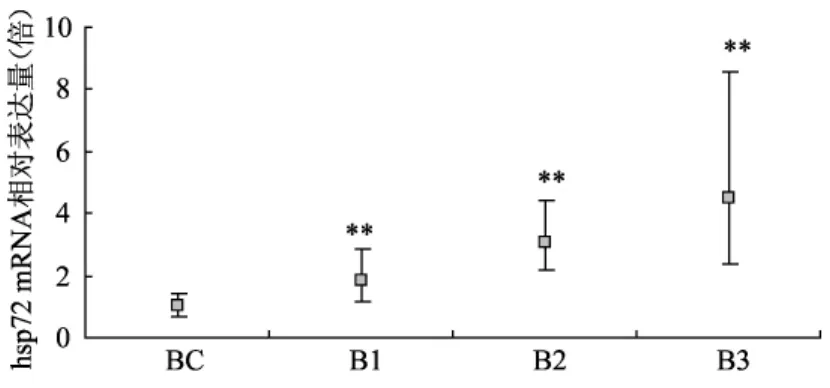
注:与BC组比较,**P<0.01。图2实验B hsp72 mRNA相对表达量测定结果Note:compared with group BC,**P<0.01Fig.2 Expermen B,the results of measurements of the relative hsp72 mRNA expression
3 讨论
给药、采血和固定操作对大鼠是一种身心复合应激,不仅会引起动物的疼痛或不适,还会造成动物心理上的紧张和反抗情绪。应激反应的基础是体内一系列神经内分泌免疫网络系统的相互作用。机体在应对应激时,会引起下丘脑-垂体-肾上腺皮质轴(HPA轴)的兴奋,使多种神经内分泌因子的水平发生变化,进而对机体的免疫、血液等其他各个系统的功能进行调节[4]。因此,本实验即从测定这些操作应激所造成的动物神经内分泌、免疫和血液系统主要指标的变化出发,探讨常规实验操作对大鼠的影响。
应激可诱导机体热休克蛋白(HSP)的大量表达,其中以HSP70家族最保守且最重要,其具有广泛的细胞保护、分子伴侣、免疫等生物学功能[5]。研究表明,HSP70家族中的hsp72在应激反应中可迅速诱导表达,对多种应激源的反应更敏感,其表达水平可反映机体应激反应的程度[6]。研究结果显示,各种操作均引起了大鼠hsp72的大量表达。表明这些操作对大鼠造成的应激强度均很大,使大鼠体内发生了极显著的应激反应,且hsp72的大量表达有助于大鼠应激损伤的修复。
糖皮质激素(GC)为HPA轴的终末效应激素,可反映HPA轴的激活程度。研究表明,急性应激会引起HPA的兴奋及GC水平的升高;而同种应激源的长时间反复应激后,机体HPA轴可出现适应性反应,再次应激时GC水平不再升高[7]。本研究中,连续7 d对大鼠进行常规实验操作后,各操作组大鼠的CORT仍明显升高。表明大鼠在短时间内并不能适应这些操作应激,HPA轴仍处于明显兴奋状态。应激时HPA轴的适度兴奋是维持机体稳态的必要条件,然而HPA轴的长时间过度兴奋尤其是糖皮质激素(GC)的大量分泌,则会导致机体内环境的紊乱及免疫功能的抑制等而损害机体的健康。β-EP为应激反应中重要的神经递质,对神经内分泌和免疫系统具有双重调节作用。通常在应激状态下,内源性阿片肽可抑制机体HPA轴功能,在控制应激激素分泌中起着“负调节作用”,由此来削弱由过度刺激引起的伤害性后果[8]。本研究中,各实验组大鼠β-EP水平较对照组均有不同程度的显著降低。提示这些操作应激造成了大鼠神经内分泌负反馈调节平衡的紊乱,推测这可能是HPA轴出现持续兴奋的重要原因之一。据报道,β-EP还具有促进IL-1、IL-2的表达等多种免疫功能,且是最有效的内源性镇痛物质之一[3]。因此,β-EP水平的降低可能会对大鼠的免疫功能产生不利影响,同时可能会导致大鼠对疼痛的耐受性下降而影响动物的福利水平。
外周血WBC、WSLR和WSCR可反映机体整体免疫功能状况和外周免疫监视能力。IL-2是介导T细胞活化增殖必需的细胞因子,并能增强NK和CTL细胞的活性等[9],因此常作为反映机体免疫功能的重要指标。本研究显示,腹腔注射、肌内注射和灌胃操作组大鼠的外周血WBC总数、WLCR及IL-2,以及尾静脉切割采血组的外周血WBC总数和WSCR、剪尾采血组的IL-2和WSCR、固定组的外周血WBC总数较对照组均有不同程度的显著降低。可见各种操作应激均已造成大鼠免疫功能不同程度的抑制。机体内IFN-γ和IL-4可分别诱导Th0向Th1和Th2分化,故其比值可反映Th1/Th2平衡的变化。Th1/Th2的平衡是维持机体正常免疫功能的必要条件[9]。本研究中,各操作组大鼠的IFN-γ/IL-4比值均出现明显降低。除固定组主要由IL-4水平的降低所致外,其他各实验组均由IFN-γ的显著升高所致。表明这些操作应激造成了大鼠Th1/Th2平衡的失调,出现Th1优势状态。大鼠免疫功能的抑制及Th1/Th2平衡的失调均会增加其对病原体及相关疾病的易感性。
本研究还观察了一种重要的急性期反应蛋白—CRP的水平。研究发现,固定组的CRP水平较对照组显著升高,而腹腔注射、肌内注射、灌胃和剪尾采血组CRP水平较对照组显著降低。这提示在不同的应激反应中CRP水平会有不同的变化,其变化的方向可能由不同应激源本身的性质所决定。相关资料报道,CRP为心血管疾病、糖尿病等的危险因子,其水平的升高会增加机体对这些疾病的易感性[11]。此外,CRP还具有重要的免疫功能,如激活补体、调理吞噬作用、促进细胞因子的表达等[12]。因此,其水平的降低可能也参与介导了大鼠免疫功能的抑制。
研究显示,肌内注射操作还引起了大鼠RBC和HGB的升高,固定操作组大鼠的RBC、HGB和HCT三项指标均升高,而两种采血操作却降低了大鼠HGB和HCT的水平。有关这几组大鼠血液学指标变化的原因尚不明确,其机制有待进一步研究。但在动物实验中,这些操作引起的大鼠血液学指标的变化,以及所有操作对大鼠神经内分泌及免疫学指标的影响,则均可能会对有关这些指标的实验研究产生背景性干扰,从而影响研究结果的可靠性。因此,研究者应考虑到各种常规操作对实验结果影响的可能性。为减少这种操作应激的背景性干扰,研究中可选择对动物影响相对较小的实验操作。如有关资料表明,剪尾采得的血液相对尾静脉切割更易出现溶血现象[13]。本研究中,剪尾采血对大鼠各项指标的影响也表现出更为显著的趋势,且剪尾本身对动物的福利损害相对也更明显。因此,动物实验中建议选择尾静脉切割采血作为获取大鼠微量血样的“优化”方法。
应激反应中,适度的良性应激有助于提高机体的抵抗力,但应激强度过大或恶性应激则会造成机体各系统功能的紊乱,使机体处于亚健康或亚病理状态。本研究揭示了常规实验操作对大鼠生理功能的影响,由于不同性质的应激源对机体作用机制的不同[14],因此各种操作应激对大鼠各系统指标的影响不完全一致,但总体上均对大鼠造成了强烈的应激,大鼠神经内分泌系统出现严重紊乱,免疫功能明显受抑,从而使大鼠的健康受到潜在威胁,表明这些操作均已对大鼠构成恶性应激。由此可见,常规实验操作对动物的影响值得关注,评价各种操作对动物的影响,将有助于在动物实验中控制这些操作应激对动物健康福利的损害,且有利于研究者更好地控制各项非实验因素对动物实验研究的干扰,提高研究结果的可靠性。
[1]Balcombe JP,Barnard ND,Sandusky C.Laboratory routines cause animal stress[J].Lab Animal Sci,2004,43(6):42-51.
[2]Gartner K,Buttner D,Dohler K,et al.Stress response of rats to handling and experimental procedure[J].Lab Animals,1980,14:267-274.
[3]杨斐,胡樱.短途运输应激对W istar大鼠的影响[J].中国实验动物学报,2009,17:38-43.
[4]金惠铭,王建枝.病理生理学[M].第六版.北京:人民卫生出版社,2004,144-151.
[5]林钟婷,朱静,翁银标,等.热休克蛋白70的研究进展[J].中国畜牧兽医,2007,34(3):67-70.
[6]Campisi J,Leem TH,Fleshner M,et al.Stress-induced extracellular Hsp72 is a functionally significant danger signal to the immune system[J].Cell Stress&Chaperones,2003,8(3): 272-286.
[7]Garca A,Mart O,Vallès A,et al.Recovery of the hypothalamicpituitary-adrenal response to stress[J].Neuroendocrinology. 2000,2:114–125.
[8]杜雨苍.神经肽与脑功能[M].上海:上海科技教育出版社,1998,151-171.
[9]光炎.免疫学原理[M].第一版.上海:上海科学技术出版社,2007,87.
[10]姚金晶,陈宜涛.Th1/Th2平衡调节与疾病发生的研究进展[J].现代生物医学进展,2009,9:2597-2600.
[11]王一丹,杨万松.CRP与代谢综合症[J].实用心脑肺血管病杂志,2007,15:482-485.
[12]Black S,Kushner I,Samols D.C-reactive protein[J].J Biol Chem.2004,279:48487-48490.
[13]Christensen SD,Mikkelsen LF,Fels JJ,et al.Quality of plasma sampled by different methods for multiple blood sampling in mice[J].Lab Anima,2009,43:65-71.
[14]Bowers SL,Bilbo SD,Dhabhar FS,et al.Stressor-specific alterations in corticosterone and immune responses in mice[J]. Brain Behav Immunity,2008,22:105-113.
Negative Im pact of Routine Experim ental Procedures on W istar Rats
WU Jian-ping,YANG Fei,HU Ying
(Department of Laboratory Animal Science,Fudan University,Shanghai 200032,China)
Objective To study the influence of routine experimental procedures on Wistar rats.M ethods Intraperitoneal injection(ip),intramuscular injections(im),intragastric injection(ig),blood sampling by tail vein incision(tv),blood sampling by tail tip cutting(tc)and restraint procedures were selected in this experiment.Each procedure was respectively done on W istar rats.After continuously hand led for seven days,the main neuroendocrine,immune and haematological indexes were measured to study the effects of these procedures on the rats.ResultsCompared with the control group,CORT,IFN-γ,IFN-γ/IL-4 were significantly increased and WBC,WLCR,CRP,β-EP,IL-2 were significantly decreased in the ip,im and ig groups.Compared with the control group,CORT,IFN-γ,IFN-γ/IL-4 were significantly increased and WBC,β-EP were significantly decreased in the tv group;CORT,IFN-γ,IFN-γ/IL-4 were significantly increased and β-EP,IL-2,CRP significantly decreased in the tc group;CORT,IFN-γ/IL-4,IL-2,CRP significantly increased,and WBC,β-EP,IL-4 significantly decreased in the restraint group.Hsp72 mRNA was significantly increased in all the experimental groups.Furthermore,compared with the control group,RBC and HGB were significantly increased in the im group,HGB and HCT significantly decreased in the tv and tc groups,RBC,and HGT and HCT significantly increased in the restraint group.ConlusionRoutine experimental procedures cause severely stress reactions,and lead to neuroendocrine dysfunction and immunosuppression in rats.It is of importance that those stress conditions may lead to considerable background-interference on some experimental neuroendocrine,immunological andhaematological researches.
W istar rat;Routine experimental procedures;Neuroendocrine;Immunity;Background-interference
Q-95
A
1005-4847(2010)04-0312-06
2009-11-18
上海市科技发展基金项目(编号:071409008)。
吴剑平(1986-),女,硕士研究生,研究方向:比较医学与实验动物应用。E-mail:w jp4411544@163.com
杨斐,男,副研究员,硕士生导师,主要从事实验动物学教学、科研和管理。E-mail:yfdwbfd@fudan.edu.cn

