短发夹状RNA基因沉默补体受体C5aR及抑制LPS诱导的肾脏上皮细胞凋亡①
陈 栋 张 艳李 明 尹注增 陈 刚 张伟杰 陈 实 (华中科技大学同济医学院附属同济医院器官移植研究所 教育部/卫生部器官移植重点实验室,武汉430030)
·移植免疫学·
短发夹状RNA基因沉默补体受体C5aR及抑制LPS诱导的肾脏上皮细胞凋亡①
陈 栋 张 艳②③李 明 尹注增 陈 刚 张伟杰 陈 实 (华中科技大学同济医学院附属同济医院器官移植研究所 教育部/卫生部器官移植重点实验室,武汉430030)
目的:探讨短发夹状RNA基因沉默补体受体C5aR及抑制LPS诱导的肾脏上皮细胞凋亡的作用效果。方法:构建针对大鼠补体受体C5aR基因编码区的短发夹状RNA(shRNA)真核表达载体质粒pRNAT-U6.1-C5aR shRNA,采用电穿孔的方法转染RK3E细胞,经G418筛选后,形成稳定的表达C5aR shRNA的细胞系。实验分为3组,①正常对照组:未转染的RK3E细胞;②阴性对照组:转染空载体pRNAT-U6.1的RK3E细胞系;③实验组:转染C5aR shRNA的RK3E细胞系。经脂多糖(LPS)孵育12小时后,流式细胞仪检测各组细胞凋亡率,RT-PCR检测mRNA的表达,γ计数仪测定125I标记的C5a与RK3E的结合情况。结果:与正常对照组和阴性对照组相比,实验组的细胞凋亡率显著降低(P<0.01),C5aR mRNA水平显著降低(P< 0.01),125I标记的C5a与RK3E结合活性显著下降。结论:针对C5aR的特异性短发夹RNA可以明显引起靶基因的沉默,进而抑制LPS诱导的肾脏上皮细胞凋亡的发生。
RNA干扰;C5aR;基因沉默;凋亡
肾脏上皮细胞凋亡是急性肾功能衰竭等病理生理过程的重要机制之一,细胞凋亡的发生与补体系统的激活有关,其中C5aR是补体系统的重要组成部分,表达于肾脏上皮细胞表面,参与补体系统的激活并介导靶细胞的凋亡[1]。RNA干扰(RNAi)是近年来发现的一种高效、特异性阻断mRNA表达而导致转录后基因沉默的现象,从而不能表达相应的特异性蛋白质,最终影响其生物学功能。这一干扰过程是由与目的基因有序列同源性的双链RNA引起的。在哺乳动物中发现21~23核苷酸(nt)的双链RNA介导的RNAi现象,开启了应用siRNA(Small interfering RNA)的治疗应用之门[2,3]。在本研究中,我们构建了针对大鼠C5aR特异性的发卡结构的RNAi质粒表达载体,并转染大鼠肾脏上皮细胞RK3E,建立稳定的转染细胞系,研究其基因沉默及抑制LPS诱导细胞凋亡的作用效果,为进一步研究如何减轻急性肾功能衰竭等病理过程奠定基础。
1 材料与方法
1.1 材料
1.1.1 RNAi表达载体 pRNAT-U6.1/Neo siRNA表达载体购自美国Genescript公司。
1.1.2 细胞系 大鼠肾脏上皮细胞RK3E细胞由华中科技大学同济医学院附属同济医院器官移植研究所保存。
1.1.3 试剂 DMEM培养基购自Sigma公司,胎牛血清购自Sigma公司,LB培养基为Promega公司产品,Trizol试剂购自Stratagene公司,C5aR的扩增引物由Invitrogen公司合成。
1.2 方法
1.2.1 C5aR基因shRNA的设计及载体构建 选用pRNAT-U6.1/Neo siRNA表达载体作为空载体,其携带有cGFP和U6的启动子,可以表达形成shRNA。根据GenBank提供的大鼠C5aR基因序列,使用美国Ambion公司在线设计软件,通过基因序列比对,挑选出一条长为21个碱基的特异性寡核苷酸序列(5′-TG AAACTCTTGCTGTCCCTGC-3′),合成C5aR基因的发夹样两端配对的 siRNA寡核苷酸(Small hairpin RNA)(5′-G ATCCCGTG AAACTCTTGC TGTCCCTGCTTG ATATCCGGCAGGG ACAGCAAG AGTTTCATTTTTTCCAA A-3′),同时合成互补链5′-AGCTTTTGG AAAAAATG A AACTCTTGCTGTCCCTGCTCTCTTG AAGCAGGG ACAGC AAG AGTTTCACGG-3′),shRNA的寡核苷酸序列包括靶序列的正义链、反义链和环形区域。经退火形成互补双链,用于连接pRNAT-U6.1载体。
HindⅢ和BamHⅠ双酶切RNAT-U6.1空载体成线性,T4连接酶将携带有C5aR特异性的RNAi核苷酸序列的互补双链连接进入表达载体,然后转化大肠杆菌DH5α,挑取单克隆菌落,小量扩增,收集菌液,使用DNA小量提取试剂盒提取质粒,经测序正确后,采用氯化铯离心法大量提取质粒。
1.2.2 细胞培养 大鼠RK3E细胞用含10%胎牛血清的DMEM培养基在5%CO2、37℃下培养传代,接种于75 cm2的细胞培养瓶。
1.2.3 细胞转染 采用电穿孔的方法进行细胞转染。收集RK3E细胞,2×106个细胞混合40μg的shRNA,在170 V,25 ms的条件下,应用Bio-Rad电穿孔仪进行电穿孔,荧光显微镜下可见转染的RK3E细胞呈绿色荧光,经过G418筛选,形成稳定的携带C5aR shRNA的RK3E细胞系。
1.2.4 脂多糖(LPS)诱导RK3E细胞凋亡率的检测
实验分为3组:(1)正常对照组:为正常的RK3E细胞;(2)阴性对照组:转染空载体pRNAT-U6.1的RK3E细胞系;(3)实验组:转染 C5aR shRNA的RK3E细胞。
分别将上述3组细胞接种于六孔板中。分别加入LPS 100 ng/ml诱导RK3E细胞凋亡。LPS孵育12小时后收集细胞,磷酸盐缓冲液(PBS)洗涤,调整细胞浓度为1×106ml-1,70%冷乙醇固定,-20℃过夜。检测前PBS洗涤1次,加入含RNA酶(终浓度为0.25 mg/ml)的碘化丙啶(终浓度为50μg/ml)染色液,室温孵育30分钟,用流式细胞仪(美国FACSort-BD公司产品,使用CellQuest软件)检测细胞凋亡率。
1.2.5 半定量RT-PCR检测RK3E细胞C5aR的表达 经LPS刺激后,收集上述3组细胞,用Trizol试剂提取细胞总RNA,用3μg RNA合成cDNA。PCR条件:95℃5分钟,94℃30秒,58℃30秒,72℃30秒,30个循环,72℃延伸10分钟。C5aR引物:上游引物为5′-GG ACCCCATAAGTAACG ACAGC-3′,下游引物为5′-CCACACCACCAGGGCATTTC-3′;内参照磷酸甘油醛脱氢酶(G APDH)引物:上游引物为5′-TG ATG ACATCAAG AAGGTGGTG AA-3′,下游引物为5′-TCCTTGG AGGCCATGTAGGCCAT-3′,PCR产物经1.5%的琼脂糖凝胶电泳分析。使用Chemilmager 5500软件进行图像分析,测出扩增产物条带的吸光度(A)值,并与同一样本G APDH的A值进行比值定量分析,以此比值表示C5aR mRNA的相对含量。
1.2.6125I-rrC5a与RK3E的结合试验 上述3组细胞接种于六孔板,并置于0℃冰上,用2 ml Hanks液孵育0.5小时,PBS液洗涤2次后,RK3E细胞与125I标记的重组大鼠C5a(rrC5a)的PBS缓冲液(0.1%的胎牛血清)孵育20分钟,随后用PBS液洗涤4次后, 1%SDS裂解RK3E细胞,0.1%乙基苯基聚乙二醇洗涤后,采用γ计数仪测定125I标记的C5a与RK3E的结合情况,数值用cpm值表示。
2 结果
2.1 成功构建针对大鼠C5aR的shRNA表达载体pRNAT-U6.1-C5aR shRNA HindⅢ和BamHⅠ双酶切pRNAT-U6.1空载体成线性,T4连接酶将携带有C5aR特异性的RNAi核苷酸序列的互补双链连接进入表达载体,经测序鉴定,证明我们设计的寡核苷酸序列已经成功退火,并连接至pRNAT-U6.1。
2.2 C5aR shRNA转染的RK3E稳定细胞系 电穿孔的方法将C5aR shRNA转染 RK3E细胞,由于pRNAT-U6.1携带有cGFP基因,可以表达绿色荧光蛋白,因此,转染的RK3E细胞显示绿色荧光,经G418筛选,形成稳定表达C5aR shRNA的细胞系,该细胞系在荧光显微镜下可见遍布视野的绿色荧光,而未转染的RK3E细胞无绿色荧光,只见黑色背景视野(见图1和图2)。
2.3 LPS诱导的RK3E细胞凋亡率 流式细胞仪检测结果显示,在LPS的刺激12小时后,转染C5aR shRNA的RK3E细胞凋亡率为24.81%±2.87%,而未转染的RK3E细胞和转染空载体pRNAT-U6.1的RK3E细胞凋亡率分别为 78.32%±3.62%和76.46%±5.54%,与未转染的RK3E细胞和转染空载体pRNAT-U6.1的RK3E细胞相比,转染C5aR shRNA的RK3E的细胞凋亡率显著下降,差异均有显著的统计学意义(P<0.01)。见图3。

图1 未转染的RK3E细胞Fig.1 Untransfected RK3E cells

图2 C5aR shRNA转染RK3E细胞Fig.2 C5aR shRNA transfected RK3E cells
2.4 C5aR mRNA水平的表达 LPS刺激12小时后,收集3组细胞,进行RT-PCR检测mRNA水平的表达,结果显示:经LPS刺激后,转染C5aR shRNA的RK3E细胞的mRNA相对含量为26.11%±3.16%,而未转染的RK3E细胞和转染空载体pRNAT-U6.1的RK3E细胞中mRNA相对含量为98.74%±2.27%和105.21%±2.57%。与未转染的RK3E细胞和转染空载体pRNAT-U6.1的 RK3E细胞相比,转染C5aR shRNA的RK3E细胞mRNA表达水平显著降低,差异均具有统计学意义(P<0.01),见图4A、B。
2.5 各组RK3E细胞125I-rrC5a的结合活性 LPS刺激的条件下测定各组RK3E细胞中C5a的结合活性,结果显示:与正常对照组和阴性对照组相比,经LPS刺激后,125I-rrC5a与转染C5aR shRNA的RK3E细胞的结合活性显著降低(P<0.05),见图5。
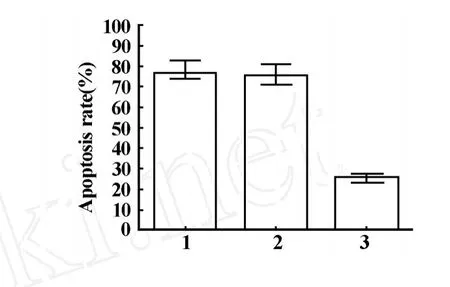
图3 LPS刺激后RK3E细胞凋亡率Fig.3 Apoptosis rate of RK3Eafter LPS stimulated
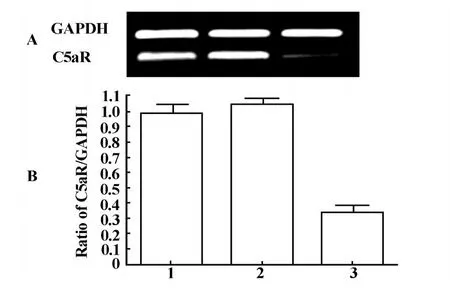
图4 LPS刺激12小时后,RT-PCR检测各组C5aR mRNA的表达(A,B)Fig.4 12 h after LPS stimulated,C5aR mRNA was detected by RT-PCR in different group(A,B)

图5 LPS刺激条件下125I-rrC5a与RK3E细胞的结合活性Fig.5 Binding of125I-rrC5a to RK3E stimulated with LPS
3 讨论
补体活化参与缺血再灌注损伤等众多病理生理过程,是关联先天免疫和获得性免疫的重要纽带。肾脏上皮细胞表达众多的补体受体C5aR,在肾脏上皮细胞的损伤和细胞凋亡的执行过程中起关键作用[1,4,5]。因此,本研究中我们设计了针对大鼠补体受体C5aR作为抑制细胞凋亡的靶位点,进而探讨通过短发夹状RNA基因沉默C5aR及抑制LPS诱导的肾脏上皮细胞的凋亡的作用。
在多种生物体细胞中,外源或内源性双链RNA (Double-stranded RNA,dsRNA)可触发细胞内同源mRNA的特异性降解,从而使该基因表达沉默,这种现象称为RNA干扰(RNA interference,RNAi)。RNAi属于转录后水平的基因沉默机制,具有高度的序列特异性和抑制基因表达的高效性[6,7]。在本研究中我们根据大鼠C5aR的基因序列,设计发夹样两端配对的shRNA寡核苷酸,并连接到真核表达载体pRNAT-U6.1,构建形成发夹状siRNA的质粒(shRNA)表达载体。然后进行电穿孔的方法转染肾脏上皮细胞RK3E,经G418筛选后得到稳定的转染细胞系,在荧光显微镜下可见遍布视野的绿色荧光,而未转染的RK3E细胞只见黑色背景。该试验表明,采用shRNA质粒表达载体转染哺乳动物细胞,就可以持续的转录出shRNA,通过筛选形成稳定表达shRNA的细胞系,便于进一步研究基因沉默的作用效果。与siRNA介导的 RNAi作用相比,shRNA介导的RNAi作用能更长期,甚至稳定地抑制目的基因的表达,更适合于对目的基因功能进行长期研究。
在肾脏C5aR主要表达在肾脏系膜细胞和近曲小管上皮细胞,远曲小管和输尿管、膀胱的移行上皮细胞也均有C5aR的表达。C5aR可能参与了肾脏上皮细胞多种细胞因子和补体成分的产生,诱导单核细胞释放TNF-α、IL-1、IL-6和IL-8等细胞因子。在血液循环中较低的C5a浓度就可以诱导粒细胞应答,而如果组织表达C5aR,则通过与C5a的结合,使组织局部的C5a浓度比血液循环要高很多,更有利于粒细胞向炎症部位聚集,而且还可以促进内皮细胞表达P选择素,后者促进粒细胞粘附到血管壁,加速炎症反应[8,9]。给实验动物注射脂多糖可以引起肾脏、肺和肝的C5aR mRNA的表达增多,同时C5aR的表达也上调,说明其可能在组织炎症反应中扮演重要角色。本实验中观察到,经LPS刺激12小时后,在未转染的RK3E细胞、转染空载体pRNAT-U6.1的RK3E细胞和转染C5aR shRNA的RK3E细胞均出现C5aR mRNA及蛋白的表达,进而诱导肾脏上皮细胞出现凋亡。而与未转染的RK3E细胞和转染空载体的RK3E细胞相比,C5aR shRNA转染RK3E细胞细胞凋亡率明显下降,C5aR mRNA水平和蛋白活性显著降低,该研究表明,一方面,LPS可以诱导肾脏上皮细胞RK3E出现凋亡,该细胞凋亡的发生与C5aR的表达增高有关,在试验中C5aR mRNA水平和蛋白均显著升高。另一方面,C5aR shRNA对LPS诱导的RK3E细胞凋亡起到抑制作用,其主要机制是沉默RK3E细胞中的C5aR基因,试验中C5aR mRNA水平较未转染的RK3E细胞和转染空载体的RK3E细胞显著降低,说明了C5aR的基因沉默作用,C5aR基因沉默从而发挥抑制凋亡的作用。另外,我们在LPS的刺激性,测定了125I-rrC5a与未转染的RK3E细胞、转染空载体pRNAT-U6.1的RK3E细胞和转染C5aR shRNA的RK3E细胞的结合活性,发现经C5aR shRNA处理的RK3E细胞其结合活性显著减低,提示经RNA干扰处理的RK3E细胞表达C5aR显著降低,进一步证实了采用RNA干扰技术可以有效的沉默肾脏上皮细胞表达C5aR。因此,我们设想,采用针对C5aR的shRNA来干预细胞凋亡过程,可以作为抑制肾脏缺血再灌注损伤等病理生理过程的一条有效途径,并有可能为研制含有siRNA的药物来抑制细胞凋亡的发生提供了思路[8,9]。
本文研究表明,通过携带C5aR的shRNA质粒表达载体pRNAT-U6.1转染哺乳动物细胞是可行的,经过筛选可以形成稳定的表达C5aR shRNA的细胞系,形成持续shRNA表达,C5aR shRNA可以显著抑制靶基因达到基因沉默的效应。LPS的刺激下, C5aR基因沉默可以明显抑制肾脏上皮细胞的凋亡,该试验为进一步研究抑制补体系统对肾脏缺血再灌注损伤的保护性作用等奠定条件。
1 Arumugam T V,Shiels I A,Strachan AJet al.A small molecule C5a receptor antagonist protects kidneys from ischemia/reperfusion injury in rats [J].K idney Int,2003;63(1):134-142.
2 张 艳,陈 栋,贡福盛 et al.RNAi介导Caspase-3基因及其抑制LPS诱导肾脏上皮细胞凋亡的研究[J].中国免疫学杂志,2008;24 (1):16-19.
3 Fire A,Xu S,Montgomery M Ket al.Pomnt and specific genetic interference by doublestranded RNA in Caenorhabditis elegans[J].Nature,1998; 391(6669):806-811.
4 de Vries B,Köhl J,Leclercq W ket al.Complement factor C5a mediates renal ischemia-reperfusion injury independent from neutrophils[J].J Immunol,2003;170(7):3883-3889.
5 Lewis A G,Köhl G,Ma Qet al.Pharmacological targeting of C5a receptors during organ preservation improves kidney graft survival[J].Clin Exp Immunol,2008;153(1):117-126.
6 Mao C P,Lin Y Y,Hung C Fet al.Immunological research using RNA interference technology[J].Immunology,2007;121(3):295-307.
7 杜 静.RNA干扰的基础研究和临床应用前景[J].国外医学计划生育/生殖健康分册,2006;25(6):307-310.
8 Gueler F,Rong S,G winner Wet al.Complement 5a receptor inhibition improves renal allograft survival[J].J Am Soc Nephrol,2008;19(12): 2302-2312.
9 Welch T R,Frenzke M,Witte Det al.C5a is important in the tubulointerstitial component of experimental immune complex glomerulonephritis[J]. Clin Exp Immunol,2002;130(1):43-48.
[收稿2009-10-11]
(编辑 张晓舟)
Small hairpin RNA targeting rat C5aRcan inhibit the cell apoptosis induced by LPS in kidney epithelial cells
CHEN Dong,ZHANG Yan,LI Ming,YIN Zhu-Zeng,CHEN Gang,ZHANG Wei-Jie,CHEN Shi.Institute of Organ
Transplantation,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective:T o investigate RNA interference and apoptosis induced byLPS in kidney epithelial cells through silencing C5aR gene with small hairpin RNA(shRNA).Methods:We construct the eukaryotic expression vector of small hairpin RNA targeting rat C5aR gene, and transfected RK3E cell by electroporation,after G418 selection,so we got the stable cell line expressing C5aR shRNA.The experiment was designed into 3 groups:①normal control group,RK3E cells without transfection;②negative control group,RK3E cells transfected with blank vector;③experimental group,RK3E cells transfected with C5aR shRNA.After incubation withLPSfor 12 h,the ratio of apoptosiswas tested by flow cytometry,the level of mRNA was tested by RT-PCR,and bindingof125I-rrC5a to RK3E cells stimulated withLPSwere performed to examine the expression of C5aR in RK3E cells.Results:Compared with the normal control group and negative control group,in the experimental group the ratio of apoptosis was significantly decreased(P<0.01),and the expression of C5aR mRNA was significantly inhibited(P<0.01), and binding of125I-rrC5a to RK3E cells was significantly decreased also.Conclusion:Hairpin shRNA targeting C5aR gene can lead to obvious gene silence in vitro and inhibit the cell apoptosis induced by LPS in kidney epithelial cell.
RNA interference;C5aR;Gene silence;Apoptosis
R392.1 文献标识码 A 文章编号 1000-484X(2010)02-0151-04
①本文为教育部留学回国人员科研启动基金项目和国家自然科学基金(30600573)资助项目
②华中科技大学同济医学院附属同济医院综合医疗科,武汉430030
③通讯作者,E-mail:yzhang1977@yahoo.com.cn
陈 栋(1973年-),男,医学博士,主要从事器官移植临床及移植免疫方面的研究,E-mail:dchen0369@yahoo.com.cn。

