二维凝胶体系中碳酸钙分形结构的形成与机理研究
王润霞 张 丽 王秀芳 谢安建,3 黄方志 沈玉华*,,3
(1安徽大学化学化工学院,合肥230039)
(2安徽医学高等专科学校,合肥230601)
(3南京大学配位化学国家重点实验室,南京210093)
二维凝胶体系中碳酸钙分形结构的形成与机理研究
王润霞1,2张 丽1王秀芳1谢安建1,3黄方志1沈玉华*,1,3
(1安徽大学化学化工学院,合肥230039)
(2安徽医学高等专科学校,合肥230601)
(3南京大学配位化学国家重点实验室,南京210093)
本文研究了二维琼脂凝胶圆盘体系中碳酸钙分形结构的形成过程,发现随着反应时间的增加,碳酸钙的形态经过了细小颗粒-枝晶结构-分形结构的转变过程,该分形结构实际上是由纳微米级碳酸钙晶粒聚集而成的。增加琼脂和反应物的浓度,碳酸钙微晶的形貌和尺寸发生了变化,呈现立方体与球形,由其构成的分形结构的尺寸也随着改变,但碳酸钙的晶型均为方解石型,无明显变化。二维凝胶体系中碳酸钙分形结构的形成主要与琼脂极性基团提供成核位点、多糖的网络结构、沉淀剂离子扩散受限有关。
碳酸钙;分形结构;二维琼脂凝胶体系;生物矿化;晶体生长
0 引言
生物矿化是指生物体系中具有特殊的高级结构和组装方式的生物矿物形成的过程[1],它与地质上的矿化作用明显不同的是无机相的结晶严格受生物分泌的有机质的控制[2]。碳酸钙作为世界上最广泛的生物矿物,常见晶型有3种:球霰石、文石和方解石,它们的热力学稳定性依次增加[3]。在腹足动物的蛋壳以及海鞘类动物的骨针中,碳酸钙主要以球霰石形式存在;在鸡蛋壳和某些疾病的结石中则主要为方解石;而在软体动物壳的珍珠层中主要为文石,棱柱层中则主要为方解石[4],如在红鲍鱼壳层中的不同部位,碳酸钙分别以文石、块状方解石和球状方解石形式存在[5]。近年来,生物组织中的碳酸钙由于具有多种晶型和复杂的结构、形貌而引起了化学、生物及材料科学工作者的广泛关注。
依据生物矿化的原理,利用各种软模板的空间限域和调控作用合成从介观尺度到宏观尺度具有复杂形态的、满足多种功能要求的仿生材料,已成为材料化学领域新近崛起的重要研究方向之一[6]。例如自组装单分子膜、LB膜、生物大分子、有机小分子、分子筛[7]、胶束[8-10]、囊泡[11],病毒[12]、细菌[13]、动植物组织[14-15]等被广泛的用来调节碳酸钙晶体的生长。我们课题组在复杂结构碳酸钙的仿生合成方面已经开展了大量的工作,如在不同氨基酸体系中合成了球状的霰石型碳酸钙[12],在氨基酸/Mg2+体系中合成了刺球状文石型碳酸钙[16],并利用合成的新型氨羧配位剂4-BAPTA作模板,合成了多角星状的方解石型碳酸钙等[17];用大肠杆菌介导合成了CaCO3的中空球[18];在二棕榈酰磷脂酰胆碱单分子层下,通过调节亚相葡聚糖的浓度控制合成了圆饼等多种形态的CaCO3[19]。
凝胶是一类具有三维网络结构的半固态介质,凝胶的浓度、内部结构和所包含功能基团的种类等性质都可以对所制备的无机晶体的形貌和大小等进行控制。凝胶作为扩散介质,为沉淀剂离子提供了一个缓慢的扩散、成核以及生长过程,因此,凝胶作为微纳米材料的制备模板,具有独到的优势[20]。有人在羟丙基甲基纤维素(HPMC)水凝胶中合成了玉米棒状的文石和方解石混合晶型的碳酸钙晶体[21];在硅酸凝胶中制备了针状的文石、立方体状的方解石和球形的球霰石[22]。本工作考虑到琼脂多糖大分子的侧链上除了含有大量的羟基外,还有许多的醚基和醛基,这些基团可与Ca2+作用,对碳酸钙晶体的形貌和性能都将产生重要的影响;而且生物大分子凝胶体系与生物体内的环境更为接近;另外在二维凝胶体系中制备复杂形貌的碳酸钙的研究尚未见报道。在此,利用二维琼脂凝胶作为离子扩散和反应介质,首次观察到了具有自相似性、分形结构特征的树枝状CaCO3晶体的形成,为凝胶体系作为生物矿物的模拟环境、制备复杂形态的无机材料提供了启示。
1 实验部分
1.1 试剂与仪器
无水氯化钙(广东汕头市西陇化工厂),无水碳酸钠(上海化学试剂有限公司),以上试剂皆为分析纯。琼脂(海南省琼海市长坡琼脂二厂)。本实验用水均为二次蒸馏水(石英双重蒸馏器制取)。
美国Nicolet公司NEXUS-870型傅立叶变换红外光谱仪,KBr压片(扫描范围4 000~400 cm-1,扫描32次,分辨率4 cm-1);MAP18XAHF转靶型X射线衍射仪,测试电压为40 kV,电流100 mA,扫描速度4°·min-1;扫描电镜(SEM,日本Hitachi S-3400型,加速电压20 kV)。索尼TX1数码相机,光学显微镜(北京泰克仪器有限公司制造)。
1.2 实验步骤
配制一定量浓度的氯化钙溶液(0.01、0.05 mol· L-1)备用。准确称取一定量的琼脂溶于二次水中,配成不同浓度的琼脂溶液(0.1%,1%),加热至沸腾,并加入一定量的碳酸钠使其浓度分别为0.01、0.05 mol·L-1,不断搅拌使其混合均匀。趁热分别取15 mL左右注入洁净的培养皿中(如图1a所示)。待琼脂冷却凝固后,在圆盘中心挖一个半径为0.7 cm的孔洞,除去其中的琼脂,在孔洞中滴加氯化钙溶液(如图1b所示)。室温下密封放置,反应过程中定时记录并拍摄现象。15 d后,取出含有产物的琼脂凝胶,部分干燥后,进行X射线粉末衍射(XRD)测试,傅立叶变换红外光谱(FTIR)、扫描电镜(SEM)等测试。
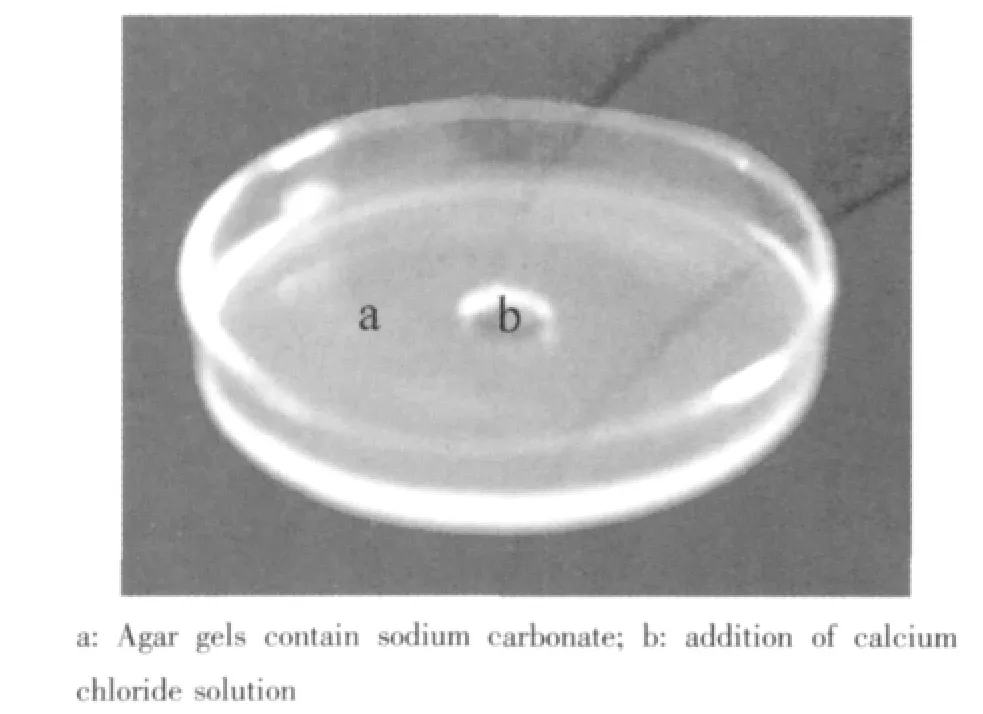
图1 二维琼脂凝胶圆盘体系实验示意图Fig.1 Experimental strategy of two-dimensional agar gel systems
2 结果与讨论
2.1 二维琼脂凝胶圆盘体系中碳酸钙分形结构的动力学观察
图2是二维琼脂凝胶圆盘体系中碳酸钙分形结构的形成过程动力学观测结果,可见,随着反应时间的增加,体系中碳酸钙晶体逐渐形成的枝状分形结构。反应5d,如图2a所示,琼脂凝胶体系出现了一些细小的颗粒,变浑浊,且部分呈现云雾状结构。其相应的XRD图显示在2θ为23.08°、29.35°、36.04°、39.43°、43.21°、47.23°和48.40°处出现衍射峰(图3a),分别对应于方解石晶体的(012)、(104)、(110)、(113)、(202)、(018)和(116)面(JCPDS Card No.:88-1812),其晶格常数约为a=0.4976 nm,c=1.748 nm,表明有方解石型CaCO3微晶形成。反应10 d后(图2b),凝胶中形成了由长约300 μm茎干和若干分枝组成的CaCO3枝晶结构,且茎干和枝干均是由微小晶粒组装而成,局部放大图(图2c)显示此微小晶粒为1~2 μm左右的立方晶体、晶体棒等多形态的晶体。对应的XRD图谱(图3b)表明此时产物为方解石型CaCO3。随反应时间的延长,碳酸钙微晶增多,组装形成类似树枝状的碳酸钙分形结构,当反应时间达到15d(图2d),分形结构中茎干变粗、枝干增多,空间结构的立体性减弱,由其局部放大图(图2e)可见,且参与形成多级分形结构的碳酸钙为1~2 μm左右的立方晶体。XRD图(图3c)表明此时所得碳酸钙也是方解石。从以上结果可以看出不同反应时间生成的碳酸钙均为方解石,可见调控诱导时间可调节碳酸钙的形态,但对产物的晶型无明显的影响。其形态的转变过程是:在结晶初期,胶体中首先形成一个个小的碳酸钙晶粒;随反应时间的延长,晶粒不断增多,胶体中晶粒聚集在一起,形成了分形花样,这个过程和电解沉积金属如Zn以及NaCl的结晶过程相似,其机制可能为扩散受限聚集机制(DLA)[23-25]。据此,以图2d为基础,计算机模型模拟计算得到其分形维数为1.83。

图2 二维琼脂凝胶圆盘体系中碳酸钙的形貌随时间的变化图Fig.2 Images of calcium carbonate crystals obtained in agar gel after different time
2.2 浓度对碳酸钙分形结构的影响
当琼脂浓度增加至1%时,所得产物如图4a所示,可见,与相同条件下琼脂浓度较低时得到的产物(图2d)不同,碳酸钙树枝状分形的主茎干变粗,且枝干变得粗而短。其分形维数为1.76。
另外,从其局部放大图(图4b)可见,此枝状分形是由大量平均直径约2 μm的球形晶体和少量的尺寸约为2~3 μm立方晶体组装而成。其X射线衍射图如图5a所示,可见,在2θ为22.99°,29.07°,36.07°,39.34°,43.20°,46.54°,48.04°和57.51°时出现了几组衍射峰,对照标准卡片(JCPDS No.88-1812),这些峰分别对应于方解石型碳酸钙晶体的(012)、(104)、(110)、(113)、(202)、(018)、(116)、(112)面的特征衍射。说明调节介质琼脂的浓度不仅可以调控碳酸钙基本晶粒的形貌和尺寸,也可影响碳酸钙的多级分形结构的形态。这可能是由于琼脂凝胶作为离子扩散介质,其浓度增加,网格密度增大,吸附面增多,使Ca2+的扩散速度降低,限域效应增强,有利于球形结构晶体的形成;琼脂分子链未能充分展开,成核位点有所减少,相同浓度的离子,琼脂凝胶浓度较大的形成的晶体尺寸较大,且晶体容易发生聚集,形成的枝状分形则较为稠密,分形维数降低,尺寸增大。
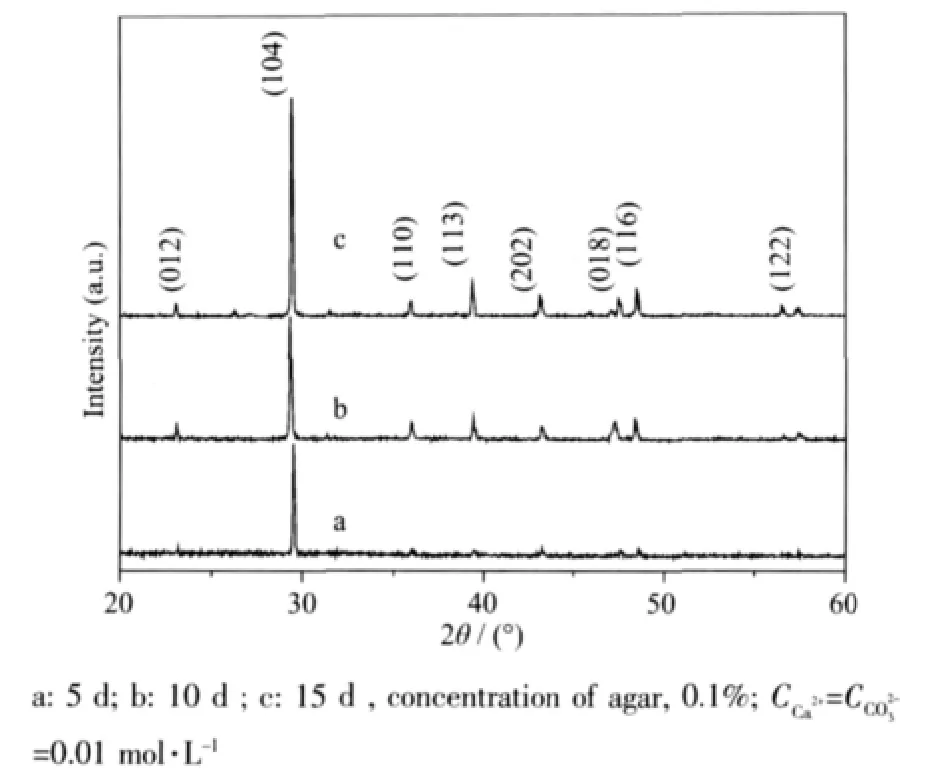
图3 二维琼脂凝胶圆盘体系中碳酸钙的XRD图Fig.3 XRD patterns of calcium carbonate crystals obtained in agar gel after different time

图4 反应在15 d后不同反应物浓度的琼脂凝胶体系中碳酸钙的分形图Fig.4 Fractal Images of calcium carbonate crystals obtained in agar gel with different reactant concentrations after 15 d
当琼脂凝胶的浓度不变(1%),增加Ca2+和CO32-的浓度至0.05 mol·L-1时(如图4c),形成的枝状碳酸钙晶体的主茎干变得更为粗壮,枝干也变得更为短而粗,但生产的碳酸钙晶体的量明显增多,分形结构也更为稠密,分形维数为1.69,XRD图(图5b)显示产物为方解石型碳酸钙。另外,组成分形结构的碳酸钙晶体的形态也发生了改变,主要是平均尺寸约为4~5 μm的多面体晶体和少量不规则形态的小晶粒(图4d)。这可能是由于琼脂浓度不变,离子浓度增大后,扩散速度增大,晶体成核速率加快的同时,晶体生长速度也显著增大,琼脂介质的调控效果降低,则形成的晶体数量增多,且大小不一;部分尺寸较大,且为立方体结构。说明碳酸钙的浓度对最终晶体的尺寸和形貌都有一定的影响,并且导致分形维数降低。
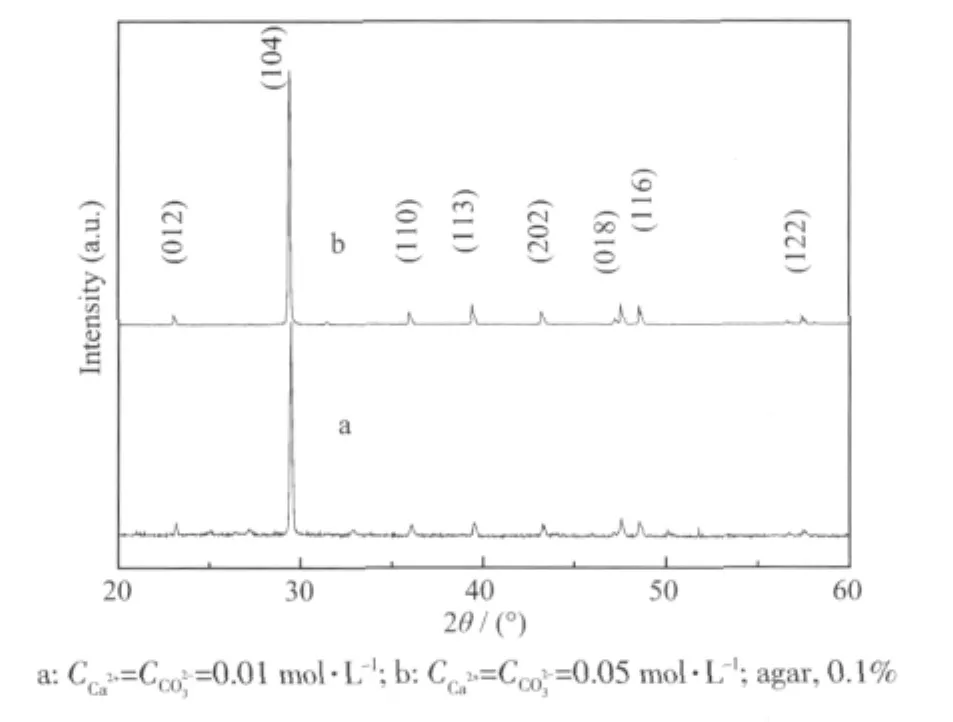
图5 反应在15 d后不同反应物浓度的琼脂凝胶体系中碳酸钙的XRD图Fig.5 XRD patterns of calcium carbonate crystals obtained in agar gel with different reactant concentrations after 15 d
2.3碳酸钙分形结构的形成机理
图6是CaCO3晶体在琼脂凝胶调控下的生长示意图。首先在琼脂凝胶体系中均匀分散,在二维圆盘中心加入Ca2+后,由于浓度梯度和琼脂凝胶介质的作用,Ca2+缓慢地向圆盘四周扩散。如图6所示,琼脂凝胶中含有大量的羟基、醚基等,其上的氧原子可与Ca2+相互作用,提供了成核位点(如图6a),进一步吸引均匀分散在琼脂凝胶中的形成CaCO3晶核。根据成核与生长理论[26],形成一个新的晶核,必须克服成核活化能(ΔGN)。ΔGN可表示为:
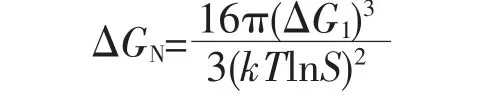
其中ΔG1、k、T和S分别为形成新界面和维持晶体生长所需表面能、玻兹曼常数、温度和局域过饱和度。表面能ΔG1的降低和局域过饱和度S的增加都可以降低晶体成核所需的活化能。琼脂凝胶分子与Ca2+相互作用使得Ca2+富集于琼脂凝胶分子中氧原子周围,导致这些区域的碳酸盐过饱和度的增加和表面能的降低,结果碳酸钙晶核形成了。同时,从琼脂分子的结构示意图(图7)可以看出,琼脂分子中存在多种构象的氧原子,氧原子之间的间距各不相同,这样可提供立体化学互补与晶格匹配效应,最终导致CaCO3的(104)面择优生长。并且,根据能量最低原理,CaCO3晶体沿着三维网状的琼脂链生长,降低了方解石型CaCO3晶体的成核与生长活化能,最终形成方解石型CaCO3晶体。琼脂凝胶的空间网络结构的形状和大小决定了生成的CaCO3晶体的形貌和粒径。琼脂凝胶浓度较大时,其网格密度也较大,吸附面增多从而易于形成球形晶体,进一步组装形成分形结构。因此,琼脂凝胶分子可以作为模板调控碳酸盐的成核、生长与多级分形结构的组装。

图6 琼脂凝胶调控CaCO3生长机理示意图Fig.6 Schematic representation of formation process of CaCO3fractal structure controlled by agar gels
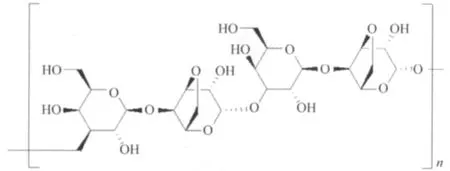
图7 琼脂分子结构式Fig.7 Molecular structure of agar
3 结论
本文以二维琼脂凝胶圆盘为仿生矿化模拟体系,成功演绎了碳酸钙微晶→枝晶结构→分形结构的转变过程。在此过程中,调节琼脂和反应物的浓度、反应时间不仅可以控制碳酸钙的多级分形结构的形态,也可调控分形结构中的碳酸钙基本单元的形貌和尺寸。随琼脂和反应物浓度的增加,基本组装单元由立方碳酸钙逐渐转变为立方体与球体2种混合结构的碳酸钙;相应的分形结构的茎干与枝干也变的粗壮;但碳酸钙的晶型不变,均为方解石型晶体。这种形态与结构的变化可能主要是受琼脂的空间构象、多糖的网络结构以及沉淀离子的空间扩散等的制约,为探讨生物体中晶体分形结构的形成提供了有益的参考依据。
[1]Landfester K.J.Adv.Mater.,2001,13(10):765-768
[2]Aizenberg J,Black A J,Whitesides G M.Nature,1999,398 (6727):495-497
[3]Cooper S J,Sessions R B,Lubetkin S D.J.Am.Chem.Soc., 1998,120(9):2090-2098
[4]Douglas T,Young M.J.Adv.Mater.1999,11:679-681
[5]Klaus T,Joerger R,Olsson E,et al.Proc.Natl.Acad.Sci. USA.1999,96:13611-13614
[6]Feng S,Bein T.Nature,1994,368:834-836
[7]Zaremba C M,Belcher A M,Fritz M.J.Chem.Mater.,1996, 8:679-690
[8]Hua T,Wentao M,Peng W,et al.J.Biomaterials,2004,25 (17):3923-3929
[9]C觟lfen H,Qi L.J.Chem.Eur.,2001,7:106-109
[10]Sedlak M,Antoniettic M,C觟lfen H,et al.J.Macromol.Chem. Phys.,1998,199:247-250
[11]Han Y,Aizenberg J.J.Am.Chem.Soc.,2003,125:4032-4033
[12]Xie A J,Shen Y H,Zhang C Y,et al.J.Cryst.Growth, 2005,285:436-443
[13]Shenton W S,Um D,Leytr U B,et al.Nature,1997,389:585-587
[14]Mann S.J.Angew.Chem.Int.Ed,2000,39(19):3392-3406
[15]Yang H,Coombs N,Ozin G A.Nature,1997,386(6626):692-696
[16]Xie A J,Shen Y H,Li X Y,et al.J.Mater.Chem.Phys., 2007(101):87-92
[17]Xie A J,Yuan Z W,Shen Y H.J.Cryst.Growth,2005,276: 265-274
[18]Chen L,Shen Y H,Xie A J,et al.Cryst.Growth Des.,2009, 9(2):743-754
[19]Huang F Z,Shen Y H,Xie A J,et al.Cryst.Growth Des., 2009,9(2):722-727
[20]Ogasawara W,Shenton W,Davis S A,et al.Chem.Mater., 2000,12:2835-2839
[21]ZHAO Jin(赵瑾),LI Yan-Jun(李彦军),CHENG Guo-Xiang(成国祥).Chin.Sci.Bull.(Kexue Tongbao),2007,52 (4):394-398
[22]CHENChen(陈沉),LIMing-Wei(李明伟),CHENShu-Xian (陈淑仙),et al.J.Chongqing Univ.:Nat.Sci.(Chongqing Daxue Xuebao:Ziran Kexue Ban),2006,29(8):40-43
[23]CHEN Shu-Rong(陈书荣),ZHANG Zheng(张郑),XIE Gang(谢刚),et al.J.Xi′an Univ.of Arch.&Tech.:Nat. Sci.(Xi′an Jianzhu Keji Daxue Xuebao:Ziran Kexue Ban), 2006,38(5):686-690
[24]CHEN Shu-Rong(陈书荣),XIE Gang(谢刚),CUI Heng (崔衡),et al.J.Chin.Nonferr.Metals(Zhongguo Youse Jinshu Xuebao),2002,12(4):846-850
[25]GE Fu-Ding(葛副鼎),ZHU Jing(朱静).J.Chin.Electron Microsc.Soc.(Dianzi Xianwei Xuebao),1998,17(6):744-747
[26]Tong H,Ma W,Wang L,et al.J.Biomaterials,2004,25(17): 3923-3929
Preparation and Formation Mechanisms of Calcium Carbonate Fractal Aggregates in Agar Gel
WANG Run-Xia1,2ZHANG Li1WANG Xiu-Fang1XIE An-Jian1,3HUANG Fang-Zhi1SHEN Yu-Hua*,1,3
(1School of Chemistry and Chemical Engineering,Anhui University,Hefei 230039)
(2Anhui Medical College,Hefei 230601)
(3State Key Laboratory of Coordination Chemistry,Nanjing University,Nanjing 210093)
Fractal growth of calcium carbonate was found in 2D agar gels.Remarkable morphological evolution of calcite from crystalline to ramified aggregates to tree-like fractal aggregates as induction time increased has been observed.Marked morphological and dimension changes of crystals were observed to be dependent on the concentration of agar and precipitator.Although,the sizes of tree-like fractal aggregates consisting of global blocks and cubical crystals also changed,all the crystals were identified to be orthorhombic CaCO3crystals.The experimental results reveal that fractal growth could occur successfully in agar gels,which was influenced by the polar groups of agar,network-like structure of amylase and pervasion of precipitators,and so on.
calcium carbonate,fractal structure,2D agar gel,biomineralization,crystal growth
O611.6;O614.23+1
A
1001-4861(2010)08-1355-06
2010-03-29。收修改稿日期:2010-05-12。
国家自然科学基金(No.20671001,20871001),高校博士点基金(No.20070357002)及安徽省高等学校自然科学重大项目(No.ZD2007004-1)和一般项目(No.KJ2008B50ZC)基金资助。
*通讯联系人。E-mail:s_yuhua@163.com
王润霞,女,42岁,硕士,副教授;研究方向:生物矿化与仿生合成。

