HPLC-MS/MS联用技术定量测定人血浆中恩替卡韦
郝光涛,李媛媛,何世学,陈 刚,高洪志,刘泽源
(1.军事医学科学院附属医院药理室,北京 100071;2.哈励逊国际和平医院,河北衡水 053000)
HPLC-MS/MS联用技术定量测定人血浆中恩替卡韦
郝光涛1,李媛媛1,何世学2,陈 刚1,高洪志1,刘泽源1
(1.军事医学科学院附属医院药理室,北京 100071;2.哈励逊国际和平医院,河北衡水 053000)
建立HPLC-MS/MS联用方法定量测定人血浆中恩替卡韦浓度。以地西泮为内标,甲醇为有机相,甲醇-水为(5 mmol·L-1碳酸氢铵)梯度洗脱流动相,Waters-Eterra MS-C18(2.1×50 mm×5μm)色谱柱为分析柱,通过电喷雾离子源(ESI),以正离子多反应监测(MRM)方式检测。用于定量分析的离子对分别为m/z278.2→152.1(恩替卡韦)和 m/z285.0→193.0(地西泮,内标)。恩替卡韦的线性范围为0.05~20 μg·L-1,定量下限为0.05μg·L-1(n=6)。日内、日间精密度的RSD<15%,平均回收率>75%。
恩替卡韦;高效液湘色谱-串联质谱;血浆药物浓度
恩替卡韦具有很强的抗 HBV作用,对HBV、DNA复制的起始,逆转病和DNA正链合成等3个阶段均起到抑制作用。恩替卡韦的作用靶点是HBV的DNA聚合酶和反转病酶,通过抑制这些酶,从而抑制前基因RNA逆转病复制HBV的DNA负链,进而抑制正链的合成,阻断HBV的DNA链的延伸和装配。恩替卡韦经口服吸收进入肝细胞后,通过磷酸化作用形成单磷酸脂、二磷酸脂、三磷酸脂,它们(尤其恩替卡韦三磷酸脂)是恩替卡韦在肝细胞内抑制HBV的DNA聚合酶的活性形式。恩替卡韦比其他核苷类似物(如拉米夫定、泛昔洛韦等)更易于被磷酸化,而这可能是其对HBV有高活性的原因之一。恩替卡韦口服吸收良好,生物利用率高,达峰时间 Tmax为0.61~1 h,峰浓度Cmax为4.3~6.7 ng·mol-1,血药溶液曲线下面积AUC为15~17.8 ng·h-1·mL-1,其组织分布广泛,以肾脏内浓度最高,血浆酶结合率低,恩替卡韦三磷酸脂的半衰期为14~15 h,体内代谢率低,主要以原形从肾脏排泄。若肾功能不良,可能会影响该药的清除。
1 实验部分
1.1 主要仪器与装置
6410型高效液相色谱-串联质谱联用仪:美国Agilent公司产品,其中安捷伦1200高效液相色谱系统包括二元输液泵、自动进样器、柱温箱;串联质谱仪为Agilent6410型三重四极杆串联质谱仪,包含电喷雾离子化源以及串联三重四极杆质谱检测器。色谱工作站:MassHunter数据处理软件,美国Agilent公司产品;GL-88B旋涡混合仪:海门市其林贝尔仪器制造有限公司产品;AB104电子分析天平:瑞士 Mettler Toledo公司产品;Sigma 2K-15型高速低温离心机:美国Sigma公司产品;Milli-Q Plus纯水器:美国密理博中国有限公司产品。
1.2 主要试剂
恩替卡韦对照品(含量99.68%):由中国药品生物制品检定所提供;地西泮对照品(内标,批号:1230-9601):由中国药品生物制品检定所提供;甲醇(色谱纯):DIMA公司产品;乙腈(色谱纯):DIMA公司产品;实验用水为去离子水,本实验室自制。
1.3 HPLC-MS/MS分析条件
1.3.1 色谱条件 色谱柱:Waters-Eterra MSC18柱 (2.1×50 mm×5μm);流动相:甲醇-水(5 mmol·L-1碳酸氢铵),梯度洗脱;流速: 0.3 mL·min-1;柱温:20℃;进样量:10μL。
1.3.2 质谱条件 电喷雾离子化源 (ESI源),正离子模式检测,多反应监测 (MRM)方式,喷射电压5 500 V;离子源温度350℃;源内气体1 (GS1,N2)压力 2.07×105Pa,源内气体 2 (GS2,N2)压力4.14×105Pa,气帘气 (N2)压力6.90×104Pa,碰撞气 (N2)压力6.90×104Pa,碰撞电压15 V;碎裂电压110 V。以多反应监测的质谱扫描方式分析,测定恩替卡韦和内标的正离子对分别为 m/z278.2→152.1,m/z 285.0→193.0,示于图1。

图1 恩替卡韦(a)和内标地西泮(b)的产物离子扫描质谱图Fig.1 Full-scan product ion spectra of[M+H]+for entecavir(a)and diazepam(b)
1.4 实验步骤
1.4.1 样品预处理 精密量取50μL血浆样品,置于1.5 mL EP试管中,分别加入50μL内标溶液 (5μg·L-1地西泮溶液)和50μL甲醇,并补加1 000μL甲醇溶液,涡旋混合均匀,在4℃下以15 000 r·min-1转速离心10 min,取上清液800μL,在50℃水浴中吹氮气挥干,200 μL流动相复溶,进样 10μL,HPLC-MS/MS分析。
1.4.2 标准曲线和质控样品的制备 精密称量10.0 mg(按无水计算)恩替卡韦,置于25 mL棕色容量瓶中,用甲醇定容,得恩替卡韦浓度为400.0 mg·L-1,作为储备液备用,然后用空白血浆依次稀释配成浓度为0.05、0.1、0.25、1、2.5、7.5、15、20μg·L-1的标准含药血浆。按照1.4.1项所描述的方法进行处理并测定。同样步骤再次配制浓度为0.25、2.5、15μg·L-1的质控样品。
1.4.3 稳定性考察 在不同的实验条件下对质控样品进行稳定性实验(n=3)。
1)质控样品在-40℃冰箱中完全冷冻后取出,在室温环境下解冻,然后再次放入冰箱,如此反复3次后制备并测定;
2)质控样品在室温下放置 4 h后制备并测定;
3)质控样品在-40℃下避光保存,1个月后制备并测定;
4)质控样品在进样器放置 4 h后制备并测定。
2 方法与结果
2.1 特异性考察
分别取6个不同受试者的50μL空白血浆,除不加入内标溶液并补加50μL甲醇外,其余按血浆样品分析方法处理,进样10μL,获得空白样品的色谱图,示于图2a;将一定浓度的恩替卡韦标准溶液和内标地西泮溶液加入空白血浆中,依同法进行样品处理,获得相应的色谱图,示于图2b(最低定量限)、图2c(标准曲线中间浓度);取受试者给药后收集的血浆样品,依同法进行样品处理,获得相应的色谱图,示于图2d。结果表明,空白血浆中的内源性物质不干扰恩替卡韦和地西泮的测定。
2.2 相对基质效应考察
分别取6个不同受试者的50μL空白血浆于1.5 mL EP试管中,然后各加入50μL恩替卡韦最低浓度 (0.05μg·L-1)标准溶液和50 μL内标,按1.4.1项操作,进样量10μL,每个空白血浆做3份;并同时做1条随行的标准曲线,根据标准曲线计算血浆样品的实测浓度。结果显示,所有实验测定值与标示量的相对偏差均在±20% 之间,精密度为 10.04%(小于15%),可认为没有基质效应干扰。
2.3 标准曲线和线性范围
以待测化合物和内标峰面积为纵坐标,浓度为横坐标,权重系数1/X2,进行线性回归计算,得标准曲线示于图 3。线性相关系数 r为0.996 4,而且各点标示浓度和计算浓度的偏差都在±15%以内(最低定量限为±20%),最低定量浓度为0.05μg·L-1。
2.4 精密度和准确度
方法学考核浓度为0.25、2.5、15μg·L-1, n=6,(方法学考核批次)为3次,结果列于表1。结果表明,此方法的精密度和准确度偏差均在±15%以内。
2.5 稳定性
分别在-40℃反复冻融3次、血浆室温放置4 h、-40℃下冻存1个月、进样器放置4 h (n=3),4种条件下考察方法的稳定性,结果列于表2。结果表明,恩替卡韦在这4种条件下的稳定性良好。
2.6 相对回收率试验
取1.5 mL EP试管数支,制备含恩替卡韦浓度分别为0.25、2.5、15μg·L-1的质控样品,按1.4项操作,记录色谱图,计算恩替卡韦峰面积 As和内标峰面积 Ai的比值 f,将 f代入当天的标准曲线方程,计算实测浓度与加入浓度的比值即为准确度 (相对回收率),结果显示,低、中、高浓度的相对回收率分别为 107.33%、102.47%、105.22%。
2.7 方法应用
应用本方法测定36名中国成年健康志愿者单剂量口服1 mg恩替卡韦后,不同时间血浆中恩替卡韦的浓度,并计算药代动力学参数。平均血药浓度-时间曲线示于图4。药代动力学参数结果为 Cmax:(7.63±1.91)μg·L-1;Tmax: (0.67±0.22)h;t1/2:(62.35±22.36)h; AUC0-tn:(22.80±4.19)μg·h·L-1;AUC0-∞: (29.08±4.57)μg·h·L-1。
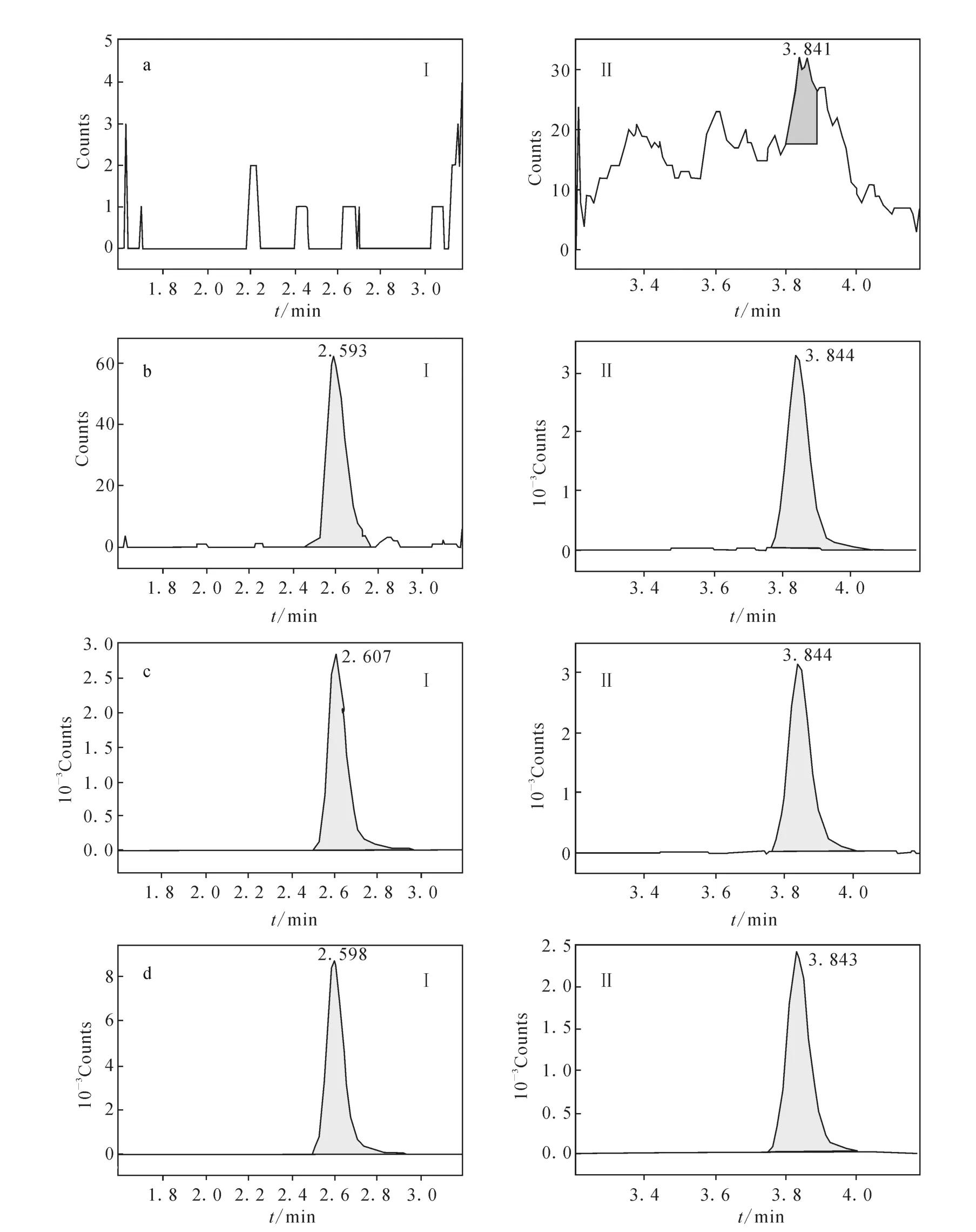
图2 血浆中恩替卡韦(Ⅰ)和内标地西泮(Ⅱ)的典型MRM色谱图a.空白血浆色谱图; b.空白血浆中加入0.05μg·L-1恩替卡韦和5μg·L-1内标地西泮的色谱图; c.空白血浆中加入2.5μg·L-1恩替卡韦和5μg·L-1内标地西泮的色谱图; d.志愿者口服1 mg恩替卡韦0.75 h后的血浆样品色谱图Fig.2 Chromatograms of entecavir(I)and diazepam(IS)(II)in humen plasma a.blank plasma;b.standard curve sample(0.05μg·L-1)added IS(5μg·L-1); c.standard curve sample(2.5μg·L-1)added IS(5μg·L-1); d.plasma sample from a healthy volunteer 0.75 h after oral administration of 1 mg entecavir
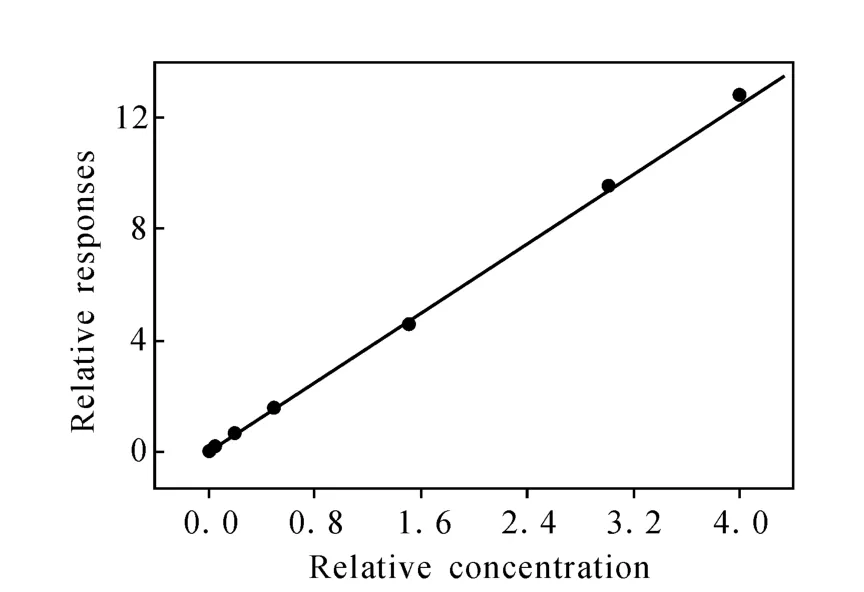
图3 HPLC-MS/MS法测定人血浆中恩替卡韦的标准曲线Fig.3 The typital calibration cure for entecavir in human plasma
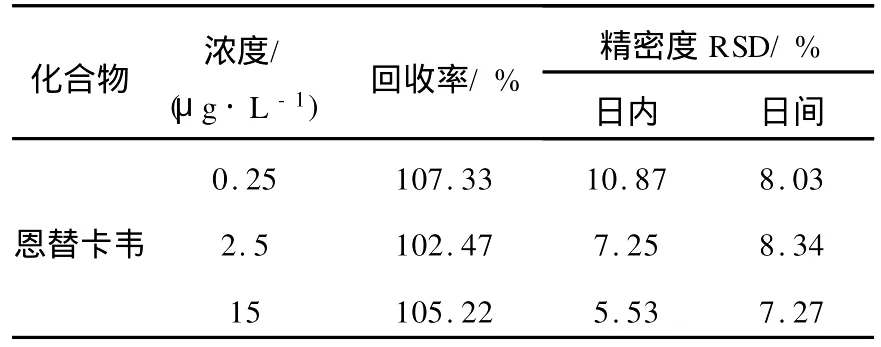
表1 恩替卡韦回收率和精密度Table 1 Recovery and precision of entecavir
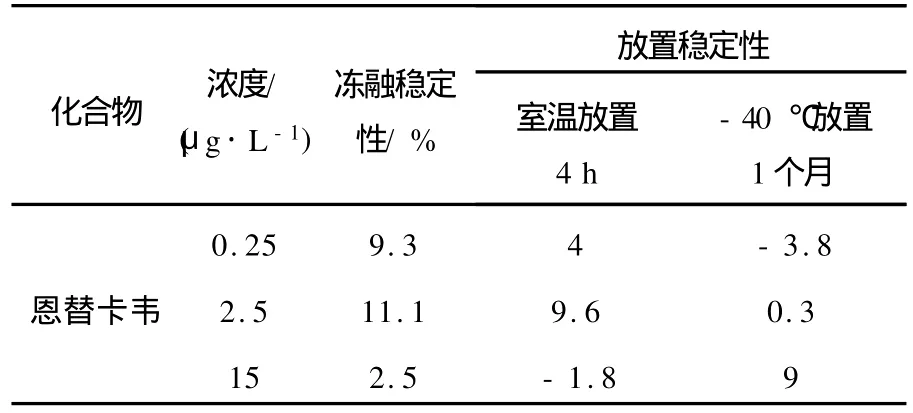
表2 恩替卡韦稳定性Table 2 Stability of entecavir
3 讨 论
本实验建立了血浆中恩替卡韦的 HPLCMS/MS测定法,血浆中的杂质不干扰样品的测定,标准曲线线性范围为0.05~20μg·L-1,线性关系良好;高、中、低3个浓度的批内和批间精密度均小于15.0%;相对回收率在102.47%~107.33%之间;恩替卡韦血浆样品室温放置 4 h,-40℃下反复冻融3次,-40℃下冻存1个月及检测样品进样器放置4 h条件下的稳定性良好,符合生物样品分析要求。采用沉淀蛋白法后挥干的方法处理血浆样品,相比固相萃取法操作简单,节约成本,最低定量限为50 pg,满足本研究药代数据的需要。
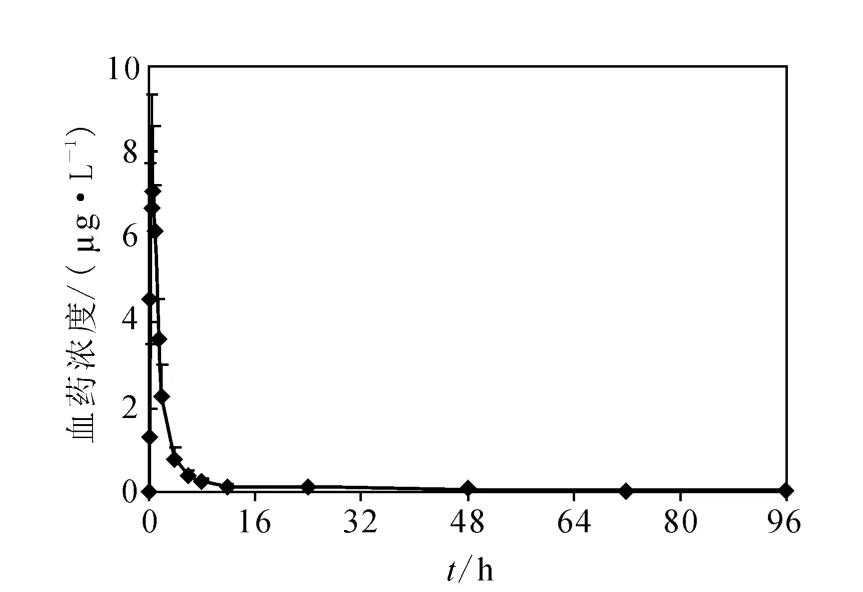
图4 36名健康志愿者口服1 mg恩替卡韦后的平均血药浓度-时间曲线Fig.4 Mean plasma concentration-time profile of amycin in 36 healthy volunteers after oral administration of 1 mg entecavir
[1]YAN J H,BIFANO M,OLSEN S,et al.Entecavir pharmacokinetics,safety,and tolerability after multiple ascending doses in healthy subjects[J]. The Journal of Clinical Pharmacology,2006,46: 1 250-1 258.
[2]MA TUSZEWSKI B K,CONSTANZER M L, CHAVEZENG C M.Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J].Anal Chem, 2003,75(13):3 019-3 030.
[3]ZOULIM F.Entecavir:A new treatment option for chronic hepatitis B[J].Journal of Clinical Virology,2006,36(1):8-12.
[4]SHERMAN M,YURDAYDIN C,SOLLANO J. Entecavir for treatment of lamivudine-refractory, HBeAg-positive chronic hepatitis B[J].Gastroenterology,2006,130(7):2 039-2 049.
[5]CHANG T T,GISH R G,HADZIYANNIS S J, et al.A dose-ranging study of the efficacy and tolerability of entecavir in lamivudine-refractory chronic hepatitis B patients[J].Gastroenterology, 2005,129(4):1 198-1 209.
Quantitative Determination of Entecavir in Human Plasma by HPLC-MS/MS
HAO Guang-tao1,LI Yuan-yuan1,HE Shi-xue2,CHEN Gang1, GAO Hong-zhi1,LIU Ze-yuan1
(1.A f f iliated Hospital,Academy of Military Medical Sciences,Beijing100071,China; 2.Harrison International Peace Hospital,Hengshui053000,China)
Entecavir in human plasma was determined by high performance liquid coupled with-tandem mass spectrometry(HPLC-MS/MS).Diazepam was used as internal standard. Entecavir was separated on a Waters-Eterra MS-C18column(2.1×50 mm×5μm).Electrospray ionization(ESI)source was applied,and multiple reaction monitoring(MRM)mode was operated in the positive mode with the monitor ions atm/z278.2→152.1 for entecavir andm/z285.0→193.0 for the internal standard,respectively.The linear calibration curve is obtained over the concentration range of 0.05—20μg·L-1.The limit of quantitation is 0.05μg·L-1(n=6).The inter and intra-day precision(RSD)is less than 15%.The average recoveries are above 75%.
entecavir;high performance liquid chromatography coupled with-tandem mass spectrometry(HPLC-MS/MS);plasma concentration
O 657.63;R 927.2
A
1004-2997(2010)04-0252-05
2009-10-21;
2010-02-02
郝光涛(1980~),男(汉族),甘肃庆阳人,药师,从事新药I期临床研究。E-mail:13146323056@m165.com
刘泽源(1961~),男(汉族),山西太原人,主任药师,从事新药I期临床研究。E-mail:13311010528@m165.com

