五仁醇胶囊的质量控制
孙素珍
五仁醇胶囊系由北五味子仁经提取浓缩成浸膏,再经干燥粉碎而制成,具有滋补肝肾之功效。用于急慢性肝炎(GPT偏高)而具肝肾阴虚之症者,其现行标准收载于局颁标准(YBZ11272005),其含量测定采用分光光度法,以标准曲线计算,为提高检测手段,更有效地控制产品质量,本文采用HPLC法测定五味子乙素的含量,取得满意的结果,报告如下。
1 仪器与试药
1.1 仪器 LC-10AT高效液相色谱仪、SPD-10A检测器、AG-135型电子天平、MILLI-Q50超纯水器。
1.2 试药 五味子乙素对照品(编号为110765-200805)购自中国药品生物制品检定所;五仁醇胶囊(广东在田药业有限公司,批号:20091001,20091101,20091201),甲醇为色谱纯,水为超纯水,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件 色谱柱为shim-pack CLC-ODS(4.60 mm×150 mm,5 um);流动相甲醇:水(75:25);检测波长:254 nm;流速:1.0 ml/min;进样量:20 μl[1]。
2.2 对照品溶液的制备 取五味子乙素对照品10 mg,精密称定,置100 ml量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得((每1 ml含五味子乙素0.1 mg)。
2.3 供试品溶液的制备 取本品内容物约1 g,精密称定,置50 ml量瓶中,加甲醇约40 ml,超声处理20 min,取出,放至室温,加甲醇至刻度,摇匀,滤过,取续滤液,即得[2]。
2.4 线性关系考察 配置每1 ml含五味子乙素1 mg的甲醇标准储备溶液,分别精密吸取标准品储备液0.5、1、2、4 ml各置10 ml容量瓶和1 ml置100 ml容量瓶中,加入甲醇稀释至刻度,按上述色谱条件,分别进样,记录峰面积。以峰面积积分值Y对其浓度X进行线性回归,得回归方程 :Y=20215239.95X+2280.457355,r=0.9999902,见表 1,表明五味子乙素在0.01~0.40 mg/ml范围内,峰面积积分值和浓度呈良好的线性关系。

表1 线性关系(n=5)
2.5 精密度试验 取对照品溶液,按上述色谱条件,以20 μl进样,记录峰面积,重复进样5次,结果:五味子乙素平均峰面积为1885322,RSD为1.2%(n=5)。
2.6 稳定性试验 取供试品溶液,按上述色谱条件,以20 μl进样,记录峰面积,每隔1 h进样1次,共进样6次,结果:RSD为0.9%(n=6),表明供试品溶液在6 h内基本稳定。
2.7 加样回收试验 取已知含量的样品(20091001)配置成三个不同浓度,每个浓度各分别制备3份供试品溶液,再分别精密加入标准品储备液1 ml,按样品测定项下样品溶液制备方法制备,测定,记录峰面积,计算回收率,见表2。
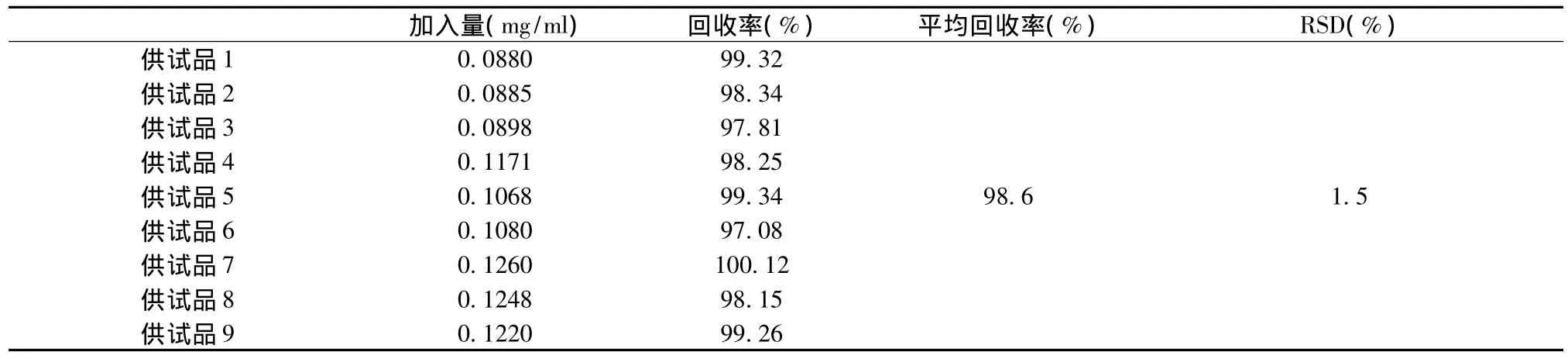
表2 回收率试验结果(n=9)
2.8 样品测定 分别取对照品溶液和供试品溶液,按上述色谱条件测定,分别以20 μl进样,记录峰面积,以外标法计算供试品中五味子乙素的含量。结果见表3,色谱图见图1,图2。

表3 样品含量测定结果(n=3)

图1 供试品(五仁醇胶囊)
图2 对照品(五味子乙素)
3 讨论在对五味
子乙素进行初步测试时,首先是进行紫外扫描,确定其最佳检测波长为254 nm。后进行初步进样测试,用五味子乙素对照品配置成甲醇溶液,稀释成不同浓度,确定最佳进样浓度和最佳流动相比例。
因为仪器设备的局限,专属性试验无法进行(需用到二级管阵列检测仪或质谱检测仪,而现实条件只有单波长紫外检测仪),有待以后的改进。
在配置样品溶液时,为确定是否提取完全,特对0630401批次的样品设计了三个超声时间:10 min 20 min 30 min,按样品制备项下方法操作,分别计算其五味子乙素的含量,结果见表4,故采用20 min的超声时间[1]。

表4 超声提取实验结果比较
4 结论
五味子为五仁醇胶囊的主药,而五味子乙素又为五味子的有效成分之一,上述采用HPLC法测定五味子乙素的含量[2],结果表明本法简便、准确,可用于五仁醇胶囊的质量控制。
[1]孙玉雯,刘汉青.五味子及其制剂中主要化学成分的提取和测定方法研究进展.时珍国医国药,2004,15(6):368-369
[2]崔兰贵,陈虹,苗德田,等.HPLC法测定益肾丸中五味子甲素和乙素的含量.武警医学,2001,12(8):479-480.

