稀有放线菌的分离及抗菌筛选
范丽霞,郑继平
(海南大学 食品学院微生物实验室,海南 海口 570228)
稀有放线菌的分离及抗菌筛选
范丽霞,郑继平
(海南大学 食品学院微生物实验室,海南 海口 570228)
通过对海南不同植被的土壤、对土样不同的预处理方式及抑制剂的有无对稀有放线菌进行分离、筛选出57株稀有放线菌,使用纸片扩散法测定它们对大肠杆菌、枯草芽胞杆菌、金黄色葡萄球菌、黑曲霉的拮抗作用.结果表明,从不同植被土壤分离的稀有放线菌数量上看,耕作土>草甸土>风沙土;土样不同的预处理后稀有放线菌的检出中,自然风干>化学处理>烘干处理;土壤共有8个菌株对指示菌有拮抗作用,其中3株具有进一步研究的价值.
稀有放线菌;分离;拮抗作用
放线菌是一类重要的药源微生物,大量常见菌株已被反复研究,从中发现新药物的几率逐渐降低,很多学者都逐渐转向极端环境或有特色环境中筛选能产生新抗生素的放线菌[1].如小单孢菌产生的庆大霉素、诺卡氏菌产生的利福霉素、马杜拉放线菌产生的马杜拉霉菌和洋红霉素等[2-3].目前,微生物抗生素的研发热点已从链霉菌转移到稀有放线菌[4-6].海南岛地处热带,在该地区对稀有放线菌进行分离,并对其进行抗菌筛选,对于放线菌药物资源的开发利用具有重要的意义.
1 材料与方法
1.1 土壤样品
为海南的各地的山地风沙土、林地草甸土、菜地耕作土各3个样,共9个样品.
1.2样品预处理方法
土样采集后,自然条件下风干7 d,再用以下3种不同的物理、化学等方法对样品进行预处理.
A:自然风干:即不进行任何处理.
B:烘干处理:研磨过筛,120℃烘干处理1 h[7].
C:化学处理:称取1 g土样,加入9 mL无菌水混匀,加入0.05%(w)的SDS和6%(w)的酵母膏,40℃振荡20 min.
1.3 培养基
菌种分离选用高氏一号、改良高氏二号及腐殖酸培养基,菌种培养选用高氏一号培养基.
1)高氏一号培养基:可溶性淀粉20 g,KNO31.00 g,NaCl 0.50 g,K2HPO40.50 g,MgSO40.50 g,FeSO40.01 g,琼脂20.00 g,水1 000 mL,pH7.2~7.4.
2)改良高氏二号培养基[8]:葡萄糖1.0 g,蛋百胨0.5g,胰胨0.3g,NaCl 10.5g,琼脂1.5g,pH7.2,琼脂20.0 g;
3)腐殖酸培养基[9]:腐殖酸1.00 g,碳酸钙0.02 g,磷酸氢二钠0.50 g,硫酸镁0.50 g,氯化钾1.70 g,硫酸亚铁0.01 g,核黄素0.50 mg,硫胺素0.50 mg,维生素B6 0.50 mg,烟酸0.50 mg,肌醇0.50 mg,泛酸0.50 mg,生物素0.25 mg,对-氨基苯甲酸0.50 mg,琼脂18.00 g.
1.4 培养基中添加的抑制剂
100 mg/L放线菌酮和20 mg/L萘啶酮酸[8].
1.5 稀有放线菌的鉴定[10-13]
按形态和培养特征进行鉴定.依据《放线菌分类学》和《伯杰氏细菌鉴定手册》及《链霉素鉴定手册》中的方法进行稀有放线菌的鉴定和排除.
1.6 抗菌筛选试验
采用纸片扩散法.以大肠杆菌(Escherichia coli)、枯草芽胞杆菌(Bacillus subtilis)、金黄色葡萄球菌(Stephylococcus aureus)、黑曲霉(Aspergillus niger)为指示菌进行抗菌测定.
2 结果与分析
2.1 不同植被土壤分离到的稀有放线菌(见表1)

表1 海南土样中放线菌和稀有放线菌总数Tab.1 The total quantity of actinoMycete and rare actinomycete in HaiNan soil
从表1可知,耕作土中无论是放线菌还是稀有放线菌,数量均最多,而风沙土则两种都最少,草甸土位于中间.这是因为耕作土土壤肥力水平高,含有适度水分,通气条件好,而风沙土相对干旱,有机质含量低,环境恶劣,不利于微生物的生长繁殖[14].而草甸土则各方面均位于二者之间.
从稀有放线菌占放线菌的比例来看,风沙土为15%,草甸土为37%,耕作土为25%.可见草甸土中稀有放线菌所占比例最高,检出率高,风沙土稀有放线菌检出率最低,这可能也是营养太缺乏所至.
2.2 土样不同预处理及对稀有放线菌分离的影响
在土样放置7d后[15],对草甸土样进行3种不同预处理后,采用平板涂布法进行微生物分离,统计放线菌和稀有放线菌菌株数,结果见表2.
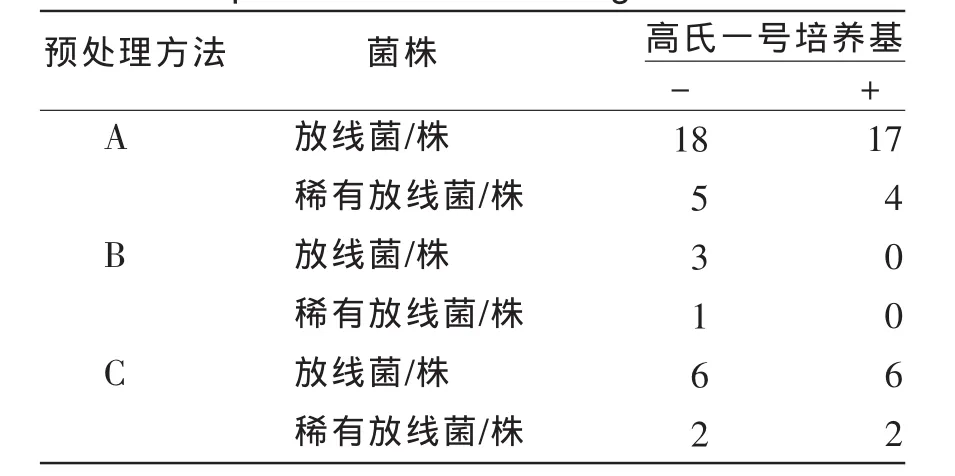
表2 土样不同预处理及抑制剂的有无对稀放线菌分离的影响Tab.2 The Isolation effect to rare actinoMycete With different pretreatment and having inhibitor or not
由表2可知,稀有放线菌的检出中,自然风干>化学处理>烘干处理.经过化学处理和烘干处理后,稀有放线菌的检出大大减少.分析原因,可能因为烘干处理会杀死一些不耐热的稀有放线菌,明显降低稀有放线菌的分离效果,而化学处理在杀灭一些细菌和真菌的同时,也不可避免地杀灭了一些稀有放线菌.故如果没有特殊的原因,一般不建议采取这两种方法分离稀有放线菌.
2.3 抑制剂的运用

表3 抑制剂对稀有放线菌分离的影响Tab.3 Effect of inhibitor on the isolation of rare actinoMycete
本实验的结果表明,采用100 mg/L放线菌酮和20 mg/L萘啶酮酸能有效地抑制细菌和真菌,能达到分离较多稀有放线菌的目的.在平板上,细菌和真菌都很少,有效地解决了放线菌分离中细菌和真菌污染的问题.
2.4 抗菌活性筛选结果
在分离得到的57株稀有放线菌中,通过其发酵液的纸片扩散实验筛选出8株具有抗菌活性的稀有放线菌,占稀有放线菌总数的14%.从表3中我们可以看出,同一种拮抗放线菌对不同靶标菌活性有较大区别.总的来说,分离菌株中对枯草芽胞杆菌有抑制作用的较多,达到6株,其次为金黄色葡萄球菌和黑曲霉,各有3株,而对大肠杆菌有抑制作用的最少,仅有1株,表明海南土壤中稀有放线菌抗G+细菌的能力强于抗G-细菌,抗真菌的能力也不错.其中AGHD149对革兰氏阳性菌(金黄色葡萄球菌、枯草杆菌)及革兰氏阴性菌(大肠杆菌)均有抑制作用,AGHDY88、AFHD15对革兰氏阳性菌(金黄色葡萄球菌、枯草杆菌)有抑制作用,这3种菌有进一步研究的价值.

表4 稀有放线菌发酵液的抑菌活性Tab.4 The antagonistic action of ferment liquid of rare actinoMycete
在这批有活性的8株稀有放线菌中,AGHDY176、AGHD149、AGHDY88、BGHD70、AGH DY132为耕作土中分离出来,其余3株为草甸土分离出来,而风沙土则未分离出有活性菌株.
3 结论
实验证实植被不同,其下土壤中的稀有放线菌的种类和数量也不同.耕作土中稀有放线菌数量最多,且在抗菌活性筛选中,耕作土中有活性的菌株也是最多,而风沙土中稀有放线菌数量很少,且未发现有拮抗活性的菌株.说明耕作土土壤肥沃、透气性好,也非常适合稀有放线菌的生长.
在海南得到的8株有活性的稀有放线菌中,AGHD149、AGHDY88、AFHD15这3株菌的抑菌活性较强,可能是具有较好开发潜力的拮抗菌株,有必要对其进行进一步的深入研究.
[1]龙中儿,朱跃进,黄运红,等.一株具有广谱抗菌活性小单孢菌的分离和鉴定[J].微生物学通报,2008,35(3):378-383.
[2]Nara T,Yamamoto M,Kawamoto I,et al.Fortimycin A and B,neWaMinoglycoside antibiotics.I Producing organisms,Fermertation and biological properties of FortiMicins [J].J S Antibiotics,1977,30:533-540.
[3]Magman G H,Weinstein MJ.Antibiotic froMMicromonospora[J].Annu Rev Microbiol,1980,34:537-557.
[4]Peric-Concha N,Long P F.Mining the Microbial metabolome:a neWfrontier for natural product lead discovery[J].Drug Discovery Today,2003,8(23):1078-1084.
[5]Donadio S,Monciardini P,Alduina R,et al.Microbial technologies for the discovery of novel bioactive metabolities[J].Journal of Biotechnology,2002,99(3):187-198.
[6]Lazzarini A,Cavaletti L,Toppo G,et al.Rare genera of actinomycetes as potential producers of a neWantibiotics[J]. Antonie van Leeuwenhock,2000,78(3/4):399-405.
[7]李文均,张忠泽,姜成林.几种主要稀有放线菌的选择性分离[J].国外医药抗生素分册,2002,23(1):16-17.
[8]姜怡,段淑蓉,唐蜀昆,等.稀有放线菌分离方法[J].微生物学通报,2006,33(1):181-183.
[9]Coombs J T,Franco C MM.Isolation and identification of actinobacteria froMsurface-sterilized wheat roots[J]. Appl Environ Microbiol,2003,69:5603-5608.
[10]姜成林,徐丽华.放线菌分类学[M].昆明:云南大学出版社,1997.
[11]布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册[M].8版.中国科学院生物研究所《伯杰细菌鉴定手册》翻译组译.北京:科学出版社,1984.
[12]中国科学院微生物研究所放线菌分类组.链霉素鉴定手册[M].北京:科学出版社,1975.
[13]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[14]罗红丽,黄英,王黎明,等.西藏地区土壤放线菌种群多样性及拮抗性活性研究[J].微生物学报,2005,45(5):724-727.
[15]史学群,宋海超,刘柱.海南省土壤拮抗放线菌分离方法初探[J].中国农学通报,2006,22(10):431-435.
责任编辑:黄 澜
Isolation and Screening of Antagonistic Rare Actinomycetes
FAN Lixia,ZHENG Jiping
(Microbiology Laboratory,Food College of Hainan University,Haikou 570228,China)
In the paper,we get 57 strains rare actinomycetes by isolation froMthe HaiNan soil of different vegetation、different pretreatment to the soil samples and having inhibitor or not.The slip of paper diffusion is used to measure the antagonistic action of the separated rare actinomycetes to Escherichia coli、Bacillus subtilis、Stephylococcus aureus and Aspergillus niger.The result indicated that the order of the quantity of rare actinomycetes of different vegetation is cropped soil>meadoWsoil>aeolian sandy soil;the order of the quantity of rare actinomycetes of different pretreatment to the soil samples is natural air drying>chemical treatment>furnace drying treatment.There are eight strains rare actinomycetes which have antagonistic action to the indicator,and three of theMis worthy of further study.
rare actinomycete;isolation;antagonistic action
Q 939.13
A
1674-4942(2010)02-0185-03
2010-03-25
海南省教育厅高等学校科研项目(H jkj2008-06)

