CpG-ODN加强树突状细胞疫苗治疗小鼠膀胱肿瘤的实验研究
聂志林,梁培禾,霍文谦,张克勤,靳风烁
(第三军医大学大坪医院野战外科研究所泌尿外科,重庆400042)
尽管树突状细胞(dendriticcell,DC)疫苗在肿瘤治疗中显示出令人憧憬的前景,但真正为临床所用,还存在构建方法和质量控制等问题,在DC的分化过程中,其成熟度与功能直接相关。研究证明,含未甲基化CpG基序的细菌DNA或人工合成的寡聚脱氧核苷酸(oligodeoxynucleotieds,ODN)具有强大的促DC成熟功能[1-2]。本研究利用CpG序列的寡脱氧核糖核苷酸(CpG oligodeoxynucleotide,CpG-ODN)作为骨髓来源DC的成熟刺激信号,体外诱导DC充分成熟,并将膀胱肿瘤抗原负载于DC,制备 DC疫苗,探讨CpG-ODN对 DC疫苗治疗小鼠膀胱肿瘤模型作用的影响。
1 材料与方法
1.1 细胞株及实验动物 BTT739小鼠膀胱肿瘤细胞株,本室保存,T739近交系小鼠48只,中国医学科学院肿瘤研究所实验动物中心提供,雌雄各半,5周龄,体质量20~25 g。
1.2 主要试剂 CpG-ODN:ATA ATC GAC GTT CAA GCA AG[3],上海生工生物技术公司合成,两端均用磷硫酰修饰。FITC-大鼠抗小鼠CD80单克隆抗体、FITC-大鼠抗小鼠CD86单克隆抗体及FITC标记的同型IgG购自美国Promega。
1.3 荷瘤小鼠模型的建立 BT T 739小鼠膀胱肿瘤细胞株常规培养,细胞生长至80%~90%时,台盼蓝染色计数细胞,检测活细胞比例大于95%,调整细胞数为1×106/mL。将细胞悬液注射于T739小鼠右前腋皮下,每只0.2 mL(2×105个)。
1.4 负载肿瘤抗原的DC疫苗的制备 参照文献[4-5],制备BTT739肿瘤细胞冻融粗提全抗原,体外冲击致敏法:收获培养第7天的DC[2],调整浓度为1×106/mL,常规台朌蓝试验示活细胞数大于90%;每孔按DC与抗原细胞的比例1∶10(抗原的量以冻融前肿瘤细胞的量计)加入BTT739肿瘤细胞冻融抗原。加入 rmGM-CSF、rmIL-4使其终浓度分别为500 u/mL、200 u/mL,继续置于37℃,5%CO2饱和湿度孵箱中培养48 h,加入CpG-ODN使其终浓度分别为2 μ mol/L,继续培养48 h后收获DC细胞即得DC疫苗。
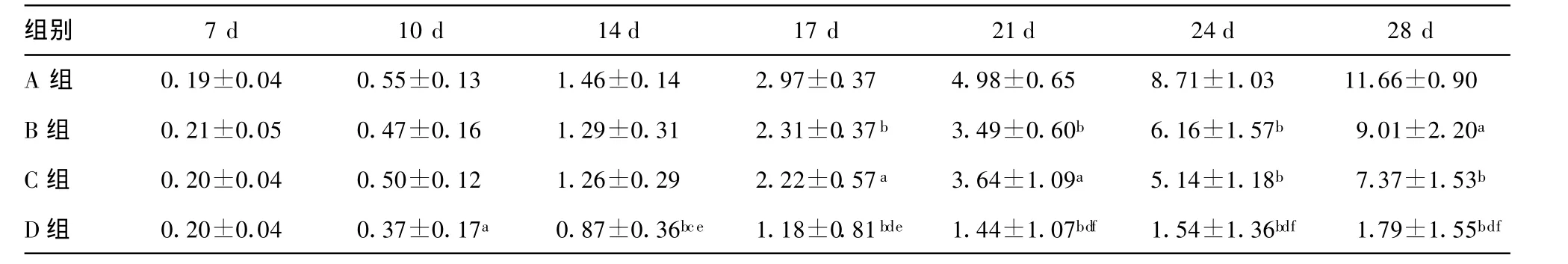
表1 不同治疗组荷瘤小鼠皮下肿瘤体积变化情况(cm3)
1.5 实验分组 T739小鼠48只,接种肿瘤细胞 7 d后,随机分为4个组,12只/组。分别为:(1)磷酸盐缓冲液(PBS)对照组(A组);(2)DC疫苗组(B组);(3)CpG-ODN组(C组);(4)DC+CpG-ODN联合治疗组(D组)。每组又随机分2个亚组,每个亚组6只。亚组1:用于观察肿瘤生长及荷瘤小鼠存活情况。卡尺测定肿瘤的长径a和短径b,按v=1/2ab2算出体积。2次/周,绘制肿瘤体积变化曲线,继续观察小鼠死亡情况,直至其中1组小鼠死亡达到50%时停止体积测量。亚组2:用于测量瘤重、体积:接种肿瘤细胞第21天颈椎脱臼法处死全部亚组6只小鼠,称取瘤重,按上法计算肿瘤体积,根据公式计算瘤重和体积抑制率,移植瘤瘤重抑制率(%)=(空白对照组平均瘤重-治疗组平均瘤重)/空白对照组平均瘤重×100%,移植瘤体积抑制率(%)=(空白对照组平均体积-治疗组平均体积)/空白对照组平均体积×100%。肿瘤组织用于检测浸润性树突状细胞(tumor infiltrating dendritic cell,TIDC)表面CD80、CD86 表达。
1.6 治疗时相点设置及治疗方案 调整DC疫苗细胞浓度至1×106/mL,各组实验动物分别于接种肿瘤细胞后第7、14天给予相应治疗,PBS对照组注射PBS 0.2 mL,DC疫苗组注射DC疫苗0.1 mL+PBS 1 mL,CpG-ODN治疗组注射浓度为500 μ g/mL的CpG-ODN溶液 0.2 mL,DC疫苗+CpG-ODN治疗组注射DC疫苗0.1 mL+CpG-ODN溶液0.1 mL,治疗方法采用肿瘤周围多点注射。
1.7 肿瘤组织TIDC表面共刺激分子CD80、CD86的表达提取肿瘤组织浸润淋巴细胞悬液,调整细胞浓度到5×105/mL,分别加入荧光FITC标记的大鼠抗小鼠CD80单克隆抗体、CD86单克隆抗体,FITC标记的同型IgG作为相应的阴性对照,行流式细胞仪检测。
1.8 统计学方法 采用SPSS10.0软件进行,各组数据以s表示,各组间比较采用非配对t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 荷瘤鼠肿瘤生长的一般情况 接种肿瘤细胞后第7天,小鼠肿瘤平均直径可达0.5~1.0 cm,此时给予第1次治疗。接种瘤细胞后第14天(即第1次治疗7 d后)D组平均体积明显小于A(P<0.01)、B和C(P<0.05)组,此时各组小鼠给予第2次相应治疗。于接种肿瘤细胞第17天时,B、C组肿瘤体积也明显小于A组(P<0.01,P<0.05),但B、C组之间肿瘤体积无明显差异,D组平均体积小于A、B、C组(P<0.01)(表1)。于接种瘤细胞后第 22、26、29天,PBS组各有1只小鼠死亡(肿瘤直径均大于3 cm),终止体积测量观察,此时其他 3个组小鼠也相继出现死亡。
2.2 DC疫苗联合CpG-ODN对膀胱肿瘤荷瘤鼠的抑瘤效应
各治疗组亚组2荷瘤小鼠,于接种肿瘤第21天解剖,联合治疗组平均瘤重及平均体积均显著小于其它各组(P<0.01)。DC疫苗组及CpG-ODN组平均瘤重及平均体积均显著小于PBS对照组(P<0.01),见表 2。
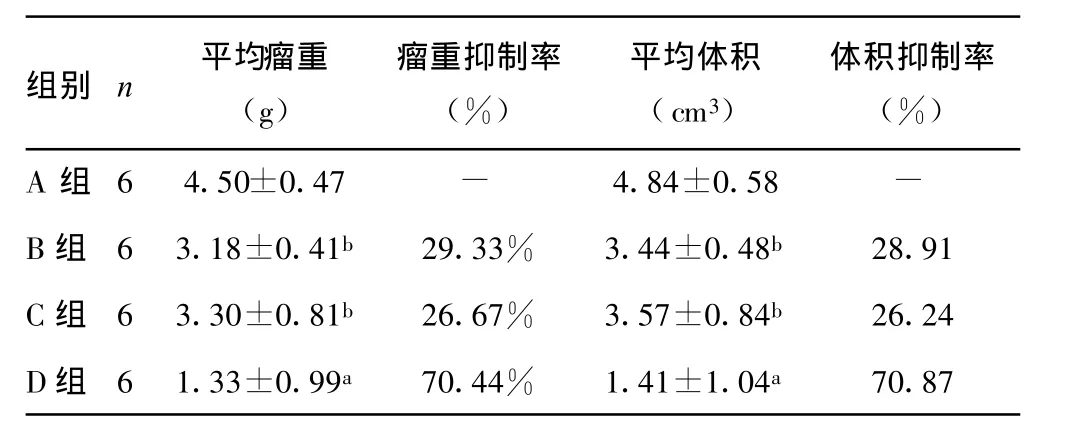
表2 BTT739荷瘤小鼠不同治疗组的抑瘤效应
2.3 DC疫苗联合CpG-ODN对膀胱肿瘤荷瘤鼠的存活延长效应 DC疫苗联合CpG-ODN治疗组的荷瘤生存期长于DC组、CpG-ODN组及PBS对照组,DC组、CpG-ODN组荷瘤小鼠生存期长于PBS对照组(P<0.05),见封2图1。
2.4 肿瘤组织TIDC表面分子CD80及CD86的表达 DC+CpG-ODN组肿瘤组织中TIDC表面共刺激分子CD80、CD86表达水平高于DC组及PBS对照组(P<0.01),虽略高于CpGODN组,但差异无统计学意义(P>0.05)。CpG-ODN组肿瘤组织中TIDC表面CD80、CD86表达水平高于DC组及PBS对照组(P<0.05),在DC组中二者表达虽略高于PBS对照组,但差异无统计学意义(P>0.05),见表3。
表3 小鼠肿瘤组织中TIDC表面CD80、CD86的表达(%,
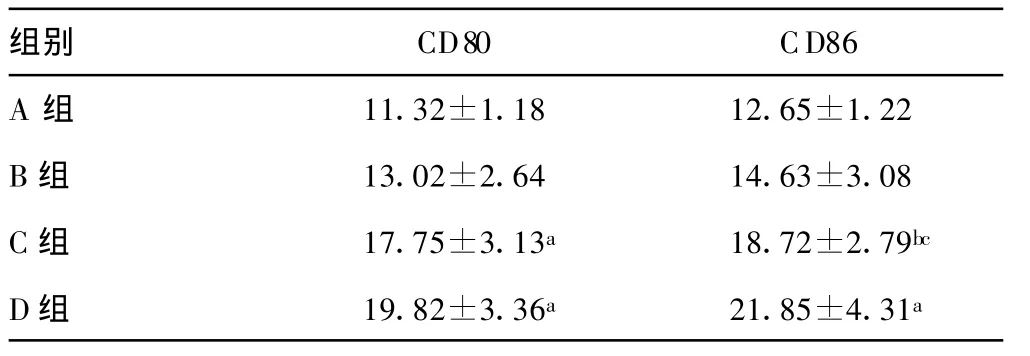
表3 小鼠肿瘤组织中TIDC表面CD80、CD86的表达(%,
a:与A、B组比较,P<0.01;b:与A组比较,P<0.01;c:与D组比较,P<0.05。
组别 CD80 CD86 A 组 11.32±1.18 12.65±1.22 B组 13.02±2.64 14.63±3.08 C组 17.75±3.13a 18.72±2.79bc D组 19.82±3.36a 21.85±4.31a
3 讨 论
肿瘤细胞可通过下调肿瘤相关抗原、低表达或不表达主要组织相容性复合物(MHC)分子和共刺激分子,使抗原不能被有效递呈给T细胞以产生特异性的抗瘤效应,因此激发有效的T细胞介导的抗瘤免疫反应是提高肿瘤免疫治疗效果的关键。单纯的抗原不能活化T淋巴细胞,必须经过抗原递呈细胞(APC)递呈,因为T淋巴细胞活化需要抗原和辅助分子双信号才能有效地诱导细胞毒T淋巴细胞(CT L)形成,发挥抗瘤效应。负载肿瘤抗原的DC疫苗由于可通过DC表面M HC类分子、共刺激分子将各种已知或未知的肿瘤相关抗原信息得到有效递呈,因此作为理想的肿瘤疫苗在实验和临床研究受到广泛重视。
CpG基序(CpG motifs)是一个含胞嘧啶(cytosine,C)和鸟嘌呤核苷酸(guanine,G)的二核苷酸。人工合成的CpG-ODN作为一种新型免疫佐剂,多项动物实验研究表明单独应用可有效治疗肿瘤[6-7]。CpG-ODN通过诱导DC的成熟和迁移,从而增强对抗原反应性T细胞刺激能力而间接发挥作用。肿瘤局部注射CpG-ODN后可活化APC,促进其成熟并迁移至局部淋巴结激活肿瘤特异性T细胞,T淋巴细胞活化后从淋巴结到达肿瘤部位而发挥效应。目前CpG-ODN联合抗体、细胞因子治疗肿瘤的研究已逐渐开展,体外实验已显示出了良好效果,但CpG-ODN能否增强DC疫苗的抗肿瘤效应,其机制如何等问题研究的甚少,为此本研究观察了CpG-ODN对DC疫苗治疗小鼠膀胱肿瘤作用的影响。
本研究的实验结果显示,21 d时DC疫苗联合CpG-ODN治疗组的荷瘤鼠平均瘤重和平均体积均显著低于DC疫苗组、CpG-ODN组、PBS对照组,而荷瘤生存期显著长于其它各组,结果说明DC疫苗联合CpG-ODN对膀胱肿瘤荷瘤鼠具有较强的抑瘤效应和延长生存期作用,而且这种作用强于单独应用CpG-ODN、DC疫苗治疗,显示了CpG-ODN增强 DC疫苗抗肿瘤效应。DC疫苗联合CpG-ODN治疗组及CpG-ODN组肿瘤组织中TIDC表面共刺激分子CD80、CD86的表达明显高于PBS对照组及DC疫苗组,CD80、CD86为成熟DC表面特异性标志,这些表面分子的参与是DC完成其抗原递呈功能所必须,表明CpG-ODN肿瘤周围注射后可增强肿瘤微环境中DC的成熟和活化,从而发挥免疫学效应,与 Heckelsmiller等[8]报道的结果相似。
本研究的实验结果发现,CpG-ODN可增强负载肿瘤抗原的DC疫苗的免疫治疗作用,提示其激发了机体强而有效的抗肿瘤免疫应答。结合前期实验结果[2],本研究认为其作用机制可能与以下几个方面有关:(1)CpG-ODN具有极强的诱导DC成熟、促进Th1型细胞因子分泌、诱导免疫应答向Th1型转化的作用,成熟的DC具有强大的刺激T淋巴细胞增殖的能力;(2)DC高表达M HC-Ⅰ、Ⅱ类分子和CD80/CD86等共刺激分子,为T淋巴细胞充分活化提供信号刺激;(3)CpG-ODN可增强DC疫苗诱导的CT L免疫杀伤活性,提高细胞因子干扰素-γ(IFN-γ)分泌,从而诱导肿瘤细胞凋亡及抑制肿瘤细胞增殖。CpG-ODN可维持长期的肿瘤特异性免疫反应,有研究表明CpG-ODN可以抑制DC的凋亡,延长DC的生存期[9],这对于逆转肿瘤微环境导致的DC数量减少、功能受抑制具有重要意义,同时肿瘤局部CpG-ODN可引起T淋巴细胞向肿瘤部位浸润,促进CD8+T细胞毒性反应的启动。CpG-ODN无免疫原性,不会导致自身免疫反应,因此是一种理想的DC激活剂,可望应用于体内免疫调节。
[1] Pilon TS,Li W,Briggs JJ,et al.Immunostimulatory effects of CpG-ODN upon dendritic cell-based immunotherapy in a murine melanoma model[J].J Immunother,2006,29(4):381.
[2] 聂志林,靳风烁,梁培禾,等.CpG-ODN促进小鼠骨髓来源的树突状细胞成熟作用的实验研究[J].重庆医学,2008,37(2):136.
[3] Actins H,Davis BR,Kirby JA,et al.Polarisation of a T-helper cell immune response by activation of dendritic cells with CpG-containing oligonucleotides:a potentiao therapeutic regime:for bladder cancer immunotherapy[J].Br J Cancer,2003,89(12):2312.
[4] 高维实,闵军,褚忠华,等.肝癌细胞冻融抗原负载树突状细胞瘤苗的制备与活化[J].中国病理生理杂志,2003,19(9):1279.
[5] Silke G,Michael S,Herbert R.Dendritic cells pulsed with tumor-derived lysate augment T cell mediated tumor cell lysis[J].Otolaryngol Head Neck Surg,2004,131(2):176.
[6] Baines J,Celis E.Immune-mediated tumor regression induced by CpG-containing oligodeoxynucleotides[J].Clin Cancer Res,2003,9(7):2693.
[7] Heckelsmiller K,Rall K,Beck S,et al.Peritumoral CpG DNA elicits a coordinated response of CD8 T cells and innate effectors to cure established tumorsin a murine colon carcinoma model[J].J Immunol,2002,169(7):3892.
[8] Heckelsmiller K,Beck S,Rall K,et al.Combined dendritic cell-and CpG oligonucleotide-based immune therapy cures large murine tumors that resist chemotherapy[J].Eur J Immunol,2002,32:3235.
[9] 杜宇琛,林苹,张洁,等.CpG-ODN加强树突状细胞疫苗抗Lewis肺癌的研究[J].中华肿瘤杂志,2005,27(1):1.

