银杏黄酮苷元对氧化低密度脂蛋白所致内皮细胞功能的影响*
何 艳,付永昕,吴立荣,方 颖,李 屏,李安敏
(贵州省贵阳医学院附属医院心内科,贵阳 550005)
氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)导致内皮功能障碍在动脉粥样硬化(atherosclerosis,AS)病理过程中起关键作用[1],植物血凝素样低密度脂蛋白受体-1(lectin-like oxidized low density lipoprotein receptor-1,LOX-1)作为近期发现的主要在内皮细胞表达的ox-LDL特异性受体,介导了ox-LDL对内皮细胞的损伤作用[2]。银杏黄酮苷元(ginkgo aglycone,GA)是通过酸水解-重结晶法去除单糖后获得的新型银杏叶提取物(ginkgo biloba extract,GBE),与传统GBE比较,具有较强的脂溶性和体内生物效价高的特点,目前国内外对GBE防治动脉粥样硬化的实验研究和临床应用很多,但对GA的研究却很少。本研究在培养的人脐静脉内皮细胞株ECV304上观察了不同浓度GA、作用不同时间对 ox-LDL所致的内皮细胞表面单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和LOX-1异常表达的干预,以期为GA进一步用于临床防治AS性疾病提供实验依据。
1 材料与方法
1.1 试剂与仪器 人脐静脉内皮细胞株ECV304(中国典型培养物保藏中心提供)。ox-LDL(中山大学谢志忠博士提供)。DMEM培养基(Gibco)、聚肌苷酸(Polynosinic acid,PIA,Sigma公司生产)。新生小牛血清(杭州四季青生物工程材料研究所提供)。总RNA提取 Trizol试剂及逆转录-聚合酶链反应(reverse transcription-polymerse chain reaction,RT-PCR)试剂盒(北京天根生化科技有限公司生产)。MCP-1酶联免疫吸附反应(ELISA)试剂盒(Boshide);LOX-1兔抗人多克隆抗体(Sata Cruz);染色体图像分析仪(Leica);梯度 PCR仪(Eppendorf公司AG22331型);凝胶图像分析系统(Eppendorf公司AG22331型)。上海捷瑞生物工程有限公司合成引物序列如下,MCP-1mRNA(177 bp)上游引物:5′-AGG AAG ATC TCA GTG CAC AGA GG-3′,下游 引物:5′-AGT CTT CGG AGT TTG GGT T TG-3′;LOX-1mRNA(193 bp)上游引物:TTA CTC TCC ATG GTG GTG CC,下游引物:AGC TTC TTC TGC TTG TTG CC;β-actin mRNA(295 bp)上游引物:5′-TCA CCC ACA ATG TGC CCA TCT ACG A-3′,下游 引物:5′-CAG CGG AAC CGC TCA TTG CCA ATG G-3′。 GA由贵州省生化中心何照范教授惠赠(主要成分:槲皮素25.75%、山奈酚15.26%、异鼠李素 1.77%、总黄酮苷元占总成分含量42.79%)。其他试剂均为进口或国产分析纯。
1.2 人脐静脉内皮细胞株ECV304培养 将所购的人脐静脉内皮细胞株ECV304用含10%胎牛血清、100 u/mL青霉素和100 u/mL硫酸链霉素的DMEM培养液继续培养,置于37℃、5%CO2培养箱中孵育,当细胞生长至80%融合以上时,用体积分数0.25%胰酶消化后,以1∶2或1∶3传代,传代后第2天换液1次,以后每2~3天换液1次,约 3~4 d可长成单层细胞。实验分组:取对数生长期细胞,随机分为对照组(培养基),ox-LDL组(培养基中加入终浓度为50 mg/L的ox-LDL后继续培养24 h)、银杏黄酮苷元浓度效应组(GA6.25、12.5、25、50 mg/L预先培养48 h,然后加入终浓度为50 mg/L的ox-LDL培养24 h),银杏黄酮苷元时间效应组(GA 25 mg/L预先分别作用6、12、24 h后,加入终浓度为 50 mg/L的ox-LDL培养24 h),LOX-1拮抗剂组(PIA250 mg/L预先作用2 h后,加入终浓度为50 mg/L的 ox-LDL培养24 h)。
1.3 内皮细胞形态学观察 相差显微镜观察各组细胞形态变化。
1.4 M CP-1和LOX-1mRNA测定 样品总RNA提取采用Trizol试剂盒,操作按试剂盒说明进行。A260/A280测定RNA浓度和纯度。采用二步法逆转录试剂盒,将RNA逆转录成cDNA作为模板进行扩增。PCR反应条件均为94℃预变形5 min,94℃变性30~40 s,55.4~60.5℃退火40 s,72℃延伸1 min,循环40次,最后72℃延伸 10 min,反应终产物立即进行电泳跑胶,用凝胶图像分析扫描、电泳结果并照相,测定各条带吸光度值。以恒定表达的β-actin mRNA作为内参进行校正,计算相对表达量。实验重复3次。
1.5 MCP-1蛋白表达测定 采用ELISA法检测。常规消化细胞,将等量细胞悬液分别接种于24孔培养板上,调整细胞浓度为5×105个/孔,待细胞长成单层贴壁后,按上述试验分组,达作用时间之后,取细胞培养上清液离心,再收集上清液置于-20℃保存,然后按试剂盒说明操作。置于酶标仪在450 nm处测定OD值,并记录结果(每组设6个复孔)。
1.6 LOX-1蛋白表达测定 采用SP免疫组化法检测。用特异性兔抗人 LOX-1多克隆抗体进行细胞免疫组化鉴定,以PBS代替一抗作阴性对照,于显微镜下观察并计数,以胞浆和胞膜着色为棕黄或棕褐色颗粒为LOX-1蛋白表达阳性细胞,计数阳性细胞数和染色强度累计积分,结果以均数表示。
1.7 统计学方法 采用SPSS11.5统计学软件进行分析,数据以表示,多组间比较进行方差齐性检验和单因素方差分析(one-way ANOVA),P<0.05表示差异有统计学意义。
2 结 果
2.1 人脐静脉内皮细胞株ECV304细胞形态观察 与对照组比较,银杏黄酮苷元(≤50 mg/L)对 ECV304生长无影响,细胞贴壁生长,黏附紧密,呈典型的铺路石样分布。
2.2 银杏黄酮苷元对 ox-LDL诱导的脐静脉内皮细胞株ECV304 MCP-1和LOX-1mRNA表达的影响 通过RT-PCR方法检测各组内皮细胞上M CP-1和LOX-1mRNA水平的表达,结果(图1~3)显示:与对照组比较,ox-LDL可明显上调MCP-1和LOX-1的mRNA表达,差异有统计学意义(P<0.05)。用GA预处理48 h后,在6.25~50 mg/L浓度范围内,均可显著抑制 ox-LDL诱导内皮细胞MCP-1和 LOX-1 mRNA表达;且此效应25 mg/L组大于12.5 mg/L组及6.25 mg/L组,差异有统计学意义(P<0.05),提示此效应有一定浓度依赖性。
以25 mg/L GA预处理细胞6~24 h,均可显著抑制ox-LDL诱导细胞MCP-1、LOX-1mRNA表达,差异有统计学意义(P<0.05)。药物效应24 h组大于12 h和6 h组,差异有统计学意义(P<0.05),而 12 h和6 h组之间差异无统计学意义(P>0.05),提示GA与细胞作用6 h后即可发挥抑制MCP-1和LOX-1mRNA表达的作用,该作用在 24 h时较强。用LOX-1阻断剂 PIA对细胞进行预处理2 h,可显著抑制ox-LDL诱导的内皮细胞MCP-1和LOX-1mRNA表达。

图1 各组MCP-1和LOX-1基因的RT-PCR结果

图2 GA对ox-LDL诱导内皮细胞MCP-1表达的影响
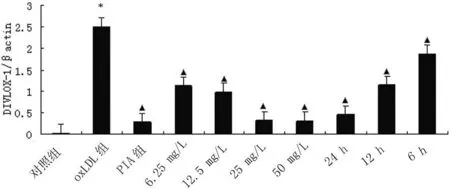
图3 GA对ox-LDL诱导内皮细胞LOX-1基因表达的影响
2.3 银杏黄酮苷元对ox-LDL诱导的内皮细胞MCP-1蛋白表达的影响 ELISA法检测各组细胞MCP-1蛋白表达量,结果(图4)显示,ox-LDL作用后,细胞上清液MCP-1的表达量显著升高,差异有统计学意义(P<0.01)。用GA预处理48 h后,在6.25~50 mg/L终浓度范围内,可显著抑制ox-LDL引起的内皮细胞MCP-1的分泌,效应有一定的浓度依赖关系,差异有统计学意义(P<0.05);用终浓度25 mg/L的 GA预处理6~24 h,可显著抑制ox-LDL引起的MCP-1分泌,呈时间依赖关系,差异有统计学意义(P<0.01)。
2.4 银杏黄酮苷元对ox-LDL诱导的内皮细胞LOX-1蛋白表达的影响 通过SP免疫组化法检测各组细胞LOX-1蛋白表达量,结果(封2图5、表1)表明:经 ox-LDL作用后,内皮细胞LOX-1蛋白被大量地诱导表达,与对照组相比,差异有统计学意义(P<0.05)。分别用终浓度25 mg/LGA预处理48 h和250 mg/L LOX-1受体阻断剂PIA预处理2 h,均可完全阻断ox-LDL诱导内皮细胞 LOX-1蛋白过量表达与ox-LDL组比较,差异有统计学意义(P<0.05);与对照组比较,差异无统计学意义(P>0.05)。
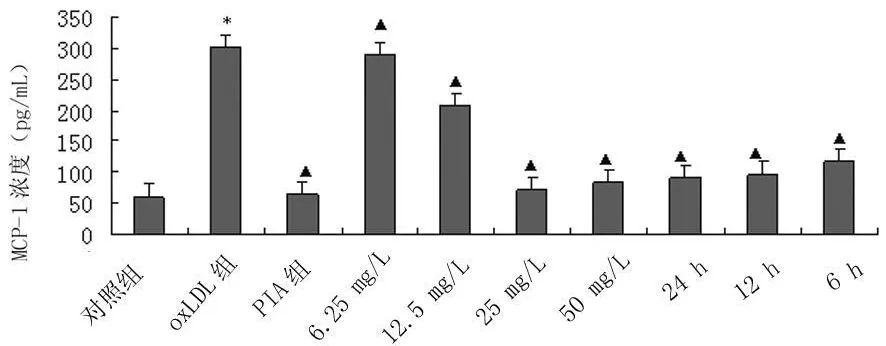
图4 GA对内皮细胞oxLDL诱导内皮细胞MCP-1蛋白表达的影响
表1 GA对ox-LDL诱导内皮细胞LOX-1蛋白表达的影响

表1 GA对ox-LDL诱导内皮细胞LOX-1蛋白表达的影响
*:与对照组比较,P<0.01;#:与ox-LDL组比较,P<0.01。
组别 LOX-1蛋白含量对照组(0 mg/L) 7.6±0.8944 ox-LDL 14.6±1.6733*PIA 7.6±1.5166b#G A(25 mg/L) 8.2±0.8367b#
3 讨 论
MCP-1作为一种强有力的趋化因子,促进循环中的单核细胞聚集于血管内皮间隙,并促进单核细胞清道夫受体表达,进而摄取脂质,转变为泡沫细胞,成为AS发生的早期事件。ox-LDL是目前公认的致AS的重要危险因子,导致血管内皮细胞功能紊乱,合成和分泌大量黏附分子和趋化因子[3]。研究认为内皮细胞通过其表面受体LOX-1吞噬和降解ox-LDL是其功能发生障碍的主要原因。
近年来GBE在AS防治方面的基础研究取得了一定的进展。研究发现GBE增加循环内皮祖细胞端粒酶活性,抑制过氧化氢所致内皮细胞凋亡蛋白3活性,促进内皮祖细胞增殖,从而促进内皮细胞增殖和修复[4-5];干预内皮细胞损伤后一氧化氮合酶的表达,改善内皮功能[6-7];对AS大鼠致炎细胞因子白细胞介素-1β、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)表达显著抑制,对抗炎细胞因子白细胞介素-10及其受体表达显著上调[8]。
本研究发现,GA可显著抑制ox-LDL诱导的内皮细胞MCP-1表达,且该效应在6.25~25 mg/L范围内,具有一定的浓度和时间效应关系。提示GA可能通过影响内皮细胞MCP-1表达,减少或预防ox-LDL所致的内皮细胞黏附功能紊乱。而GA和LOX-1受体阻断剂PIA干预LOX-1表达的同时,阻断了MCP-1的异常合成和分泌,提示LOX-1可能作为一种信号分子参与ox-LDL诱导的内皮细胞MCP-1表达的调节过程。LOX-1的表达受多种因素包括ox-LDL、TNF、高同型半胱氨酸等调节,这些物质均与体内氧化应激相关。核因子-κ B(nuclear factor-κ B,NF-κ B)和激活蛋白-1(activator protein-1,AP-1)是调节真核生物氧化还原反应的重要转录蛋白,在AS氧化应激病理过程中发挥重要作用。研究表明,LOX-1基因启动子上存在NF-κ B和AP-1结合位点,而本研究中 GA黄酮含量高达42.79%,黄酮类物质是天然抗氧化物家族中的重要成员之一,能有效清除超氧阴离子、羟自由基、一氧化氮等。Chen等[9]研究显示,GBE可以下调内皮细胞中活性氧族生成,抑制 NF-κ B、AP-1表达。提示GA可能通过干预氧化应激造成的内皮细胞LOX-1上调而抑制MCP-1表达。
因此,银杏黄酮苷元作为一种新型银杏叶提取物,能够显著下调ox-LDL诱导的内皮细胞LOX-1表达,从而抑制MCP-1的异常合成和分泌,改善内皮细胞黏附功能,发挥抗动脉粥样硬化作用。
[1] Vita JA,Keaney JF Jr.Endothelial function:a barometer for cardiovascular risks?[J].Circulation,2002,106(6):640.
[2] Mehta JL,Li DY.Identification,regulation and function of a novel lectin-like oxidized low-density lipoprotein receptor[J].J Am Coll Cardiol,2002,39(9):1429.
[3] 高凌云,何作云,李福平.心脉神口服液对氧化型低密度脂蛋白介导的内皮细胞ICAM-1表达变化的影响[J].重庆医学,2003,32(1):6.
[4] Hill JM,Zalos G,Halcox JP,et al.Circulating endothelial progenitor cells,vascular function,and cardiovascular risk[J].N Engl J M ed,2003,348(7):581.
[5] Dong XX,Hui ZJ,Xiang WX.Ginkgo biloba extract reduces endothelial progenitor-cell senescence through augmentation of telomerase activity[J].J Cardiovasc Pharmacol,2007,49(2):111.
[6] 刘军须,张敬各.银杏叶提取物对同型半胱氨酸致血管内皮细胞损伤的保护作用[J].中药药理与临床,2007,23(3):52.
[7] 张金霞,胡涛,田琼,等.银杏叶提取物对培养的人脐静脉内皮细胞结构型一氧化氮合酶的影响[J].心脏杂志,2001,13(3):214.
[8] Jiao YB,Rui YC,Li TJ,et al.Expression of pro-inflammatory and anti-inflammaatory cytokines in brain of atherosclerotic rats and effects of ginkgo biloba extract[J].Acta Pharmacol Sin,2005,26(7):835.
[9] Chen JW,Chen YH,Lin FY,et al.Ginkgo biloba extract inhibits tumor necrosis factor-α-induced reactive oxygen species gneration,transcription factor activation,and cell adhesion molecule expression in human aortic endothelial cells[J].Arterioscler Thromb Vasc Biol,2003,23(9):1559.

