日粮不同NFC/NDF比对奶山羊瘤胃pH、挥发性脂肪酸及乳酸含量的影响
胡红莲 卢德勋 刘大程 珊 丹 李胜利 张春华 石 岩
(1.内蒙古农牧业科学院动物营养研究所,呼和浩特010030;2.内蒙古农业大学动物科学与医学学院,呼和浩特010018)
随着饲养集约化程度的不断加强和对产奶量要求的提高,使得亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA)成为现代奶业中危害最大,最常见的疾病之一,造成了不可估量的经济损失,已引起了营养学界极大的关注。大量研究表明,无论是急性瘤胃酸中毒还是SARA其发生的根本原因是动物采食过量或大量的易发酵碳水化合物饲料。大多数研究者均采用精粗比进行量化研究,肖训军[1]报道精料水平为70%时诱发绵羊发生SARA;常影[2]报道当精料水平达 80%时,诱导阉牛发生SARA。然而日粮精粗比这一指标较为笼统,只能粗略而不能精准地说明日粮中易发酵碳水化合物的真正含量和营养物质之间相互平衡,因为不论是精料还是粗料各自都包括可发酵碳水化合物和纤维物质,只是比例和含量不同而已。因此,当日粮精粗比上升引起瘤胃pH下降时,就很难判断究竟是由于NFC还是易消化纤维过多造成的。非纤维性碳水化合物(non-fiber carbohydrate,NFC)包括日粮中极易发酵的碳水化合物部分如淀粉、糖、果胶和有机酸等在内,能够较为全面体现日粮中易发酵碳水化合物的含量,中性洗涤纤维(neutral detergent fiber,NDF)则能全面体现日粮中纤维物质含量。迄今为止,日粮易发酵碳水化合物的摄入量究竟达到多大时才能引起反刍动物发生SARA,改变瘤胃发酵模式,还鲜有报道,因此有必要对此进行研究。
1 材料与方法
1.1 试验动物及日粮
选用6只体重30~35 kg的泌乳初期经产关中奶山羊,安装永久性瘤胃瘘管。试验日粮参照NRC(1981)[3]奶山羊饲养标准,并结合我国奶山羊饲养标准[4]配制,以玉米、豆粕、麦麸、青干草为主要原料,按照日粮中NFC与NDF比例的不同分为Ⅰ、Ⅱ、Ⅲ、Ⅳ4组(分 4期进行试验),其NFC/NDF比分别为1.02、1.24、1.63、2.58。日粮组成及营养水平见表1。
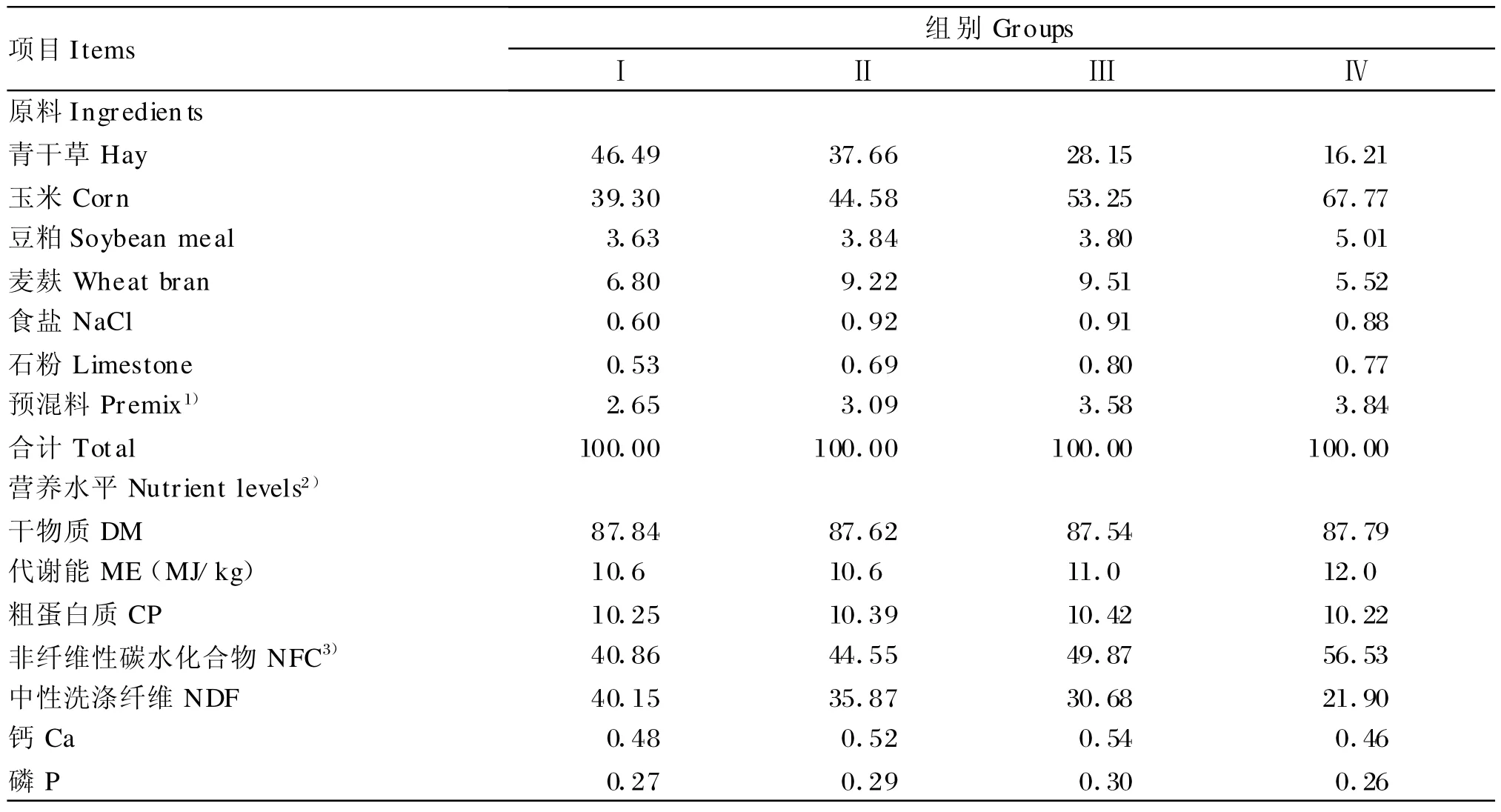
表1 日粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the diets (air-dry basis,%)
1.2 试验设计与饲养管理
采用自身对照试验设计,试验动物依次饲喂NFC/NDF比分别为 1.02(Ⅰ期)、1.24(Ⅱ期)、1.63(Ⅲ期)、2.58(Ⅳ期)的4种日粮(即Ⅰ、Ⅱ、Ⅲ和Ⅳ组),每期 10 d,包括7 d预试期和 3 d正试期。试验动物单笼饲养,先喂粗料后喂精料,日喂2次(分别在06:00和18:00),自由饮水。
1.3 样品采集与分析测定
1.3.1 瘤胃液的采集与分析测定
每个采样期分别在饲喂前(0 h)及采食后3、6、9和12 h采集瘤胃液,每次采集20 mL,用4层纱布过滤,滤液经3 500 r/min离心 10 min,取4 mL上清液加到装有1 mL 25%偏磷酸的样品瓶中用于测定挥发性脂肪酸(volatile fatty acid,VFA),其余上清液留样备测乳酸,于-20℃冷冻保存。VFA采用GC-7A气相色谱仪测定(检测器:FID;色谱柱:柱长2 m、内径3 mm的不锈钢柱;测定条件:柱温150℃,汽化室温度230℃,空气压力0.35 kg/cm2,空气流速140 mL/min,氢气压力1.2 kg/cm2,氢气流速14 mL/min,氮气(载气)流速 55 mL/min,进样量1 μ L)。乳酸测定方法参照文献[1]。
1.3.2 血液的采集与分析测定
每个采样期最后1天分别于饲喂前(0 h)及采食后3、6、9和12 h采集试验羊颈静脉血10 mL,肝素锂抗凝,2 000 r/min离心10 min,制取血浆,吸取血浆1 mL,缓慢加入到装有8 mL蒸馏水的锥形瓶,再加入0.333 mol/L硫酸溶液 0.5 mL,静置使其酸化完全再加入10%钨酸钠溶液0.5 mL,2 500 r/min离心10 min,制得无蛋白血滤液,然后上机测定VFA含量。
1.3.3 瘤胃pH实时监测
采用动态pH连续监测记录系统对测试期每日pH进行24 h动态监测。动态pH连续监测记录系统主要由pH电极(450 CD,美国Sensorex有限公司生产)、pH变送器(692型,美国Jenco有限公司生产)和无纸记录仪(R4100型,浙大中控仪表有限公司生产)3部分组成。设定每隔5 s显示1次pH,每隔10 min记录1次pH,将每日所采集的pH数据运用Excel进行处理分析。
1.4 数据处理
采用SPSS 11.5版统计软件中One-way ANOVA过程进行方差分析,并采用Duncan氏法进行多重比较。结果以平均值±标准误来表示。
2 结 果
2.1 日粮不同NFC/NDF比对奶山羊瘤胃pH的影响
由图1和表2可知,瘤胃pH与采食时间呈曲线变化,各期饲喂前瘤胃pH均较高,采食后3~6 h瘤胃pH达到最低值。同一日粮不同时间点pH随着采食后时间推移逐渐下降,于3~6 h降到最低值,而后又逐渐上升,周而复始随采食时间呈周期性动态变化。不同日粮同一时间点pH变化基本趋势为Ⅳ期最低,Ⅲ期低于Ⅱ期和Ⅰ期。随着日粮NFC含量增加,瘤胃pH下降速率和幅度随之加大,瘤胃pH平均值、最低值、最大值随着日粮NFC/NDF比的增加而呈降低趋势,日粮NFC/NDF比的增加对瘤胃pH<5.2持续时间没有显著差异(P>0.05),但对瘤胃pH<5.8和6.0持续时间有显著的影响(P<0.05),瘤胃pH<5.5持续时间Ⅳ期显著高于Ⅰ 、Ⅱ、Ⅲ期(P<0.05),Ⅰ、Ⅱ、Ⅲ期之间没有显著差异(P>0.05)。同一日粮不同pH持续时间随pH下降而降低,而不同日粮同一pH持续时间随日粮NFC/NDF比的增加而增加。
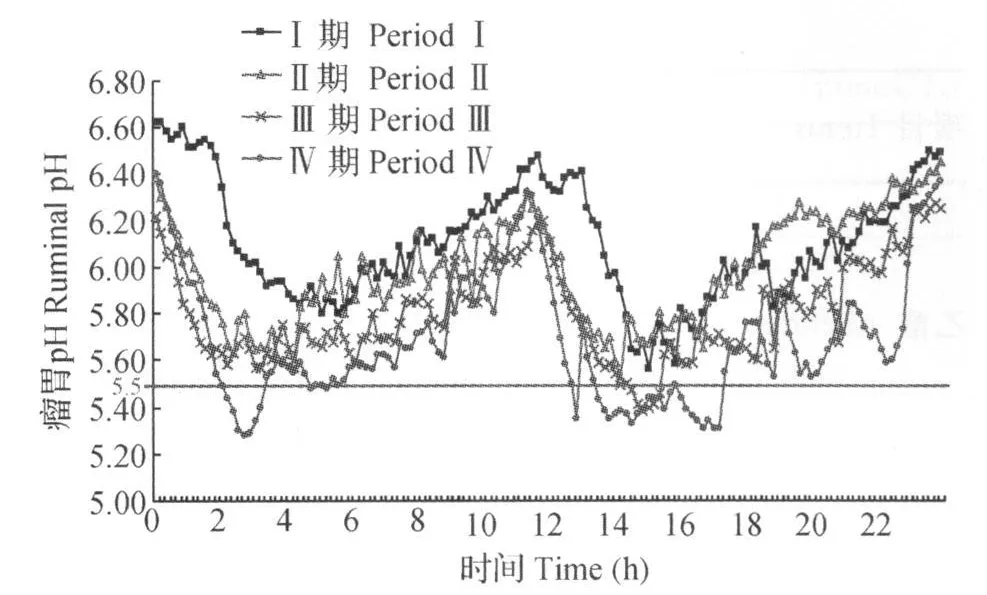
图1 日粮不同NFC/NDF比对奶山羊瘤胃pH动态变化的影响Fig.1 Effects of different dietary NFC/NDF ratios on ruminal pH dynamics in dairy goats
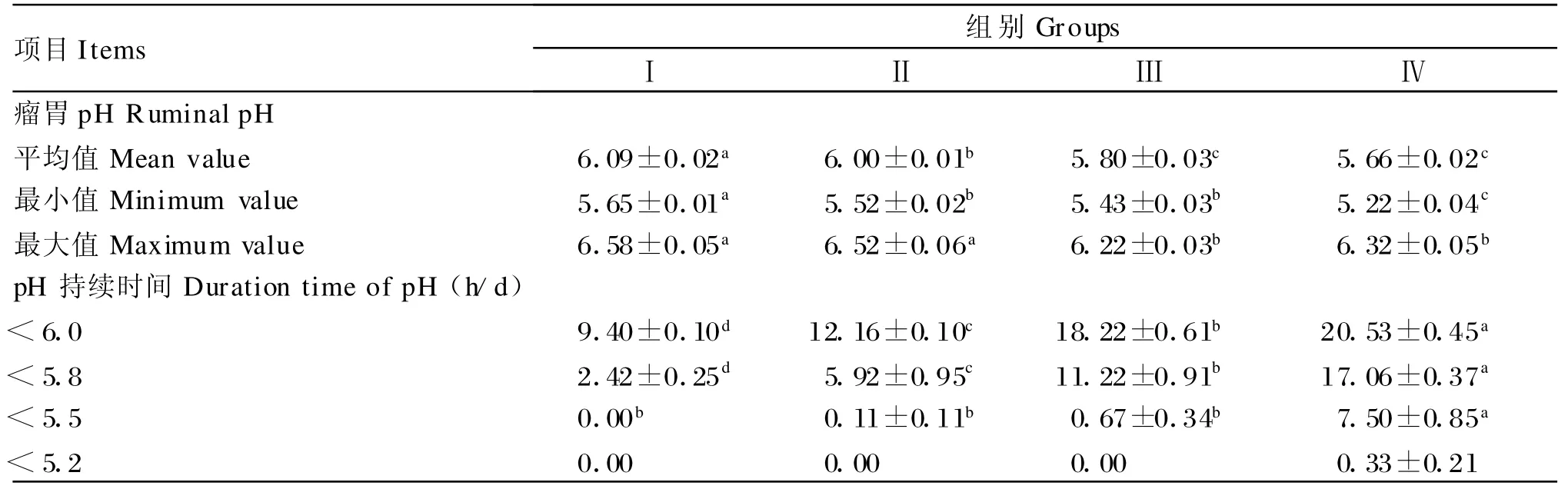
表2 日粮不同NFC/NDF比对奶山羊瘤胃pH最大值、最小值、平均值及pH低于6.0、5.8、5.5、5.2 持续时间的影响Table 2 Effects of different dietary NFC/NDF ratios on ruminal maximum,minimum,mean values of pH and duration time when pH under 6.0,5.8,5.5 and 5.2 in dairy goats
2.2 日粮不同NFC/NDF比对奶山羊瘤胃VFA及乳酸含量的影响
由表3可知,随着日粮NFC/NDF比的提高,瘤胃总挥发性脂肪酸(total volatile fatty acid,TVFA)、丙酸和丁酸含量均呈现增加趋势,Ⅳ期达到最高值,显著高于Ⅰ、Ⅱ、Ⅲ期(P<0.05);丙酸和丁酸含量在Ⅰ、Ⅱ、Ⅲ期之间没有显著差异(P>0.05);TVFA 含量除采食后3、6、12 h,Ⅰ 、Ⅱ 、Ⅲ期之间没有显著差异(P>0.05)。乙酸含量和A/P变化是随着日粮NFC/NDF比的提高而呈现先增加后降低的趋势,乙酸含量和A/P以Ⅳ期最低,显著低于Ⅰ、Ⅱ、Ⅲ期(P<0.05),Ⅱ期乙酸含量和A/P最高,乙酸含量除采食后3、6、12 h,A/P 除采食后3、12 h外,其他时间点在Ⅰ、Ⅱ、Ⅲ期之间差异不显著(P>0.05)。同一日粮,瘤胃乙酸、丙酸、丁酸及TVFA含量随采食时间呈现先升高后下降趋势,于采食后3~6 h达到其峰值。Ⅰ、Ⅱ、Ⅲ期未检测到乳酸,Ⅳ期虽检测到乳酸,但其含量较低,不同时间点均低于 0.1 mmol/L,且差异不显著(P>0.05)。
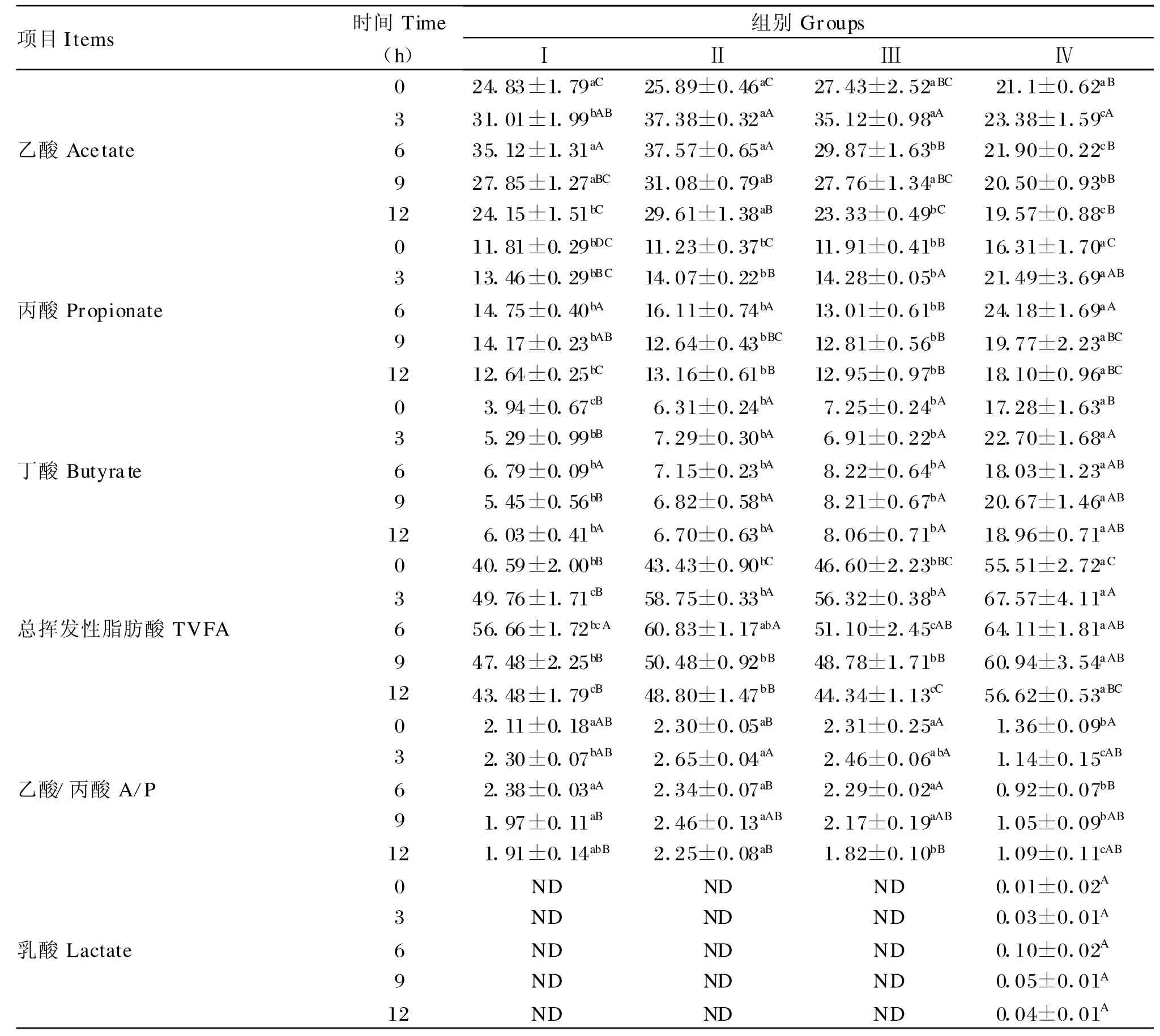
表3 日粮不同NFC/NDF比对奶山羊瘤胃VFA及乳酸含量的影响Table 3 Effects of different dietary NFC/NDF ratios on ruminal VFA and lactate content in dairy goats(mmol/L)
2.3 日粮不同 NFC/NDF比对奶山羊血浆VFA含量的影响
由表4可知,血浆乙酸、丙酸、丁酸及TVFA含量都呈现出随日粮NFC/NDF比提高而增加的趋势。在0~3 h,日粮NFC/NDF比提高对血浆乙酸含量没有显著影响(P>0.05),在采食后6~9 h,Ⅳ期乙酸含量显著高于Ⅰ、Ⅱ、Ⅲ期(P<0.05),但Ⅰ、Ⅱ、Ⅲ期之间无显著差异(P>0.05);Ⅰ 、Ⅱ、Ⅲ期日粮NFC/NDF比对血浆丙酸和TVFA含量无显著影响(P>0.05),Ⅳ期达到了最高值,显著高于Ⅰ、Ⅱ、Ⅲ期(P<0.05);血浆丁酸含量随着日粮NFC/NDF比提高而有所提高,但差异不显著(P>0.05)。在同一日粮情况下,血浆乙酸、丙酸、丁酸及TVFA含量均随采食时间呈现先升高后下降的趋势,于采食后6 h达到其峰值。
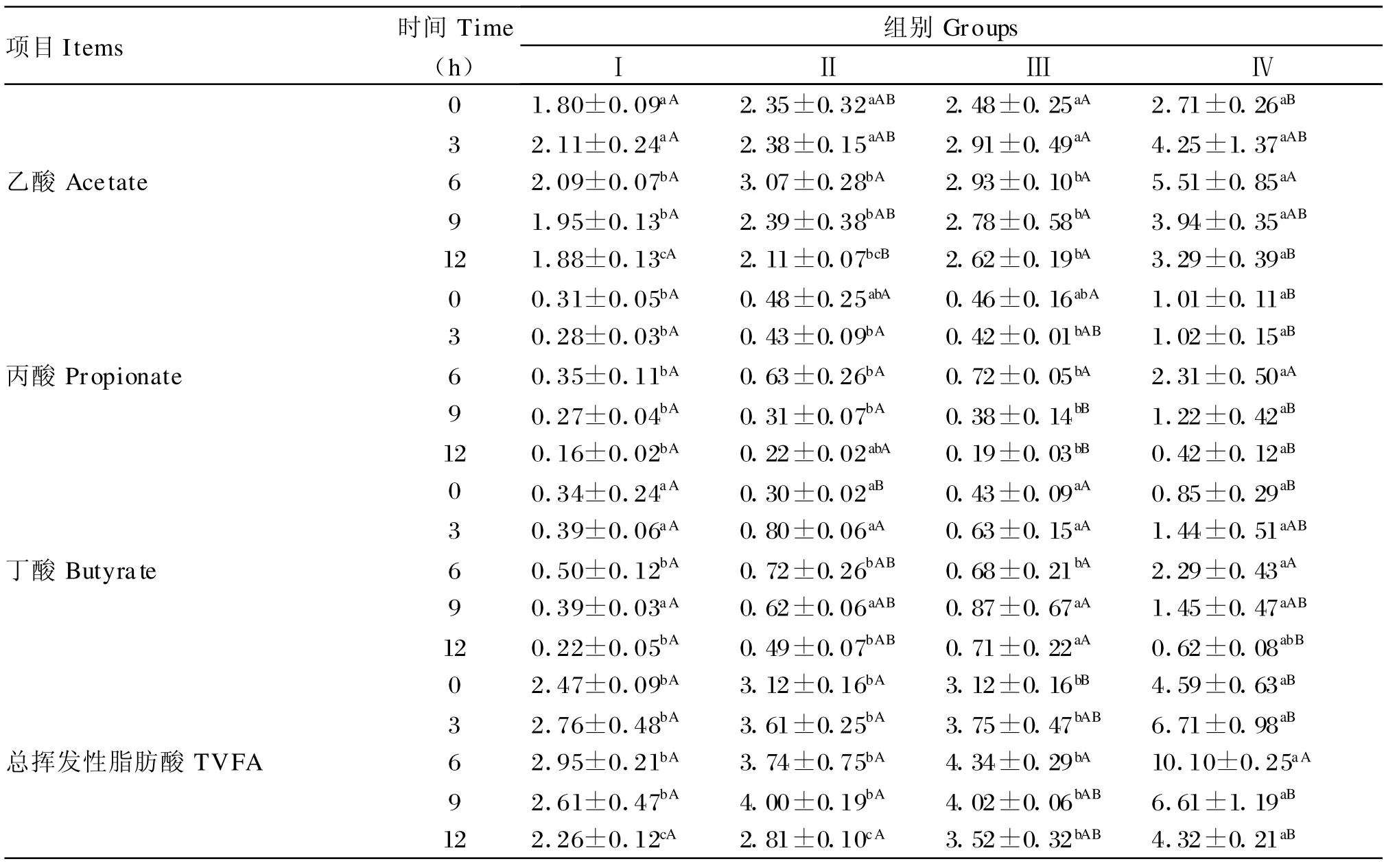
表4 日粮不同NFC/NDF比对奶山羊血浆VFA含量的影响Table 4 Effects of different dietary NFC/NDF ratios on plasma VFA content in dairy goats (mmol/L)
3 讨 论
3.1 日粮不同NFC/NDF比对奶山羊瘤胃pH的影响
瘤胃pH是一项反映瘤胃发酵水平最基本、最重要的指标之一,是瘤胃发酵的“引领者”,对维持瘤胃内环境相对恒定起到了主导作用。影响瘤胃pH的因素很多,主要包括日粮性质、唾液分泌量、有机酸生成、吸收和排出速度等等,但其波动的根本原因则是日粮结构与营养水平[5]。本试验结果表明,瘤胃pH下降速率和下降幅度随着日粮NFC/NDF比的增大而随之加大,Ⅳ期表现最为突出,采食后短时间内呈线性下降,各时间点pH均显著低于前3期(P<0.05),瘤胃pH最低值不仅出现时间较早,其值也显著低于前3期(P<0.05),这说明瘤胃pH波动幅度随着日粮NFC/NDF比的增大而明显加大(表2)。随着日粮NFC/NDF比的增大,瘤胃pH均值从6.09降至5.66(P<0.05),最大值从6.58降至6.22(P<0.05),最低值则从5.65降至5.22(P <0.05);不仅如此,瘤胃 pH 低于 5.2、5.5、5.8和6.0所持续时间也在逐渐延长,即瘤胃pH<6.0持续时间分别为 9.40、12.16、18.22和20.53 h/d,瘤胃pH<5.8持续时间分别为2.42、5.92、11.22和17.06 h/d,瘤胃pH<5.5持续时间分别则为0、0.11、0.67和7.50 h/d,这些数据表明日粮结构对瘤胃pH产生了显著的影响。Nocek等[6]研究表明,瘤胃pH下降速率、幅度以及最低值所持续的时间均随日粮谷物含量的增加而增加,本试验数据与此结论一致。
瘤胃pH也是衡量瘤胃酸中毒程度的关键指标[6],目前大多数研究者将5.2作为衡量急性瘤胃酸中毒发生时pH阈值[7-8],而SARA发生时pH阈值却存在较大分歧,主要集中于 6.0[9]、5.8[10]、5.5[11]。最新研究常以瘤胃pH平均值、最低值以及低于某个阈值所持续时间和曲线面积大小来判断SARA的严重程度[7-8],但这些阈值所持续的时间目前还没有一个统一标准。在本研究中,瘤胃pH低于6.0、5.8、5.5的持续时间及曲线面积随着日粮NFC/NDF比的增加而增加,进入Ⅱ期每日有12 h/d以上时间瘤胃处于pH<6.0的酸性环境,pH<5.8长达5.92 h/d,Ⅲ期每日pH<6.0长达18 h/d以上,pH<5.8也长达 11 h/d以上。Keunen等[12]报道,奶牛处于 SARA状态,瘤胃 pH<6.0长达10.5 h以上,若以6.0或5.8作为SARA发生时pH阈值,本研究进入Ⅱ期就意味着试验动物发生SARA,然而本研究中试验动物在Ⅱ期乃至Ⅲ期均处于健康状态,采食正常,无任何亚健康迹象,可见,从本研究结果判断,6.0或5.8均不宜作为判定SARA发生的pH临界阈值。本研究进入Ⅳ期试验动物才表现出明显的SARA临床症状:精神萎靡,反刍次数明显减少,排尿、排粪量减少,且粪便稀软多呈团状,甚至出现拉稀现象,而且采食量出现较大的波动,刚开始2天其采食量仍较高,达到1.08 kg/d[13],随后几天急剧下降,甚至个别试验动物出现了拒食。此时瘤胃pH在5.5~5.2之间持续时间长达7 h/d以上,但没有持续下降到5.2水平以下,瘤胃pH低于5.5的曲线面积也由 0增加到1.09,这表明将5.5和5.2作为SARA发生时瘤胃pH临界阈值上限和下限更为准确。基于本研究结果,当瘤胃pH在5.5~5.2之间波动时间持续长达7 h/d以上,pH<5.5曲线面积大于1 pH◦h时,标志着动物处于SARA状态。
3.2 日粮不同NFC/NDF比对奶山羊瘤胃和血液VFA及乳酸含量的影响
VFA含量是瘤胃发酵的主要指标之一,影响其含量变化的最根本因素之一也是日粮结构。本研究中,随着日粮NFC/NDF比的增加,瘤胃乙酸含量呈现降低的趋势,而丙酸、丁酸及TVFA含量呈现出增加的趋势,当日粮NFC/NDF比达2.58时,瘤胃乙酸含量、A/P显著降低(P<0.05),丙酸、丁酸和TVFA含量显著增加(P<0.05),其中丁酸含量增幅最大,这说明NFC含量的变化可以改变瘤胃发酵类型。一般来说在高精料日粮条件下发酵应为明显的丙酸型,但在本次试验中虽然A/P的比值有所下降,但并未呈现出明显的丙酸型,而丁酸显著增加成为显著特征。这可能说明丁酸与亚急性酸中毒发展进程密切相关。有研究指出,丁酸酸中毒可能是亚急性酸中毒和急性酸中毒的过渡阶段[2]。
血浆中的VFA主要由瘤胃发酵产生的VFA经瘤胃壁吸收而来的,本研究中血浆中TVFA含量及其各组分含量的变化均随日粮NFC/NDF比的增加而呈现增加的趋势,这说明日粮结构变化对血浆TVFA含量有着一定的影响。在本研究中血浆TVFA含量是随瘤胃TVFA含量的增加而增加,但血浆乙酸含量与瘤胃乙酸含量变化趋势恰好相反,其原因还有待于研究。
乳酸是瘤胃微生物利用底物发酵产生的另一种酸性物质。在正常瘤胃发酵状态下,乳酸并不是瘤胃发酵的一种重要中间产物,也不被吸收[14]。许多以往的研究证实,当瘤胃发酵异常时,瘤胃乳酸含量增加是导致急性瘤胃酸中毒的直接原因,但在SARA发病中的作用却报道不一。一些研究表明反刍动物发生亚急性酸中毒时乳酸累积高达50 mmol/L[15],但另一些研究表明瘤胃乳酸含量较低,不会超过10 mmol/L[12]或根本不存在[16]。本研究中当日粮NFC/NDF比达2.58时,瘤胃中才检测到乳酸存在,但其含量很低,低于0.1 mmol/L,这与肖训军[1]对绵羊研究的结果相近。乳酸的酸度(pKa=3.1)是 VFA 酸度(pKa=4.8)的 10倍,可见,乳酸虽然是强酸,但因其含量较低不足以使瘤胃pH显著下降。这说明随着日粮NFC/NDF比增加,瘤胃pH下降主要源于瘤胃TVFA增多,瘤胃TVFA含量增多是本研究奶山羊发生SARA的主要原因,而非乳酸。
4 结 论
①随着日粮NFC/NDF比的增加,瘤胃pH下降主要源于瘤胃TVFA增多,而非乳酸。
②当日粮NFC/NDF比达2.58,即NFC摄入量为610.5 g,NDF摄入量为236.6 g时,奶山羊发生SARA。
[1] 肖训军.毛茛科植物提取物对饲喂高碳水化合物饲粮反刍动物瘤胃发酵的影响[D].硕士学位论文.北京:中国农业大学,2001.
[2] 常 影.阉牛亚急性瘤胃酸中毒发病机理和饲喂高油玉米籽粒缓解效果的研究[D].博士学位论文.北京:中国农业大学,2006.
[3] NRC.Nutrient Requirements of Goats:Angora,dairy and meat goats in temperate and tropical countries[S].Washington,D.C.:National Academy Press,1981.
[4] 金公亮.奶山羊饲养标准[J].畜牧兽医杂志,1989,2:7-12.
[5] 赵国琦,贾亚红,陈小莲,等.不同NDF/NFE比的日粮对山羊瘤胃发酵参数影响的研究[J].中国畜牧杂志,2006,42(13):29-33.
[6] Nocek J E,Allman J G,Kautz W P.Evaluation of an indwelling ruminal probe methodology and effect of grain level on diurnal pH variation in dairy cattle[J].Journal of Dairy Science,2002,85:422-428.
[7] Darren W B.Effect of the number of step-up diets fed during grain adaptation on acidosis and feeding behaviour of feedlot cattle[D].Master degree thesis.Saskatoon:The University of Saskatchewan,2005.
[8] Penner G B,Beauchemin K A,Mutsvangwa T.Severity of ruminal acidosis in primiparous Holstein cows during the periparturient period[J].Journal of Dairy Science,2007,90:365-375.
[9] Bauer M L,Herold D W,Britton R A,et al.Efficacy of laidlomycin propionate to reduce ruminal acidosis in cattle[J].Journal of Dairy Science,1995,73:3 445-3 454.
[10] Yang W Z,Beauchemin K A.Effects of physically effective fiber on chewing activity and ruminal pH of dairy cows fed diets based on barley silage[J].Journal of Dairy Science,2006,89:217-228.
[11] Enemark J M D ,Jø rgensen R J,Enemark P S.Rumen acidosis with special emphasis on diagnostic aspects of sub clinical rumen acidosis:A review[J].Veterinarijair Zootechnika,2002,20:16-29.
[12] Keunen J E,Plaizier J C,Kyriazakis L,et al.Effects of a subacute ruminal acidosis model on the diet selection of dairy cows[J].Journal of Dairy Science,2002,85(12):3 304-3 313.
[13] 胡红莲.奶山羊亚急性瘤胃酸中毒营养生理机制的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2008.
[14] 段得贤,贺信恒,曹光荣.奶山羊过食谷物中毒的研究[J].西北农学院学报,1981,3:21-33.
[15] Horn G W,Gordon J L,Prigge E C,et al.Dietary buffers and ruminal and blood parameters of subclinical lactic acidosis in steers[J].Journal of Animal Science,1979,48:683-691.
[16] Beauchemin K A,Yang W Z,Rode L M.Effects of particle size of alfalfa-based dairy cow diets on chewing activity,ruminal fermentation,and milk production[J].Journal of Dairy Science,2003,86:630-643.
