糖尿病大鼠来源骨髓间充质干细胞体外培养观察及其生物学特性
金培峰,张浩,郑亮承,蒋成榜,孙成超
(1.温州医学院附属第一医院 心胸外科,浙江 温州 325000;2.中国医学科学院阜外心血管病医院 卫生部心血管疾病再生医学重点实验室,北京 100037)
干细胞治疗心肌梗死已被证实是一种较有前景的治疗方法。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)由于具有取材容易、体外增殖能力强、低免疫原性、可分化为不同类型的成熟细胞等优点[1-2],成为最佳的移植细胞来源。但是和其他体细胞类似,BMSCs也易受各种因素如:年龄、氧化应激和高糖[3-4]等的影响而导致其生物学性状改变。
糖尿病患者复杂的体内环境,包括长期的高血糖、高血脂、酮体的增多、活性氧等,势必会对自身体内的BMSCs产生影响[5-6]。目前国内外在干细胞治疗心梗的研究中,大多采用正常或者年轻的BMSCs作为移植细胞来源。为了确定糖尿病体内环境对BMSCs的影响以及其能否作为自体移植的细胞来源,我们将以糖尿病大鼠来源的BMSCs作为研究对象,在体外培养条件下进行一系列的生物学特性检测,就此问题进行初步探讨。
1 材料和方法
1.1 动物 220g Spraque Dawley(SD)大鼠由温州医学院实验动物中心提供,所有研究都经温州医学院实验动物委员会批准。
1.2 主要试剂 DMEM、胰蛋白酶、胎牛血清购自Gibco公司;链脲佐菌素(STZ)、Hoechst 33342购自Sigma公司;细胞低氧培养盒、缺氧催化剂购自BioM6rieux-sa(France);膜联蛋白(annexin)-V FITC细胞凋亡检测试剂盒购自北京宝赛生物公司;酶联免疫吸附试验(ELISA)试剂盒购自R&D公司。
1.3 糖尿病大鼠模型的制备 12只健康的SD大鼠随机平均分为两组,分别为糖尿病组和正常对照组。两组大鼠在禁食12h后分别予单次腹腔注射STZ柠檬酸缓冲液(55mg/kg)和柠檬酸缓冲液。3 d后剪尾静脉测血糖,以>16.67 mmol/L视为糖尿病模型成功,腹腔注射后3周复测1次尾静脉血糖和体重,以确保血糖浓度>16.67 mmol/L。糖尿病模型合格的和正常对照组大鼠继续饲养10周,为下面实验做准备。
1.4 骨髓间充质干细胞的分离和培养 无菌条件下分别剥离糖尿病大鼠和正常对照大鼠的股骨和胫骨[3],以全骨髓贴壁法分离并培养BMSCs,待状态良好的第二代细胞生长达到70%~80%汇合时可用于以下实验。
1.5 细胞增殖能力检测 取生长良好的第二代骨髓间充质干细胞,于96孔板的每个孔中加入100μL细胞悬液,细胞数为1.5×103,培养基每2天更换一次。于细胞接种后的7 d内,每天取5个孔进行检测,每个孔内加入CCK-8试剂10μL,置培养箱内孵育4 h后,用全自动酶标仪检测490 nm(参比波长630 nm)的吸光度值(OD值),取平均值,以培养时间为横坐标,以相应的OD值为纵坐标,描绘生长曲线。
1.6 间充质干细胞凋亡的检测
1.6.1 细胞模拟缺血处理(无血清和低氧联合处理):当第二代细胞生长达到70%~80%汇合时用PBS冲洗2次,加入不含胎牛血清的DMEM培养基,然后迅速将细胞放入密闭低氧罐中,置于37 ℃、5% CO2细胞培养箱内培养6 h。
1.6.2 形态学检测:将进行低氧和无血清处理后的细胞用PBS洗1次,然后加入含Hoechst33342的无血清DMEM培养基,Hoechst33342终浓度为0.1 mg/mL,室温避光反应10 min。用荧光显微镜观察,紫外光激发,观察凋亡细胞并摄片。
1.6.3 流式检测:取经低氧无血清处理的7×105个细胞,用0.125%胰蛋白酶/0.04% EDTA消化细胞后,4 ℃,以800 r/min离心4 min后,弃掉上清液;细胞用PBS冲洗1次后悬浮于200μL结合缓冲液。然后加入10μL 20μg/mL的异硫氰酸荧光素(FITC)标记的膜联蛋白V(膜联蛋白-V-FITC),轻轻混匀后,4 ℃避光反应15 min。加入5μL 50μg/mL的PI,300μL结合缓冲液,轻轻混匀,用流式细胞仪检测活细胞、早期和中晚期凋亡细胞及坏死细胞所占的比例。
1.7 血管内皮生长因子(VEGF)和胰岛素生长因子-1(IGF-1)的ELISA检测 将生长良好的第二代骨髓间充质干细胞用PBS冲洗1次后,添加不含血清DMEM培养基置于37 ℃、5% CO2细胞培养箱内培养6 h后,取上清液备用。按照ELISA试剂盒操作说明书,用双抗体夹心法分别检测细胞培养上清中VEGF和IGF-1的含量,每份标本设3个复孔。用全自动酶标仪测450 nm处吸光度值,取其平均值,根据所绘制的标准曲线计算出各个细胞因子的含量。
1.8 统计学处理方法 采用独立样本t检验。
2 结果
2.1 大鼠BMSCs的培养和增殖能力检测 采用常规细胞原代培养法,成功培养了糖尿病大鼠的BMSCs。相差显微镜下对细胞形态进行了观察,如图1A所示培养的原代细胞呈长梭型,集落生长,中间较密,夹杂着圆形高亮未贴壁的杂细胞,但是糖尿病大鼠的BMSCs所形成的集落较正常大鼠的明显要小,而且贴壁后4~5 d才表现出成纤维样生长特性。细胞传代后,在第1代和第2代细胞生长呈现明显的漩涡状,但是相对于正常大鼠BMSCs饱满的细胞形态,糖尿病大鼠的则表现为细胞伸展无力,且较为扁平。本实验所用细胞均为第2代BMSCs。利用CCK-8检测的结果显示(见图1B),糖尿病来源的骨髓间充质干细胞增殖能力明显较正常来源的低(P<0.01)。

图1 A 在原代中,糖尿病组所形成的细胞集落明显较正常组小,经传代后细胞较正常的扁平并且伸展无力图1B 在第1天和第2天,两组细胞生长并无差异,随时间增长,糖尿病组生长明显较正常的减慢(*P<0.05,**P<0.01)
2.2 VEGF和IGF-1的分泌量 ELISA结果(见图2)显示糖尿病大鼠来源BMSCs的VEGF和IGF-1的分泌量较正常来源的明显降低(分别为P<0.05,P<0.01)。
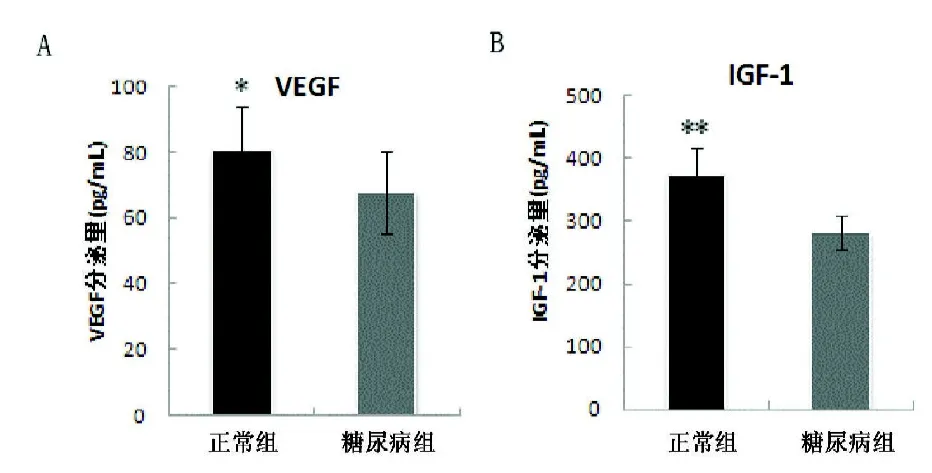
图2 A,2B 糖尿病来源的骨髓间充质干细胞分泌的VEGF和IGF-1的量较正常组显著降低(*P<0.05,**P<0.01)
2.3 细胞凋亡 在缺血无血清联合处理后(图3A),相差显微镜照片可以显示明显的细胞凋亡表征,即胞核皱缩变圆,贴壁细胞数量明显地减少。Hoechst33342染色后,正常细胞核呈弥散均匀的荧光, 而凋亡的细胞, 细胞核与细胞质中可见浓染致密的颗粒荧光, 被认为是典型的凋亡细胞。
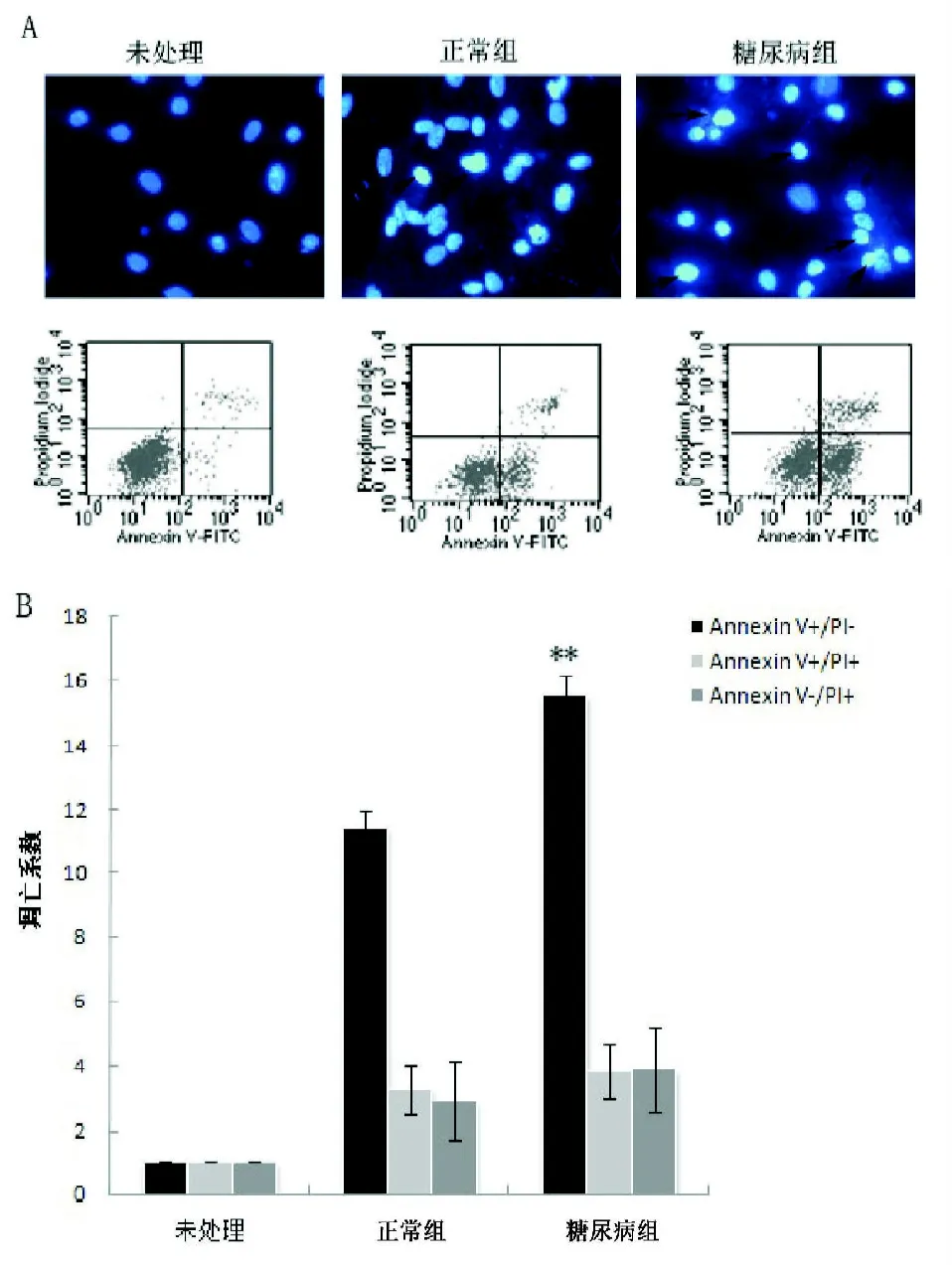
图3 A 凋亡预处理后,经Hoechst33342染色后细胞核为浓染致密的颗粒荧光;图3B示经流式细胞学检测后,糖尿病组凋亡系数较正常组明显增高 (**P<0.01)
2.4 膜联蛋白V/PI双染流式细胞术检测细胞凋亡膜联蛋白 糖尿病来源的BMSCs中早期凋亡细胞(膜联蛋白为V+/PI-)较正常大鼠来源的明显增多(P<0.01,见图3B);中晚期凋亡细胞(V+/PI+)和死亡细胞(V-/PI+)两者差异无显著性(P>0.05)。
3 讨论
随着冠心病发病机制研究的深入,更多的证据表明,作为代谢综合征之一的糖尿病和冠心病的发生有着密切的关系[5]。而糖尿病患者体内的高糖、酮体、氧化产物等有害物质的增多,势必对自体来源的BMSCs的性状产生影响。在本研究中我们通过利用STZ诱导糖尿病大鼠模型,在经体外培养后发现,糖尿病来源的BMSCs在增殖能力上明显减弱,并且在细胞的分泌和抗凋亡能力上也较正常大鼠来源的显著降低。
在BMSCs治疗心肌梗死的研究中,首先要在体外扩增得到移植所需的细胞量。我们在研究中发现,在原代培养中糖尿病来源细胞在贴壁后4~5 d才表现出成纤维样生长的特性,且糖尿病来源的BMSCs的增殖能力明显降低,并且细胞较为扁平。原代体外贴壁时间的延长和细胞形态的变化说明其对环境的适应能力降低,需要较长的时间来恢复其生长增殖能力。另外有研究表明,传代后细胞变为扁平,具有这样的形态特征为细胞衰老的表象[7],并且与我们所得出的增殖能力的下降是相一致的。
另外在BMSCs移植提高梗死后的心功能上,干细胞所分泌的细胞因子被认为是提高心功能的主要因素之一[8],其中VEGF和IGF-1在促进新生血管的生成和细胞增殖方面起着非常重要的作用。我们的研究表明,糖尿病来源的BMSCs其VEGF和IGF-1分泌量较正常来源的明显降低。Liu等[9]利用高糖培养多功能前体细胞后,VEGF的分泌量也可以得到类似的结果,但是其细胞来源为正常的幼年大鼠。在本实验中所采用的干细胞培养条件为正常的培养条件,说明糖尿病的体内环境对糖尿病来源的干细胞其分泌能力有不可逆的损害作用。另据研究表明,VEGF和IGF-1在糖尿病患者的肾脏和视网膜以及血液中的浓度明显高于正常水平[10],但是糖尿病自身来源的BMSCs所分泌的VEGF和IGF-1较正常的明显降低,造成这种矛盾的结果,可能是不同的组织来源的细胞对于糖尿病内环境的反应性不同,并且VEGF和IGF-1在糖尿病肾病和视网膜病变等糖尿病并发症的发展中起着重要的作用。至于细胞移植后分泌的细胞因子,是否会加速糖尿病并发症的发展进程,需要更深入地研究。
影响干细胞治疗心梗疗效的另一重要因素是在干细胞移植后细胞在心梗区的存活率较低,而心肌梗死区缺血低氧的环境是导致细胞凋亡的主要原因。我们采用体外低氧无血清的方法建立细胞凋亡模型[11],发现糖尿病组的抗凋亡能力明显较正常组下降。现有的体外研究表明,体外的高糖、丙酮醛类、活性氧产物(ROS)等环境对细胞的凋亡起着很大的促进作用,而这些因素在糖尿病患者中均存在。另外,VEGF的分泌减少和糖尿病BMSCs在体外培养条件下的所表现出细胞衰老的形态学特征,抗细胞凋亡能力的下降也起着重要的促进作用。
目前关于糖尿病大鼠来源的BMSCs在增殖、分泌和抗凋亡能力下降方面的确切机制目前尚不清楚,可能与糖尿病体内复杂的病理生理条件造成干细胞的线粒体功能障碍[12]、高糖所导致的细胞复制性衰老[3]和相应的信号通道阻断等有关[9]。在本实验中,我们选择均为同龄的大鼠作为实验对象,避免了因年龄不同而造成的误差;在细胞培养方面,均在体外正常的培养条件下进行,从而可以得出糖尿病对BMSCs的各种生物学性状的损害是客观存在的。
本研究也存在若干不足,如没有将培养得到的糖尿病BMSCs移植回动物心梗模型体内,检测其对心功能的改善情况。另外,在糖尿病来源的BMSCs在抗凋亡能力、增殖能力和分泌能力损伤的机制上,没有做进一步的探讨,这也是我们下一步实验的方向。
[1] Jiang Y, Jahagirdar Bn, Reinhardt Rl, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature, 2002, 418(6893):41-49.
[2] Wang Js, Shum-Tim D, Galipeau J, et al. Marrow stromal cells for cellular cardiomyoplasty: feasibility and potential clinical advantages[J]. J Thorac Cardiovasc Surg, 2000, 120(5):999-1005.
[3] Stolzing A, Coleman N, Scutt A. Glucose-induced replicative senescence in mesenchymal stem cells[J]. Rejuvenation Res,2006,9(1):31-35.
[4] Zhang H, Fazel S, Tian H, et al. Increasing donor age adversely impacts beneficial effects of bone marrow but not smooth muscle myocardial cell therapy[J]. Am J Physiol Heart Circ Physiol,2005,289(5):H2089-2096.
[5] Rahman S, Rahman T, Ismail Aa, et al. Diabetes-associated macrovasculopathy: pathophysiology and pathogenesis[J].Diabetes Obes Metab, 2007, 9(6):767-780.
[6] Rathmann W, Giani G. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030[J]. Diabetes Care, 2004, 27(10):2568- 2569.
[7] Re F, Zanetti A, Sironi M, et al. Inhibition of anchorage dependent cell spreading triggers apoptosis in cultured human endothelial cells[J].J Cell Biol,1994,127(2):537-546.
[8] Tang Yl, Zhao Q, Qin X, et al. Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction[J].Ann Thorac Surg,2005,80(1):229-237.
[9] Liu Z, Lei M, Jiang Y, et al. High glucose attenuates VEGF expression in rat multipotent adult progenitor cells in association with inhibition of JAK2/STAT3 signaling[J].J Cell Mol Med, 2008, [Epub ahead of print].
[10] Duh E, Aiello Lp. Vascular endothelial growth factor and diabetes: the agonist versus antagonist paradox[J]. Diabetes,1999,48(10):1899-1906.
[11] Zhu W, Chen J, Cong X, et al. Hypoxia and serum deprivation-induced apoptosis in mesenchymal stem cells[J]. Stem Cells,2006,24(2):416-425.
[12] Thornton Sn, Hess K. Exercise, lactate, and mitochondrial function in aging and diabetes[J]. Am J Clin Nutr, 2009, 89(5):1476-14767.

