Ets-1在不同食管病变组织中的表达及意义
王永霞,王金祥,张哲莹,焦云娟,赵卫星△
(1.新乡医学院病理学教研室,河南 新乡 453003;2.新乡医学院第二临床学院,河南 新乡 453003)
Ets-l基因(E26 tansformation-specific 1)是一种原癌基因,它通过转录激活一系列在细胞外基质改建和血管生成中起重要作用的基因表达,参与细胞外基质的降解、细胞迁移、肿瘤血管生成等多个浸润转移环节。已有研究表明,在乳腺癌、甲状腺癌、胃癌等多种肿瘤细胞中都有Ets-1的表达,其表达上调与肿瘤的浸润转移密切相关,同时还可介导细胞增殖、分化和恶性病变[1-3]。本研究首次联合应用逆转录-聚合酶链反应(RT-PCR)和Western blotting方法检测Ets-1在正常食管黏膜组织、癌旁不典型增生组织及食管鳞癌组织中的表达情况。
1 材料与方法
1.1 材料 62例食管鳞癌、20例癌旁不典型增生及40例正常食管黏膜手术切除标本均为河南省安阳市肿瘤医院2006年2月26日至3月16日手术切除的新鲜标本。标本离体0.5 h内迅速取材,每例标本均在无坏死区癌灶、癌旁3 cm以内及远端正常黏膜组织处分别取材,全部标本均经常规病理证实为相应病变。全部样本取材后立即置于液氮冷冻,后移至-80℃超低温冰箱贮存,用于RT-PC R及Western blotting检测。
1.2 方法
1.2.1 半定量RT-PCR (1)主要试剂及引物:RNA提取试剂盒及Trizol为Sigma公司产品,一步法RNA PCR试剂盒购自大连宝生物工程有限公司。引物由北京奥科生物工程公司合成,Ets-1引物:上游5'-CAA ACT TGC TAC CAT CCC GT-3',下游 5'-TCT GCA AGG TGT CTG TC T GG-3′;内参β-actin引物 :上游 5′-TCA CCC TGA AGT ACC CCA TC-3',下游 5′-TAG CAC AGC CTG GAT AGC AA-3′。预期扩增片段大小分别为702、227 bp的荧光条带。(2)组织总RNA提取:取0.1 g组织,加入1 m L预冷的T rizol提取液,在玻璃匀浆器中充分匀浆,其余步骤严格按Trizol-RNA提取试剂盒说明书进行,再用分光光度计检测RNA含量及纯度,所得RNA溶解于50μL DEPC处理水中。(3)RT-PC R检测Ets-1逆转录总体系为25 μL,操作步骤严格按照试剂盒说明书进行,混合后离心30 s。取出混匀的反应体系置入PCR仪中。RT-PCR反应条件:50℃30 min进行 RT反应,94℃2 min灭活 RTase;循环参数为94 ℃30 s,57 ℃90 s,72 ℃30 s,共35个循环;72 ℃延伸 10 min。扩增产物取5μL进行琼脂糖凝胶电泳,在凝胶成像仪上照相和测定分析。以目的基因条带与内参条带的比值作为目的基因的相对含量。
1.2.2 Western blotting检测 用蛋白裂解液提取食管鳞癌、癌旁不典型增生组织及正常食管黏膜组织中的总蛋白,取100 mg组织加入预冷的蛋白裂解液0.5 m L,裂解组织细胞,提取总蛋白。取50 g蛋白进行100 g/L聚丙烯酰胺凝胶电泳后,转移到PVDF膜上。转移后的NC膜置封闭液中,室温封闭1 h,Ets-1及β-actin抗体稀释浓度均为1∶500,将膜置于用封闭液稀释的一抗中,室温微摇 2 h,将膜置于用含1%(W/V)去脂奶粉的TBS稀释的二抗中,室温轻摇2 h。按照ECL发光液试剂盒的说明书配制工作液,将膜放于工作液中作用1 min,然后压片曝光,观察结果。Western blotting结果的灰度值分析采用Gene Tools软件完成。
2 结 果
2.1 RT-PCR法检测Ets-1 m RNA在不同食管病变组织中的表达 RT-PCR扩增结果经凝胶电泳显示,Ets-1 m RNA RTPCR扩增产物与预计一致,其片段大小为702 bp,内参β-actin片段大小为227 bp。扩增结果经凝胶灰度扫描而对 Ets-1 m RNA阳性表达进行定量,在正常黏膜、不典型增生及食管鳞癌组织中Ets-1 m RNA的含量依次增高,组间比较差异有统计学意义(P<0.05),见表1、图 1。
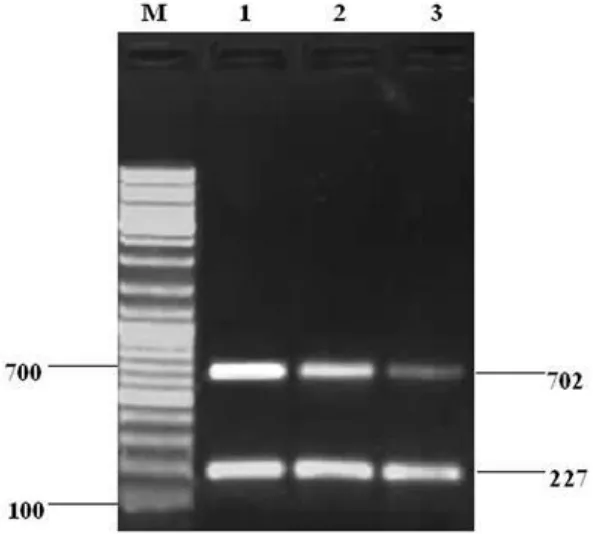
图1 食管鳞癌、不典型增生及正常食管黏膜组织中Ets-1 m RNA的RT-PCR检测

表1 正常食管黏膜、不典型增生及食管鳞癌组织中Ets-1 m RNA的表达

表2 食管鳞癌组织中Ets-1 m RNA的表达与临床病理学参数的关系
2.2 RT-PCR法检测食管鳞癌组织中Ets-1 m RNA的表达与临床病理学及生物学行为的关系 62例食管鳞癌标本中Ets-1 m RNA的相对表达量与患者的性别、年龄无关(P>0.05),与淋巴结的转移密切相关(P<0.05)。其次Ets-1 m RNA的相对表达量随着食管鳞癌分化级别及浸润深度的升高而升高,但差异无统计学意义(P>0.05),见表2。
2.3 Western blotting法检测Ets-1蛋白在不同食管病变组织中的表达 利用蛋白裂解液分别提取不同部位食管组织总蛋白,经过SDS-PAGE、转膜、一抗反应、二抗反应,然后曝光显影,最后利用Gene Tools软件进行蛋白相对表达分析。Ets-1蛋白在食管正常黏膜组织及不典型增生组织中的表达量均低于其在食管鳞癌组织中的表达,见表3、图2。

表3 正常食管黏膜、不典型增生及食管鳞癌组织中Ets-1蛋白的表达

图2 食管鳞癌、不典型增生及正常食管黏膜组织中Ets-1蛋白Western bloting检测
3 讨 论
肿瘤的发生是一个多步骤、多阶段的演进过程,即:单纯增生-异常增生-癌前病变-癌变,除原癌基因激活外,常伴随一个或多个基因功能的失活或丢失[4]。食管癌是中国最常见的恶性肿瘤之一,其发病率高,治疗效果欠佳,居癌症死亡的第6位[5-6]。其中鳞状细胞癌占食管癌的90%,是食管癌的主要组织学类型[7]。
Ets家族是最大的信号依赖转录因子家族之一,可分成Ets、ERG、ELG及EIF等9个亚族。其中Ets亚族由Ets-1与Ets-2组成[8]。人类 Est-1基因位于染色体11q23,编码分子量为54 k D的Est-1蛋白[9]。Est-1最初鉴定为鸟类白血病逆转录病毒E26基因组中原癌基因v-Ets的细胞性前体,是Ets转录因子家族的祖先[10-11]。Ets-l基因与从禽类白血病逆转录病毒E26中分离的v-Ets-l基因序列具有同源性,是一种原癌基因。它通过转录激活一系列在细胞外基质改建和血管生成中起重要作用的基因的表达,参与细胞外基质降解、细胞迁移、肿瘤血管生成等多个浸润转移环节。同时,其过度表达和许多人类肿瘤的发生有着密切的联系,近年已成为各国学者的关注热点。
本研究采用 RT-PCR及Western blotting两种实验方法联合检测了食管不同病变组织中Ets-1 m RNA及蛋白的相对含量,结果显示,正常食管黏膜组织中Ets-1 m RNA相对含量显著低于癌旁不典型增生组织及癌组织的相对含量。提示Ets-1基因在食管鳞癌的发生过程中可能发挥了重要作用。临床病理分析发现Ets-1 m RNA的表达与许多临床因素如患者的年龄、性别等无关,但与食管癌的淋巴结转移密切相关,提示Ets-1在癌组织中呈高表达,具有更强的侵袭转移能力。另外,本研究结果还显示,Ets-1 m RNA的相对表达量随着食管鳞癌分化级别及浸润深度的升高而升高,说明Ets-1在食管癌的分化及浸润过程中也发挥了作用,虽然结果并不具有统计学意义,可能与样本量较少有关。
[1]Lo IC,Lin TM ,Chou LH,et al.Ets-1 mediates plateletderived grow th factor-B B-induced thrombomodulin expression in human vascular smooth muscle cells[J].Cardiovasc Res,2009,81(4):771.
[2]Eo J,Han K ,Murphy K ,et al.Etv5 ,an ETS transcription factor,is expressed in granulosa and cumulus cells and serves as a transcriptional regulator of the cyclooxygenase-2[J].J Endocrinol,2008 ,198(2):281.
[3]Du ZJ,Kamei M ,Suzuki M ,et al.Coordinated expression of Ets-1 ,p ERK 1/2,and VEGF in retina of streptozotocininduced diabetic rats[J].Ophthalmic Res,2007,39(4):224.
[4]Dubey S,Hutson P,Alberti D,etal.Phase Ⅰ study ofdocetaxel and topotecan in patients with advanced malignancies[J].J Oncol Pharm Pract,2005 ,11(4):131.
[5]邹晖,黎孝平.PLFP方案治疗食道癌46例临床观察[J].重庆医学,2006,35(11):1460.
[6]庞霞,郑湘予,李晟磊,等.食管鳞癌组织中 Galectin-3蛋白及m RNA的表达及意义[J].广东医学,2009,30(9):1268.
[7]Tzao C ,Tung H J,Jin JS ,et al.Prognostic significance of global histone modifications in resected squamous cellcarcinoma of the esophagus[J].Mod Pathol,2009,22(2):252.
[8]Liu F,Patient R.Genome-w ide analysis of the zebrafish ETS family identifies three genes required for hemangioblast differentiation or angiogenesis[J].Circ Res,2008,103(10):1147.
[9]Ahlers CM,Figg WD.ETS-TMPRSS2 fusion gene products in prostate cancer[J].Cancer Biol Ther,2006 ,5(3):254.
[10]Qi MC ,Hu J,Zou SJ,et al.Mechanical strain induces osteogenic differentiation:Cbfa1 and Ets-1 expression in stretched rat mesenchymal stem cells[J].Int J Oral M axillofac Surg ,2008,37(5):453.
[11]Vikman P,Ansar S,Edvinsson L,et al.Transcriptional regulation of inflammatory and extracellular matrix-regulating genes in cerebral arteries following experimental subarachnoid hemorrhage in rats.Laboratory investigation[J].J Neurosurg ,2007,107(5):1015.

