乙酰丁香酮浓度和共培养pH对大豆再生频率的影响
武小霞,李 静,王志坤,刘珊珊,李海燕,马 永,李文滨
(1.东北农业大学农学院,大豆生物学省部共建教育部重点实验室,哈尔滨 150030;2.七台河市新兴区长兴乡人民政府农业综合服务中心,黑龙江 七台河 154532)
大豆是公认的难转化植物,主要原因是转化的细胞或组织分化再生植株较困难,再生频率相对较高的再生系统还不能和现有的植物转化方法很好的结合。大豆转基因技术中以农杆菌转化法为主导且应用最为广泛[1]。在大豆的遗传转化过程中,影响转化效率的条件很多,其中在共培养阶段加入乙酰丁香酮的浓度和pH对转化效率有很大的影响。大豆虽然是双子叶植物,但与其他作物相比,它不易受农杆菌感染,不同的大豆基因型对农杆菌的敏感性存在差异[2-7]。1988年,Hinchee等首次报道了农杆菌介导法转化大豆子叶节组织,并获得转基因植株[8]。目前最常用、最成熟的农杆菌介导大豆转基因的方法就是在Hinchee等的工作基础上改良的子叶节法[9-11]。本研究在农杆菌介导大豆转基因的过程中对乙酰丁香酮浓度和pH对大豆遗传转化的影响进行了探讨。
1 材料与方法
1.1 植物材料
以筛选得到的大豆基因型黑农35,进行遗传转化系统的建立,由无菌苗得到的子叶节为农杆菌浸染的外植体。
1.2 菌株与质粒
大肠杆菌(Escherichiacoli)所用菌株为DH5α,根癌农杆菌(Agrobacteriumtumefaciens)菌株为LBA4404(RifR,StrR,KmR),均由东北农业大学大豆研究所提供[12]。质粒pSPUD5由美国密切根州立大学提供,图谱见图1,带有选择标记基因NptⅡ,目的基因cryⅤ抗虫基因,该质粒带有35S起动子和NOS终止子。
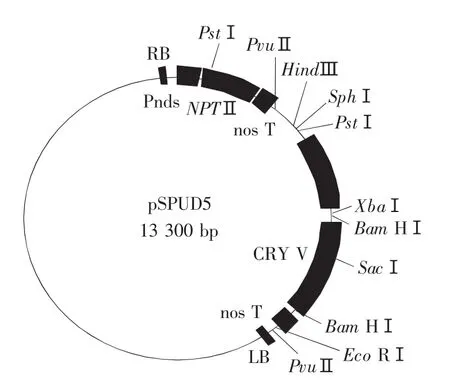
图1 质粒pSPUD5图谱Fig.1 Map of pSPUD5
1.3 试验设计与方法
以对农杆菌最敏感的大豆品种为试验材料,对影响遗传转化效率的两个主要因素(共培养基中AS浓度、共培养pH)进行2因素5水平的试验。以各因素水平的抗性芽率的平均值(K)为指标,确定各因素的最适水平。再通过各因素各水平的极差分析(R),确定各因素影响主次顺序。
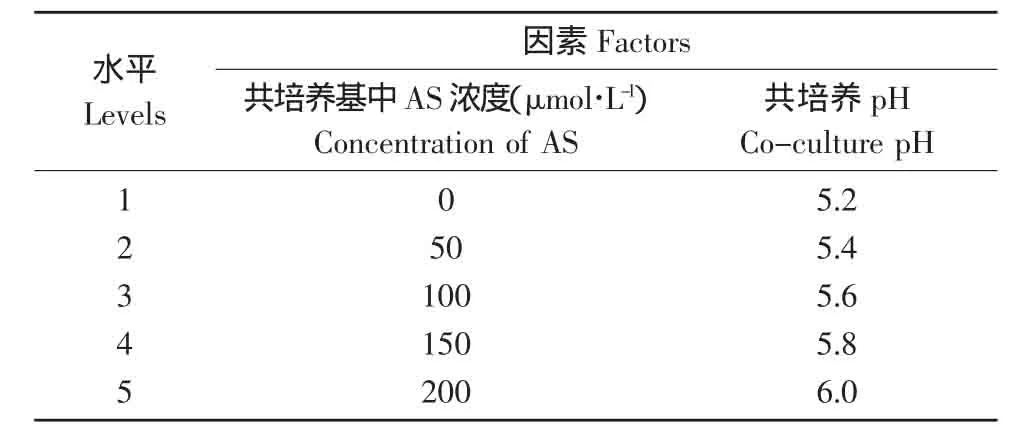
表1 影响农杆菌介导遗传转化效率的因素与水平Table 1 Factors and levels of influencing Agrobacteriummediated transformation efficiency
2 结果与分析
2.1 乙酰丁香酮(Acetosyringone,AS)对转化效率的影响
乙酰丁香酮(AS)是影响农杆菌转化的重要因子。乙酰丁香酮的使用使许多难转化植物的农杆菌介导的转化频率大幅度提高,甚至使以前不能被农杆菌侵染的植物也可以通过农杆菌介导法进行遗传转化[13]。为了明确大豆转化的适宜乙酰丁香酮浓度,以大豆品种黑农35的子叶节为外植体,用含有质粒pSPUD5的农杆菌LBA4404进行了转化试验。在共培养培养基中的乙酰丁香酮浓度设置5个水平,0、50、100、150 和 200 μmol·L-1;并在培养基中加入20 mmol·L-1MES作为pH缓冲剂。用产生抗性愈伤的外植体占总外植体的百分率表示转化频率[14]。由表2、3可知,随着乙酰丁香酮浓度的升高,抗性芽率也逐渐升高,50~150 μmol·L-1的乙酰丁香酮均显著提高大豆的转化频率。但浓度不宜过高,浓度过高反而降低转化频率(200 μmol·L-1及以上),最佳浓度为100 μmol·L-1;由表4可以看出,乙酰丁香酮单因素的F值达到极显著水平。说明在共培养阶段的乙酰丁香酮浓度对大豆转化频率有明显影响。
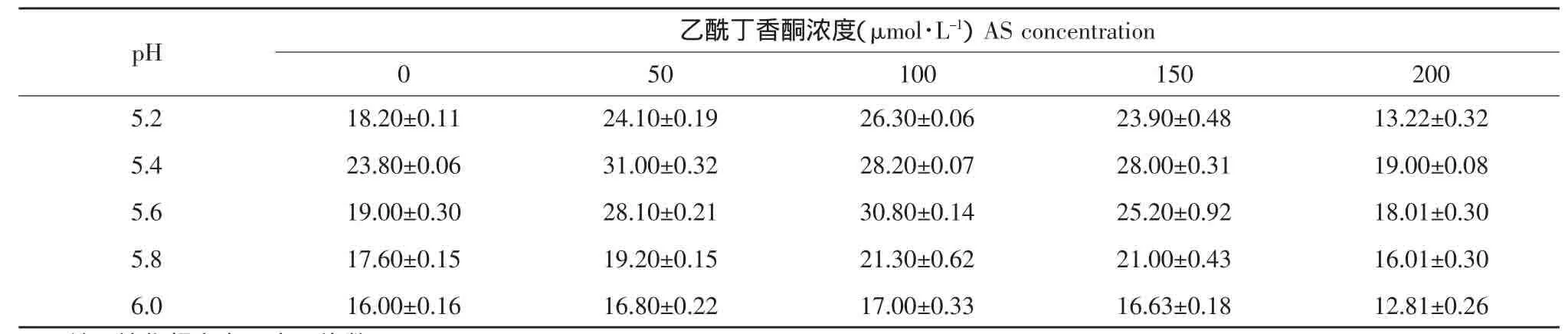
表2 乙酰丁香酮的(AS)浓度和pH对大豆转化频率的影响Table 2 Effect of acetosyringone and pH on transformation efficiency of soybean
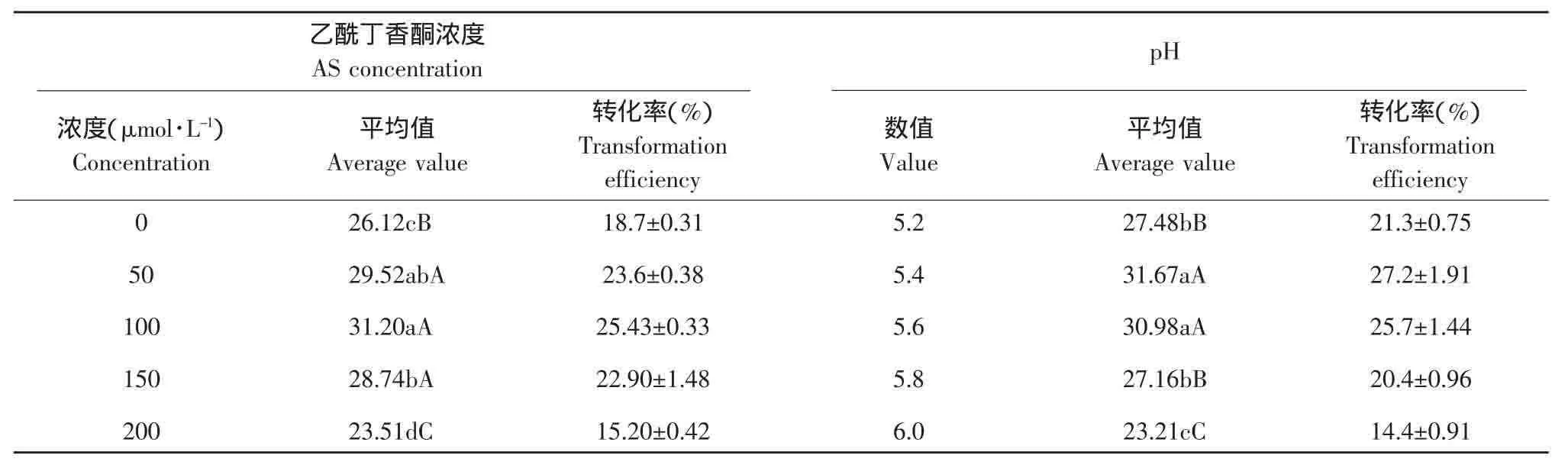
表3 不同乙酰丁香酮(AS)浓度和pH的平均转化频率及其差异显著性Table 3 Average transformation efficiency and significant difference of AS and pH
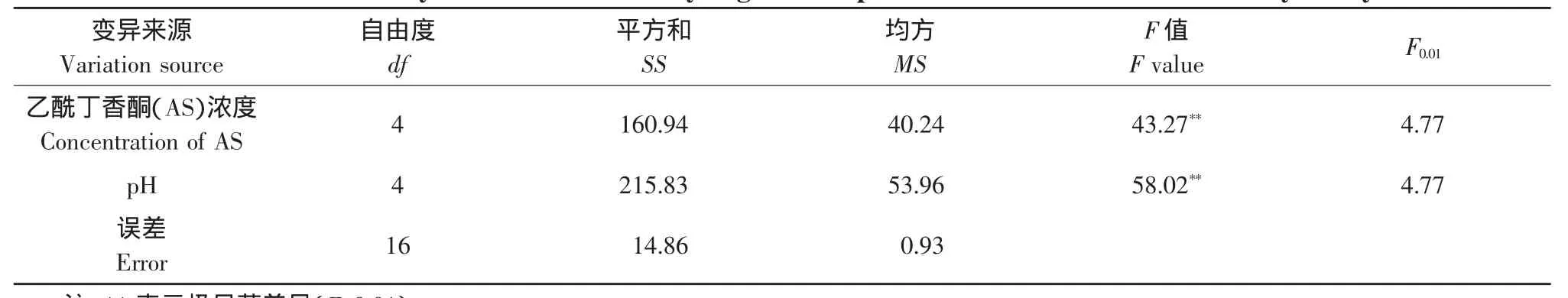
表4 乙酰丁香酮(AS)浓度和pH对大豆转化频率影响的方差分析Table 4 Variance analysis of effect of acetosyringone and pH on the transformation efficiency of soybean
2.2 pH对转化效率的影响
pH也是影响农杆菌转化的重要因子。共培养培养基中pH的大小严重影响农杆菌的转化效率。为了明确大豆转化的适宜pH,以大豆品种黑农35的子叶节为外植体,用含有质粒pSPUD5的农杆菌LBA4404进行了转化试验。共培养培养基pH设置5个水平,5.2、5.4、5.6、5.8和6.0,并在培养基中加入20 mmol·L-1MES作为pH缓冲剂。用产生抗性愈伤的外植体占总外植体的百分率表示转化频率[14],通过表2、3可以看出,pH等于5.2和高于(或等于)5.8时,转化频率极显著地下降。因此确定pH以5.4~5.6为宜。从表4可以看出,pH单因素的F值均达到极显著水平,在共培养培养基中的pH对大豆转化频率有明显影响。
3 讨论与结论
越来越多的研究表明,在大豆转化的共培养基中添加乙酰丁香酮可以部分克服农杆菌介导大豆转化的组织特异性,是农杆菌介导大豆转化成功的重要因素[16-17]。本研究在农杆菌侵染后的共培养阶段,加入了不同浓度的乙酰丁香酮,同时调节pH,发现乙酰丁香酮和pH均对大豆转化频率有明显影响。pH等于5.2和高于(或等于)5.8时,转化频率极显著地下降。因此 pH 以 5.4~5.6 为宜。50~200 μmol·L-1的乙酰丁香酮均显著提高大豆的转化频率,但浓度不宜过高,浓度过高反而降低转化频率,最佳浓度为100 μmol·L-1。可能是在培养基中加入的乙酰丁香酮能够在一定程度上克服大豆对农杆菌敏感性差的障碍。
结果表明,大豆转化过程中pH以5.4~5.6为宜。50~200 μmol·L-1的乙酰丁香酮均显著提高大豆的转化频率,最佳浓度为 100 μmol·L-1。
[1]冯涛,孙聪姝,刘丽君,等.大豆遗传转化的研究进展及在农业上的应用[J].东北农业大学学报,2008,39(3)∶120-124.
[2]Owensl D,Cress D E.Genotypic variability of soybean response to Agrobacterium trains harboring Ti or Ri plasmids[J].Plant Physiol,1985,77∶87-94.
[3]Mckenziema,CressD E.The evaluation of South African cultivars of soybean for their susceptibility to Agrobacterium tumefaciens and the production of transgenic soybean[J].SAJ Sci,1992,88∶193-196.
[4]Bailey M A,Boerma H R,Parrott W A.Inheritance of tumeformation in response to Agrobacterium tumefaciens soybean[J].Crop Sci,1994,34∶514-519.
[5]Bodanese D,Mundstocke Z.Susceptibility of Brazilian soybean cultivars to Agrobacterium tumefaciens[J].Rev Brail Genet,1994,17∶83-88.
[6]Mauro A O,Pfeiffer T W,Collins G B.Inheritance of soybean susceptibility to Agrobacterium tumefaciens and its relationship to transformation[J].Corp Sci,1995,35∶1152-1156.
[7]Donaldson P A,Simmonds D H.Susceptibility to Agrobacterium tumefaciens and cotyledonay node transformation in short-season soybean[J].Plant Cell Rep,2000,19∶478-484.
[8]Hinchee M A W,Conner-Ward D V,Newell C A,et al.Production of transgenic soybean plants using Agrobacterium-mediated DNA transfer[J].BIO/TECHNOL,1988(6)∶915-922.
[9]Zhang Z Y,Xing A Q,Staswick P,et al.The use of glufosinateas as elective agent in Agrobacterium-mediated transformation of soybean[J].Plant Cell Tissue Organ Cult,1999,56∶37-46.
[10]Olhoftpm,Link,Galbraithj,et al.Theroleofthiol compounds increasing Agrobacterium-mediated transformation of soybean cotyledonaryn-node cells[J].Plant Cell Rep,2001,20∶731-737.
[11]Olhoft P M,Flagel L E,Donovan C M,et al.Efficient soybean transformation using hygromycin B selection in the cotyledonaryn-node method[J].Planta,2003,216∶723-735.
[12]Hoekema A,van Haaren M J J,Fellinger A J,et al.Non-oncogenic∶Plant vectors for use in the Agrobacterium binary system[J].Plant Molecular Biology,1985(5)∶85-89.
[13]周思军,李希臣,刘昭军,等.大豆农杆菌介导转化系统的优化研究[J].东北农业大学学报,2001,32(4)∶313-319.
[14]李海燕.双价抗真菌病基因对大豆遗传转化的研究[D].哈尔滨∶东北农业大学,2002.
[15]Godwin I,Todd G,Ford-Lloyd B,et al.The effect of acetosyrigone and pH on Agrobacterium-mediated transformation vary according to plant species[J].Plant Cell Rep,1991(9)∶671-675.
[16]Xue R G,Xie H F,Zhang B.A multi needle assisted transformation of soybean cotyledonary node cells[J].Biotechnol Lett,2006,28∶1551-1557.
[17]Xue R G,Zhang B,Xie H F.Over expression of a NTR1 in transgenic soybean confers tolerance to water stress[J].Plant Cell Tissue Organ Cult,2007,89∶177-183.

