高表达微小RNA145前列腺癌细胞系PC-3的建立
熊大芾,郭 玮,刘铁坚,陈 松,邹学农,彭新生
随着人口的老龄化以及居民生活水平的提高,近年来我国前列腺癌的发病率有显著增长的趋势。前列腺癌是最易发生骨转移的恶性肿瘤,约70%的前列腺癌患者死于骨转移。发生骨转移的确切机制目前尚不十分清楚,临床上亦缺乏有效的治疗手段[1-3]。部分微小RNA(microRNAs,miR)具有肿瘤抑制基因功能,其在结肠癌、乳腺癌、子宫癌、淋巴癌等中表达明显下调,与肿瘤的发生、发展及转移有密切关系[4-10]。我们研究发现,相较于原发肿瘤组织,前列腺骨转移组织中的miR-145表达水平明显下调,提示其可能参与了前列腺癌骨转移的病理生理过程。Sachdeva等[11]的研究表明,miR-145通过抑制c-Myc的表达起到抑制肿瘤转移的作用。而建立高表达miR-145的PC-3骨转移细胞系对研究其在前列腺癌骨转移机制中的作用至关重要。现将PC-3/pMSCV-vector及PC-3/pMSCV-miR-145稳定细胞株建立的方法与结果报告如下。
1 材料与方法
1.1 细胞系
前列腺癌细胞系PC-3购自ATCC;感受态细胞DH5α、载体质粒pMSCV-puro、人胚胎肾细胞293FT为本实验室保存。
1.2 主要试剂
T4 DNA连接酶、内切酶BglⅡ和EcoRⅠ购自New England Biolabs公司,TIANamp Genomic DNA Kit购自天根生物科技公司,胶回收试剂盒购自AXYGEN公司,质粒提取试剂盒购自QIAGEN公司,F-12培养基和胎牛血清FBS购自Hyclone公司,polybrane购自Sigma-Aldrich公司,脂质体转染试剂盒lipofectamine2000和RNA提取试剂Trizol购自Invitrogen公司,荧光实时定量PCR试剂盒购自复能基因公司。
1.2 pMSCV-miR-145质粒的构建
1.2.1 载体序列分析 pMSCV-puro上有BglⅡ、EcoRⅠ两个限制性内切酶的酶切位点,可以利用此两内切酶将目的基因片段克隆至pMSCV-puro表达载体。载体结构图谱见图1。
1.2.2 基因序列分析 已知miR-145的cDNA序列为 AGGGATTCCTGGGAAAACTGGAC(http://genome.ucsc.edu),为方便扩增,查找出其上下游各约500 bp的序列一并进行PCR扩增。根据基因信息设计以下扩增引物:
Forward:
gccAGATCTACCGAGGAGCAGGAGGAGAA Reverse:gccGAATTCGCGTTGGGAAGTGGGTTGAG

图1 pMSCV-puro载体结构图谱
1.2.3 载体的构建 按照TIANamp Genomic DNA Kit试剂盒说明书提取正常乳腺细胞的基因组DNA(细胞由中山大学附属第一医院外科实验室惠赠)。将提取的基因组DNA用nuclease-free水溶解,浓度为1 μg/μl,以其为模板,用上述引物进行PCR扩增。将扩增产物和pMSCV-puro质粒用BglⅡ和EcoRⅠ进行酶切,使其5’和3’端产生带有BglⅡ和EcoRⅠ酶切位点的粘性末端。在T4 DNA连接酶作用下,使两者在16℃下反应过夜,形成重组质粒;取重组质粒3 μl转化200 μl感受态细胞DH5α,将转化过的细胞涂于含氨苄青霉素的平板上,37℃过夜。从平板上挑取2个单克隆菌落分别命名为test1和test2接种于LB培养液中,37℃恒温摇床培养过夜。利用质粒提取试剂盒提取纯化重组质粒。
1.2.4 重组质粒的鉴定 各取重组质粒3 μg,用BglⅡ和EcoRⅠ双酶切扩增后行1%琼脂糖凝胶电泳鉴定。将鉴定合格的质粒命名为pMSCV-miR-145,并取相应菌液送至英骏生物技术公司进行测序,鉴定插入的碱基序列顺序是否正确。
1.3 制备逆转录病毒pMSCV-vector和pMSCV-miR-145
1.3.1 逆转录病毒制备 培养293FT细胞,种板24~48 h,待细胞贴壁率达60%时按照lipofectamine2000(invitrogen)说明书将制备好的载体质粒和包装质粒进行脂质体转染。4 h后换液,细胞培养箱过夜。载体质粒和包装质粒在293FT细胞中结合,产生大量病毒并释放入培养基中。隔天用10 ml注射器收集含病毒的培养基,同时换取新鲜培养基到293FT的培养皿中;0.45 μm过滤器过滤病毒液。之后每隔3小时收集一次病毒。
1.3.2 感染细胞株 按5×105密度将PC-3细胞铺于T25培养瓶中(F-12+10%FBS),24 h后开始感染病毒。病毒液中以1000:1的比例加入polybrane并混匀。弃去待感染细胞的培养基,吸取2 ml病毒液至PC-3细胞中,37℃培养箱培养3 h后换2 ml新病毒液继续感染细胞,3 h后更换正常培养基过夜。隔天以2 ml新病毒液再次感染细胞,3 h后换回正常培养基。感染结束后24~48 h,加入含puromycin(0.5 μg/ml)的细胞培养基筛选阳性细胞,连续筛选3 d,更换正常培养基。
1.4 稳定细胞株PC-3/pMSCV-vector、PC-3/pMSCV-miR-145的鉴定
1.4.1 用Trizol裂解各细胞株,提取RNA进行荧光实时定量RT-PCR,以检测miR-145在PC-3/pMSCV-miR-145细胞中的表达水平。以PC-3/pMSCV-vector细胞株为空载体对照,以PC-3细胞株为空白对照,以鉴定稳定表达miR-145的细胞株是否已成功建立。
1.4.2 根据试剂盒说明书进行逆转录 通过Poly A Polymerase对所有miRNA的3’端进行加“PolyA”尾处理,延长各成熟miRNA的长度以用于后续反应;同时利用逆转录酶M-MLV RTase及与“Poly A”特异性结合的Oligo dT Adaptor引物对Poly A化的RNA进行反转录,生成cDNA。
1.4.3 根据说明书进行荧光实时定量PCR扩增 用特异性正向引物、通用反向引物和试剂盒中含SYBR Green、dNTP、DNA聚合酶及相关buffer的混合液对cDNA进行特异性PCR扩增和检测。待检基因miR-145的正向引物序列:GTCCAGTTTTCCCAGGAATCCCTA。内参基因homosnU6的正向引物序列:CAAATTCGTGAAGCGTTCCATAT。
1.4.4 运用The Applied Biosystems 7500 Real-Time PCR System进行qRT-PCR检测。然后得出各孔CT值并算出均值,采用2-ΔΔCT法进行相对定量。ΔΔCT=(CT试验组miR-145— CT对照组miR-145)—(CT试验组U6—CT对照组U6),此处的对照组为pMSCV-vector空载体对照组。miR-145的相对表达量RQ=2-ΔΔCT。
1.5 统计学分析
采用SPSS 13.0统计软件行统计学处理,组间整体比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 重组质粒的酶切鉴定
由图1可知,若目的基因插入正确,即可被BglⅡ和EcoRⅠ酶切出一条约1173 bp的DNA条带。本实验构建的载体经酶切鉴定,切出一条约1173 bp的条带(图2)。

图2 重组质粒酶切鉴定电泳结果
2.2 基因测序
测序结果如图3,经比对发现插入DNA片段无突变。
2.3 质粒转染和药物筛选结果
转染24 h后重组质粒开始表达,此时通过puromycin筛选可杀死未转染成功的细胞。3 d后,当空白对照组细胞全部死亡时,转染组存活的细胞即为转染成功的细胞,各组质粒转染率约为80%~90%。荧光实时定量RT-PCR的结果显示,转染pMSCV-miR-145实验组细胞的miR-145表达水平与pMSCV-vector空载体对照组之间相比差异达2000倍,差异有统计学意义(P<0.05,表1)。证明在稳定筛选出的细胞株中,miR-145的表达水平升高,稳定株筛选成功(图4)。

表1 各细胞株中miR-145的表达差异

图3 pMSCV-miR-145的测序图
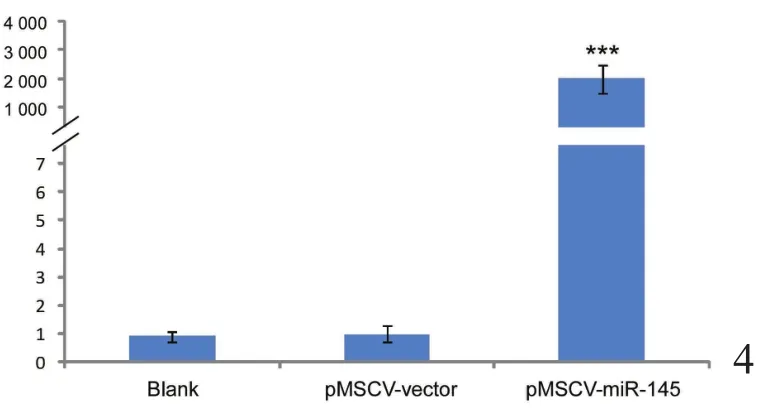
图4 qRT-PCR鉴定miR-145在各细胞株中的mRNA表达水平
3 讨论
肿瘤转移是影响恶性肿瘤治疗的瓶颈。骨转移是前列腺癌晚期的主要表现,无论采用何种治疗方法,患者的生存期仅能维持2~3年。明确前列腺癌骨转移发生发展的机制可以为疾病的预防和靶向性治疗提供新的思路和依据,因此众多学者致力于这方面的研究。近期报道显示,上调或抑制miRNA的表达可能是延缓肿瘤病灶转移的有效手段,但目前针对miRNA与肿瘤骨转移的相关研究报道甚少,其在骨转移过程中的变化及其作用尚未明确[12-14]。
miRNA是一类新的高度保守的、非编码的小RNA,在转录后水平通过与靶mRNA的3'非翻译区不完全性互补配对,对基因表达起负调节作用或产生基因沉默。虽然在表达基因中仅占很小一部分,但作为一种新的广泛存在的基因表达调节分子,miRNA可以通过调控细胞增殖、分化、凋亡、生存、运动和形态发生等在生物体的生长、发育、衰老及死亡的调控过程中扮演重要角色[4],是机体发育和细胞稳态维持的关键调节因子。
越来越多的证据表明,miRNA在肿瘤转移中起着重要作用[4-15]。在前列腺癌转移灶细胞系LNCaP中,miR-145的异常表达可引起细胞的增殖抑制;对LNCaP细胞系进行miR-145转染后,最大可达到100%的生长抑制[10]。LNCaP来源于前列腺癌淋巴结转移灶,miR-145可以影响前列腺癌转移细胞的生长,这一结果进一步证实miR-145的表达水平与前列腺癌细胞的生物学行为密切相关,但与其转移是否存在直接联系,目前尚无定论;在前列腺癌骨转移细胞系PC-3和脑转移细胞系DU145中,miR-145通过抑制BNIP3的表达,抑制细胞增殖,促进细胞凋亡,但是否跟肿瘤细胞转移有关也尚未得到证实[16]。故miRNA、靶蛋白和肿瘤转移三者之间的关系还有待进一步探讨。因此,从研究miRNA入手,阐明miRNA与骨转移的关系及其参与转移的作用机制,可为进一步探索从根本上预防和治疗恶性肿瘤骨转移的方法提供理论依据。而要达到这一目标,首先需要解决的问题是获得稳定高表达miR-145的肿瘤细胞株。
目前在细胞中过表达miRNA的常用方法有3种:(1)化学合成制备目的miRNA,通过转染介质如阳离子脂质体将目的miRNA转染至细胞内;(2)miRNA表达质粒载体;(3)病毒载体[11]。前一种为瞬时表达,后两种为稳定表达。化学合成miRNA加脂质体转染法适用范围较广,目的序列明确,无需考虑克隆载体的突变和加工的效率问题,量可控制,可以研究浓度依靠性效应;此外,化学合成的这种小RNA分子转染方便,不会对细胞造成毒性效应。但因其仅为瞬时表达,故只能用以研究一段时间内的靶基因表达水平,不能获得稳定遗传的细胞系来进行长时间的研究,重复性较差。体内表达制备miRNA的优点在于可以进行较长时期的研究,特别是在带有抗性基因的载体转染成功后可以采用相应的抗生素进行筛选,从而使miRNA在细胞中能够持续抑制靶基因的表达。病毒载体用于miRNA表达的优势在于可以高效率地直接感染细胞,部分病毒载体还可将自身基因和目的基因整合在宿主细胞的基因组中,使之随宿主细胞基因的表达而大量表达[17]。以往研究中多采用重组腺病毒,但因其属于DNA病毒,所携带的目的基因仍难以整合到宿主细胞的DNA中(仅为0.001%~1%),且无法传到子代并获得稳定的表达[18]。作为一种RNA病毒,本实验采用的逆转录病毒具有与腺病毒同样高效的感染细胞功能,且目的基因可随病毒RNA一起整合到宿主的DNA中,随细胞分裂传至子代细胞而获得稳定的表达[19]。miRNA运用病毒载体转染可以进行基因沉默的较长时间研究,可避免因质粒载体转染效率低而带来的种种不便,且转染效果更加稳定,尤其适用于已知一个有效的miRNA序列且需要维持较长时间的基因沉默研究[20]。但需注意的是病毒具有一定的毒性,且病毒载体制备周期较长,费用较高。总之,利用逆转录病毒介导的RNA干扰,可以长期稳定地对靶基因进行沉默,能够解决化学合成序列-脂质体复合物法或质粒载体法瞬时、低效的缺点,拓展了RNA干扰的使用范围,是目前国内外研究基因功能较为先进的技术,适用于长时间的基因功能研究[21]。
总之,我们成功建立了稳定高表达miR-145的前列腺癌骨转移细胞系,为明确miR-145在前列腺癌骨转移机制中的作用奠定了基础,为前列腺癌骨转移的预防和靶向性治疗研究提供了实验依据。
1 Clarke NW,Hart CA,Brown MD.Molecular mechanisms of metastasis in prostate cancer[J].Asian J Androl,2009,11(1):57-67.
2 Roodman GD.Mechanisms of bone metastasis[J].N Engl J Med,2004,350(16):1655-1664.
3 Mundy GR.Metastasis to bone:causes,consequences and therapeutic opportunities[J].Nat Rev Cancer,2002,2(8):584-593.
4 Wu W,Sun M,Zou GM,et al.MicroRNA and cancer:Current status and prospective[J].Int J Cancer,2007,120(5):953-960.
5 Wang CJ,Zhou ZG,Wang L,et al.Clinicopathological significance of microRNA-31,-143 and-145 expression in colorectal cancer[J].Dis Markers,2009,26(1):27-34.
6 Porkka KP,Pfeiffer MJ,Waltering KK,et al.MicroRNA expression profiling in prostate cancer[J].Cancer Res,2007,67(13):6130-6135.
7 Ambs S,Prueitt RL,Yi M,et al.Genomic profiling of microRNA and messenger RNA reveals deregulated microRNA expression in prostate cancer[J].Cancer Res,2008,68(15):6162-6170.
8 OzenM,CreightonCJ,OzdemirM,etal.Widespread deregulation ofmicroRNA expression in human prostate cancer[J].Oncogene,2008,27(12):1788-1793.
9 Akao Y,Nakagawa Y,Naoe T.MicroRNAs 143 and 145 are possible common onco-microRNAs in human cancers[J].Oncol Rep,2006,16(4):845-850.
10 Tong AW,Fulgham P,Jay C,et al.MicroRNA profile analysis of human prostate cancers[J].Cancer Gene Ther,2009,16(3):206-216.
11 Sachdeva M,Zhu S,Wu F,et al.p53 represses c-Myc through induction of the tumor suppressor miR-145[J].Proc Natl Acad Sci USA,2009,106(9):3207-3212.
12 Edwards JK,Pasqualini R,Arap W,et al.MicroRNAs and ultraconserved genes as diagnostic markers and therapeutic targets in cancer and cardiovascular diseases[J].J Cardiovasc Transl Res,2010,3(3):271-279.
13 Hwang JH,Voortman J,Giovannetti E,et al.Identification of microRNA-21 as a biomarker for chemoresistance and clinical outcome following adjuvant therapy in resectable pancreatic cancer[J].PLoS One.2010,5(5):e10630.
14 Wu W.MicroRNA:potential targets for the development of novel drugs?[J]Drugs R D,2010,10(1):1-8.
15 Chen X,Gong J,Zeng H.MicroRNA145 targets BNIP3 and suppresses prostate cancer progression[J].Cancer Res,2010,70(7):2728-2738.
16 Shi Y.Mammalian RNAi for the masses[J].Trends Genet,2003,19(1):9-12.
17 Yu F,Yao H,Zhu P,et al.Let-7 regulates self renewal and tumorigenicity of breast cancer cells[J].Cell,2007,131(6):1109-1123.
18 谭媛,姚德生,李力,等.携带k-ras和c-Myc基因逆转录病毒载体的构建及其转导正常卵巢细胞效能的研究[J].广西医科大学学报,2010,27(1):56-59.
19 Jia F,Zhang YZ,Liu CM.A Retrovirus-based system to stably silence hepatitis B virus genes by RNA interference[J].Biotechnol Lett,2006,28(2):1679-1685.
20 代晨,邓文,张彦明,等.表达miR-150 shRNA细胞株的初步建立[J].动物医学进展,2009,30(8):1-5.
21 Cunningham AP,Andrews LG,Tollefsbol TO.Retrovirusmediated RNA interference.Targeting hTERT through stable expression of short-hairpin RNA[J].MethodsMol Biol,2007,405:39-46.

