含镉废水人工湿地处理系统中基质微生物数量和酶活性研究
张超兰,韦必帽,刘 敏,李 磊,李忠义,高 畅
(广西大学农学院,广西南宁 530005)
人工湿地净化废水的原理主要是利用湿地中基质、植物和微生物之间的相互作用,通过一系列物理的、化学的以及生物的途径净化污水[1-2]。其中基质微生物和酶在污水净化过程中起了非常重要的作用。各种酶在基质中的积累是基质微生物、动物区系和植物根系生命活动的结果,它们参与了基质中腐殖质的合成与分解,有机化合物、高等植物和微生物残体的水解及其转化成为可利用的形态、以及氧化还原反应等[3]。重金属镉对植物的生理具有胁迫作用[4],对微生物和酶活性的影响已有相关报道。同样,人工湿地植物、基质、微生物和酶在重金属污染水体的生态修复中扮演重要的角色。笔者通过对复合垂直流人工湿地处理无机镉废水的基质微生物数量和酶活性的研究,分析其与去除重金属镉的关系,探讨人工湿地去除污水中重金属的机理。
1 材料和方法
1.1 复合垂直流人工湿地系统
试验在广西大学农业资源与环境科学系教学实习基地上建立下行-上行流为主要单元的垂直流人工湿地系统[5],该系统由下行流、上行流2个单元串联而成,各单元大小为120cm×83cm×70 cm,自下而上分别填充砾石(∅16~32mm)、豆石(∅8~16 mm)、粗沙(∅4~6mm)和细沙(∅0~4mm)4种基质。植物配置分别设:①美人蕉(下行池)+红蛋(Echinodorus osiris)(上行池)(简写为MH);②彩叶草(下行池)+风车草(上行池)(简写为CF);③无植物系统(CK)。复合垂直流人工湿地系统结构如图1。
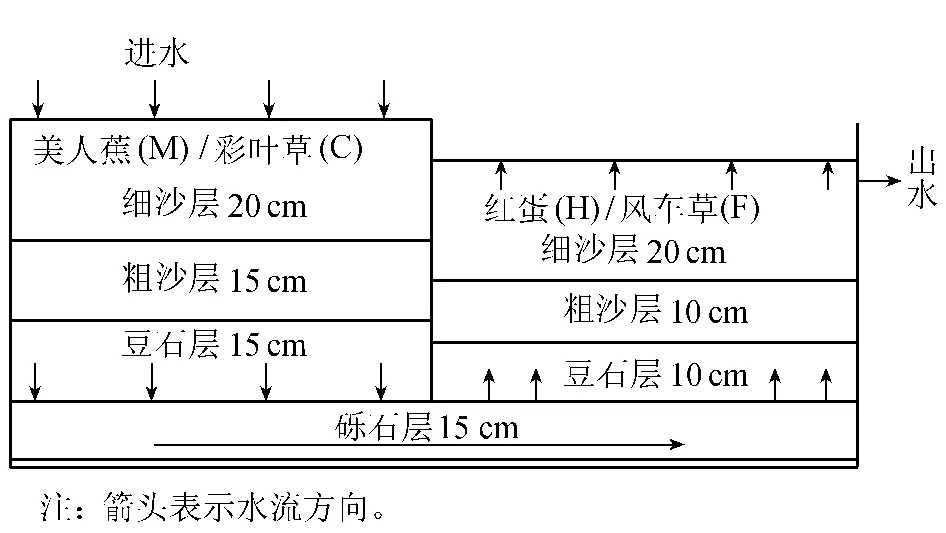
图1 复合垂直流人工湿地系统结构示意图
试验用水用自来水配制,进水的镉质量浓度为29~ 33 mg/L,电导率为 349~ 417μ S/cm,用浓度为5mol/L的HCl溶液调pH值至6.21~6.45。进水方式为间歇式,2007年9~11月每月进水运行一次,运行时间为24h,运行3个月,水力负荷为600mm/d。
1.2 样品的采集
采样时,先让出水口水流2min后再采样,测定重金属Cd的浓度;在运行后第8天采集基质样,把下行池、上行池中基质从上至下分为0~5 cm、5~15cm、15~20cm 3层,分别采用梅花点法分层取样,然后把同层次基质充分混匀,分成两部分,一部分鲜样过2mm筛,保存于4℃冰箱待测微生物数量。另一部分风干,磨碎,过1mm筛,待测各种酶的活性。
1.3 微生物数量的测定
基质的细菌、真菌、放线菌采用平板计数法测定,分别用牛肉膏蛋白胨琼脂、改良马丁氏培、淀粉铵盐培养基测定[6]。
1.4 酶活性的测定
脲酶测定采用苯酚-次氯酸钠比色法,蔗糖酶采用3,5二硝基水杨酸比色法[7]。
2 结果与分析
2.1 植物根系分布特点
人工湿地4种植物根系分布特点各不相同,美人蕉根量最大,其块根盘错在人工湿地基质的表面,且须根发达,根系深度主要在0~10cm;红蛋主要以须根为主,在湿地中其根系分布深度较美人蕉深,主要分布在0~20cm;彩叶草的根系也都是须根,根浅且根系相对细小;风车草根系较粗且较深,至40cm的深度含量也较大,表层相对少量分布。
2.2 基质微生物数量及其空间分布
由表1可见,不同植物湿地系统的细菌数量明显不同,其中,MH与CK之间细菌数量差异显著(P<0.05),但是MH与CF、CF与CK之间差异都不显著;上行池中基质细菌数量极显著大于下行池(P<0.01),从细菌数量的垂直空间分布看,总体规律性差异不显著(P>0.05)。
人工湿地基质中真菌数量较细菌数量少,在104~106个/g之间。真菌在系统中受植物影响比较大,其不同植物系统真菌数量大小顺序也是MH、CF、CK。其中MH与CK、CF与CK之间的差异性达到极显著水平(P=0.0002<0.01,P=0.0327<0.05);但是,MH与CF之间的差异不显著(P=0.201>0.05)。真菌在下行池中的数量极显著大于上行池的数量(P=0.0059<0.01);从真菌的垂直分布看,总体规律是0~5cm>5~15cm>15~20cm,在 0~5cm基质的真菌极显著高于5~15 cm、15~20 cm(P<0.01),而5~15cm与15~20cm之间的差异性不显著(P>0.05)。
放线菌与真菌在垂直流人工湿地基质中的规律基本一致,其数量也基本维持在104~106个/g的水平,但是各处理之间放线菌数量差异不显著性,上行池与下行池之间放线菌数量差异也不显著;其垂直分布总体规律是0~5cm>5~15cm>15~20cm,0~5cm与5~15cm中放线菌数量达到显著性差异(P<0.05),0~5cm与15~20cm中放线菌数量差异则达到极显著水平(P=0.0009<0.01)。
2.3 上层基质微生物数量与镉去除率相关性
人工湿地基质上层(0~5cm)微生物数量与废水中镉去除率的相关性分析结果(表1和表2)表明,在下行池中,上层真菌和放线菌数量与去除率相关性均呈显著正相关(r=0.778,P=0.014<0.05;r=0.789,P=0.011<0.05),而细菌数量与镉去除率相关性不显著(P>0.05);在上行池中,真菌数量与镉去除率相关性显著正相关(r=0.682,P=0.042<0.05);而细菌和放线菌数量与镉去除率相关性都不显著(P>0.05)。

表1 基质微生物数量及其空间分布
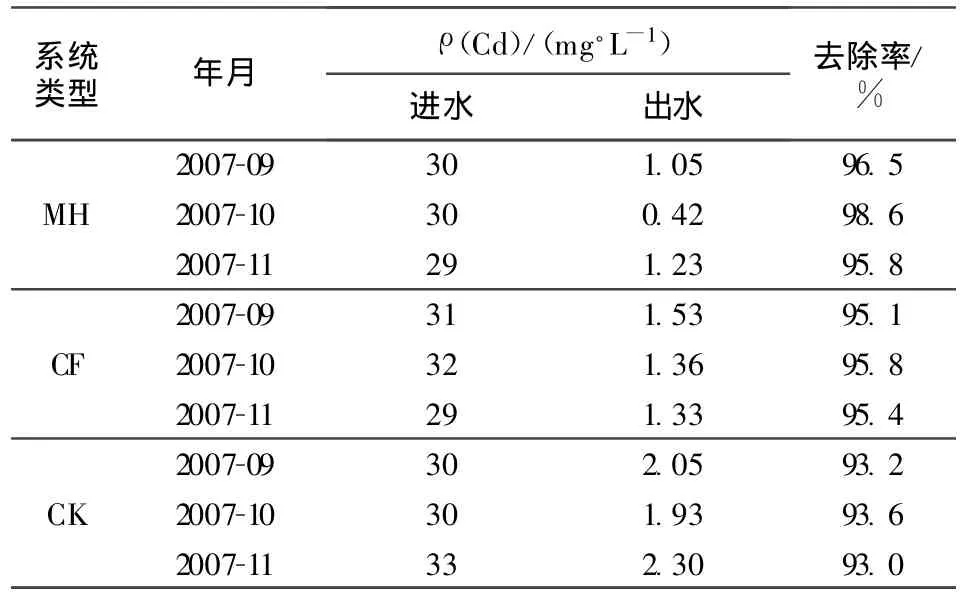
表2 废水中镉的去除率
2.4 基质酶活性及其空间分布
基质脲酶活性与基质微生物数量、有机物质浓度、总氮和速效氮浓度有关,在不同植物的人工湿地系统中,脲酶活性的大致规律为:MH>CK>CF,MH中脲酶活性极显著高于CK和CF(P=0.0001<0.01),而CK与CF差异不显著。基质中脲酶的活性随深度的增加而下降,在下行池中,其中0~5cm中脲酶活性极显著高于15~20cm的(P=0.0392<0.05),而其余各层之间差异性都未达到显著水平。上行池脲酶活性的垂直分布各层间的差异性都不显著(P>0.05)。
湿地基质蔗糖酶来自植物根系和湿地微生物,其活性受植被影响较大。由表3可以看出,不同植物系统湿地基质蔗糖酶的活性大小顺序:MH>CF>CK,且MH与CF、MH与CK、CF与CK之间差异都达到极显著水平(P<0.01);垂直空间分布上,蔗糖酶的活性随深度增加而呈下降趋势,但各层间的差异性都不显著(P>0.05)。
2.5 上层基质酶活性与镉去除率相关性
根据表2和表3,对湿地上层(0~5 cm)基质酶活性与镉去除率做相关性分析,结果发现,无论是上行池还是下行池中,上层基质中蔗糖酶活性与镉去除率相关性都呈极显著正相关(上行池r=0.863,P=0.003<0.01;下行池 r=0.837,P=0.005<0.01);而脲酶活性与镉去除率相关性均未达到显著水平(P>0.05)。
3 讨 论
a.微生物抗重金属机制有生物吸附作用和细胞外的沉淀结晶作用[8],许多微生物能产生大量的胞外多糖,胞外多糖带有负电荷,作为重金属的有效吸附,其分泌的有机酸对重金属也有络合作用;有些微生物能参与形成沉积物,这些沉积物含有大量的重金属,从而达到去除重金属的作用。在人工湿地处理无机镉废水中,细菌在上行池的数量大于下行池,这表明细菌数量除了与植物根系有关外,还可能与处理过程中镉废水浓度有关,因为经过下行池基质和植物根系的吸附净化作用,当废水流经上行池的时候,其浓度应有所下降,这样对细菌的毒害作用降低。有研究表明,细菌受重金属镉浓度影响较大,在三大菌中最敏感[9-10]。细菌、真菌和放线菌在湿地基质中垂直分布都是0~5 cm>5~15cm>15~20cm,有植物系统微生物数量显著大于无植物系统,与Ottova等[11]、Machate等[12]和成水平等[13]的研究结果一致,即人工湿地微生物数量越大,对重金属镉去除效果也越好。
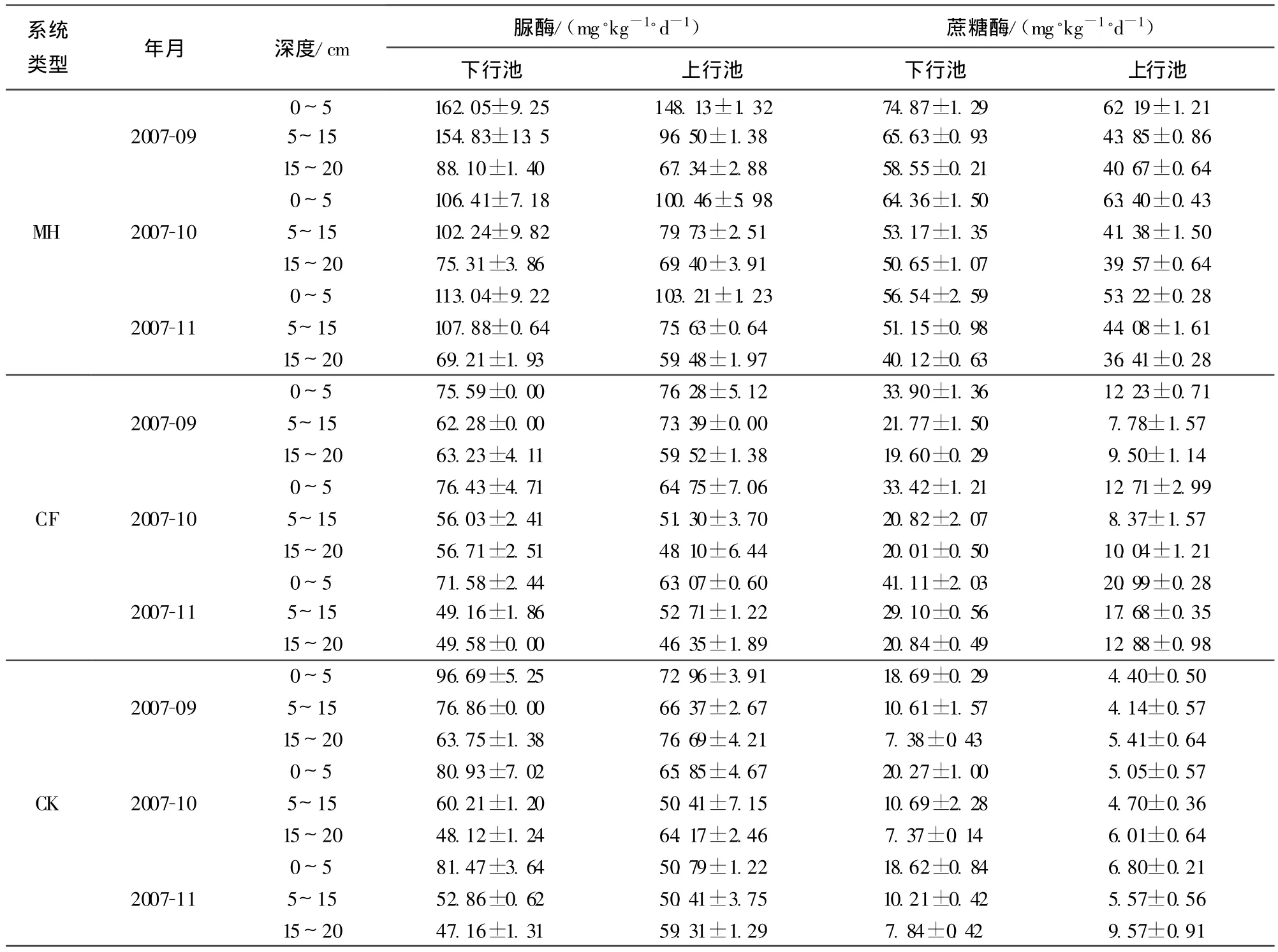
表3 基质酶活性空间分布
b.导致土壤酶活性降低的主要因素是重金属含量[14],重金属对酶活性的抑制机理可能与酶分子中的活性部位一巯基和含眯唑的配位等结合,形成较稳定的络合物,产生了与底物的竞争性抑制作用有关,或者可能由于重金属通过抑制土壤微生物的生长和繁殖,减少体内酶的合成和分泌,最后导致土壤酶活性下降[15-16]。脲酶受重金属浓度影响不大[15],这与本试验脲酶与镉去除率相关性不显著结论一致。人工湿地中植物的根系发达,微生物群落丰富,是影响酶活性的重要因素。试验中,美人蕉系统表层脲酶活性最高,即0~5cm脲酶活性最高;有植物系统极显著高于无植物系统,这与黄娟等[17]的研究结果一致。
4 结 论
a.在复合垂直流人工湿地系统中,3种微生物中细菌数量最多(为106~108个/g数量级),真菌和放线菌相差不大(都在104~106个/g数量级)。
b.不同植物配置的复合垂直流人工湿地基质微生物数量和蔗糖酶活性大小顺序为:MH>CF>CK;基质细菌数量为上行池大于下行池,而真菌、放线菌数量和酶活性则为下行池高于上行池;微生物数量和酶活性的垂直空间分布都是在0~5cm极显著高于其他各层。
c.无论在下行池还是上行池,基质上层(0~5 cm)中,真菌数量和蔗糖酶活性与镉去除率均呈极显著正相关,而细菌数量和脲酶活性与镉去除率的相关性都不显著;放线菌数量与镉去除率的相关性则表现为,在下行池放线菌数量与镉去除率呈显著正相关,而在上行池相关性则不显著。可见,真菌数量和蔗糖酶活性是影响垂直流人工湿地去除废水中镉的主要因素,而真菌数量和蔗糖酶活性与湿地植物的关系密切。
[1] HAMMER D A.Constructed wetlands for wastewater treatment municipal,industrialand agricultura1.Proc.1stinternal conference on constructed wetlands for wastewater treatment[M].Chattanooga,USA,Lewis Publishing,Chelsea,1988.
[2] MARTIN C D,MOSHIRI G A.Nutrient reduction in an series constructed wetland system treating landfill leachate[J].Water Science and Technology,1994,29(4):267-272.
[3] 李智,杨在娟,岳春雷.人工湿地基质微生物和酶活性的空间分布[J].浙江林业科技,2005,25(3):1-5.
[4] 张超兰,陈文慧,韦必帽,等.几种湿地植物对重金属镉胁迫的生理生化响应[J].生态环境,2008,17(4):1458-1461.
[5] 张洪刚,马安娜,洪剑明.垂直流人工湿地设计及净化功能初探[J].节水灌溉,2006(6):31-34.
[6] 许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986.
[7] 姚槐应,黄昌勇.土壤微生物生态学及其实验技术[M].北京:科学出版社,2006.
[8] 池振明.现代微生物生态学[M].北京:科学出版社,2005.
[9] BAATH E.Effects of heavy metals in soils on microbial processes and populations:a review[J].Water Air Soil Pollut,1989,47:335-379.
[10] 龙健,黄昌勇,滕应,等.矿区废弃地土壤微生物及其生化活性[J].生态学报,2003,23(3):492-503.
[11] OTTOVD V,BALCAROVOJ,VYMAZALJ.Microbial characteristics of constructed wetlands[J].Water Science and Technology,1997,35(5):117-123.
[12] MACHATE T,NOLL H,BEHRENS H,et a1.Degradation of phenan-threne and hydraulic characteristics in a constructed wetland[J].Water Research,1997,31(3):554-560.
[13] 成水平,夏宜垮.香蒲、灯心草人工湿地的研究Ⅲ:净化污水的机理[J].湖泊科学,1998,10(2):66-71.
[14] 滕应,黄昌勇,龙健,等.铅锌银尾矿污染区土壤酶活性研究[J].中国环境科学,2002,22(6):551-555.
[15] 张玲,叶正钱,李廷强,等.铅锌矿区污染土壤微生物活性研究[J].水土保持学报,2006,20(3):137-140.
[16] KANDELER E,LUFTENEGGER G,SCHWARZ S.Influence of heavy metals on the functional diversity of soil microbial communities[J].Biology and Fertility of Soils,1997,23:299-306.
[17] 黄娟,王世和,鄢璐,等.潜流型人工湿地的脲酶活性分布特征[J].东南大学学报:自然科学版,2008,38(1):166-169.

