核黄素对STZ诱导的大鼠糖尿病肾病的治疗作用
王国光,张 翠,陆晓华,李 伟
(皖南医学院病理生理教研室,安徽 芜湖 241000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病重要的并发症之一,始于糖尿病发病之初,血糖达到糖尿病诊断标准后DN即开始[1],是危及病人生命的主要原因。DN早期的主要病理特征是肾小球肥大,肾小球和肾小管基底膜增厚及系膜区细胞外基质的进行性积聚;后期为肾小球、肾小管间质的纤维化,最终导致蛋白尿和肾功能衰竭。DN的发病机制较复杂,目前认为高血糖、氧化应激[2,4]、糖基化末端产物[3]、高胰岛素和血脂异常等在DN的发生过程中起着非常重要的作用。越来越多的证据表明,糖尿病引起的氧化应激是导致糖尿病慢性并发症的最根本原因之一[4,5]。因此,许多具有抗氧化作用及提高机体抗氧化能力的药物被用于治疗DN[6,7]。
近年来,越来越多的研究证据表明转化生长因子-β(transforming growth factor-β,TGF-β)在 DN的发病机制中占有重要地位,TGF-β可能为DN发病机制的最后共同通路[8],在高血糖状态下,有多种生化异常及微循环障碍共同参与DN的发生发展,包括蛋白激酶C(protein kinase C,PKC)的激活、蛋白非酶糖化作用、氧化应激、肾素-血管紧张素系统活性增加等,它们可通过各种途径参与TGF-β的调节,导致细胞外基质(extracellular matrix,ECM)积聚及肾小球硬化。TGF-β1引起的纤溶酶原活化抑制因子-1(plasminogen activator inhibitor-1,PAI-1)mRNA及蛋白的表达增加和纤维蛋白溶酶活性的降低,进而使ECM沉积增多。
核黄素又称维生素B,它是动物体内参与碳水化合物、蛋白质和脂肪代谢的许多酶的组成部分。并作为抗氧化维生素之一,在动物的抗氧化体系中起着重要作用[9,10]。本研究旨在探讨核黄素对链脲佐菌素(streptozotocin,STZ)诱导的大鼠DN的保护作用,研究核黄素对TGF-β1和PAI-1表达的影响,初步研究核黄素对糖尿病大鼠肾脏的保护机制。
材料和方法
1 动物
雄性 Sprague-Dawley大鼠36只,体重180-220 g,购自南京青龙山动物养殖场。
2 主要试剂
STZ购自 Sigma;兔抗鼠 TGF-β1、PAI-1多克隆抗体购自武汉Boster公司;硝酸纤维素膜、碱性磷酸酶标记的Ⅱ抗、葡萄糖检测试剂盒等购自合肥博美生物公司;核黄素购自上海化学试剂采购供应站分装厂;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)、考马斯亮蓝法检测试剂盒购自南京建成生物工程研究所。
3 动物分组及模型的制备
大鼠自由饮水、进食。将大鼠随机分为3组:正常对照组(normal control,NC)、糖尿病模型组(diabetic model,DM)、核黄素治疗组(DM+riboflavin,RB),每组10只。适应性喂养1周,禁食12 h,腹腔注射STZ 65 mg/kg(溶于0.1%pH4.5的无菌柠檬酸-柠檬酸钠缓冲液),正常对照组注射无菌柠檬酸-柠檬酸钠缓冲液,48 h尾静脉空腹采血测血糖,血糖值≥13.8 mmol/L的大鼠为糖尿病模型组。造模后分组喂养,处理如下:正常对照组和模型组大鼠以正常饲料喂养,核黄素组大鼠辅以核黄素喂养,20 mg/d。各组实验大鼠于8周后,大鼠处死前1 d代谢笼收集24 h尿液,记录尿量,麻醉,颈动脉取血,分离血清,切取肾脏,用滤纸吸干后称重,一侧肾脏置-80℃冰箱保存供Western blotting检测用,部分肾脏以10%中性甲醛固定,做病理检查。
4 组织形态学观察
肾组织标本经10%中性甲醛溶液固定,常规梯度乙醇脱水,石蜡包埋,制成厚4 μm石蜡切片,行HE染色,在光镜下观察肾组织形态学改变。
5 生化指标的检测
考马斯亮蓝法测尿蛋白。取-80℃保存的各组肾皮质组织匀浆,测定SOD、CAT的活性及MDA的含量,测定血清SOD、CAT活性,测定均严格按照试剂盒说明书操作。
6 Western blotting检测
取-80℃保存的各组肾皮质组织,匀浆、离心后,标定上清液蛋白浓度上样,经12%SDS-PAGE电泳分离,将目的蛋白转移至硝酸纤维素膜上,脱脂奶粉封闭,TBST冲洗后加兔抗鼠TGF-β1、PAI-1Ⅰ抗,4℃孵育过夜。TBST液冲洗,加碱性磷酸酶标记的Ⅱ抗孵育,洗膜后NBT/BCIP显色。
7 统计学处理
结 果
1 大鼠的一般状况
注射STZ诱导糖尿病后,大鼠逐渐出现多饮、多食、多尿等典型的糖尿病表现,相应的对照组大鼠食量、饮水、尿量及精神状态基本正常,体重明显增加。经喂以核黄素,大鼠的饮水、食量和尿量有较明显的改善。
2 核黄素对尿蛋白及肾脏脏器系数的影响
实验结束时,检测到糖尿病组大鼠24 h尿蛋白量明显高于正常对照组(P<0.01),见表1,辅以核黄素喂养的糖尿病大鼠尿蛋白量较糖尿病组明显减少(P<0.01),见表1。由表中1可见,糖尿病组大鼠体重下降,肾脏脏器系数增大,与正常组比较有显著差异(P<0.01);核黄素治疗组大鼠体重及肾脏脏器系数较糖尿病组均有所改善,肾脏脏器系数明显降低(P<0.01)。
表1 核黄素对尿蛋白及肾脏脏器系数的影响Table1.Effects of riboflavin on the content of protein in urine and the ratio of kidney and body weight(.n=10)

表1 核黄素对尿蛋白及肾脏脏器系数的影响Table1.Effects of riboflavin on the content of protein in urine and the ratio of kidney and body weight(.n=10)
##P <0.01 vs normal control;**P <0.01 vs diabetic model.
Group Urinary protein(mg) Kidney weight(g) Body weight(kg) KW/BW(mg/g)Normal control 5.75 ±1.81 2.21 ±0.37 405.50 ±21.64 5.45 ±0.91 Diabetic model(DM) 39.92 ±8.57## 2.17 ±0.34 168.38 ±16.61## 13.02 ±2.40##DM+riboflavin 19.92 ±4.77** 2.06 ±0.18 281.24 ±27.05** 7.39 ±0.97**
3 各组大鼠血清SOD、CAT活性变化
与正常对照组比较,糖尿病组大鼠血清的SOD、CAT活性明显降低(P<0.01),见图1,显示大鼠的抗自由基能力下降;而核黄素治疗组大鼠的SOD、CAT活性较糖尿病组有显著提高(P<0.01),见图1,表明大鼠机体的抗氧化能力有所提高。

Figure1.Effects of riboflavin on the activities of SOD and CAT in serum.NC:normal control;DM:diabetic model;RB:DM+riboflavin..n=10.##P<0.01 vs NC;**P <0.01 vs DM.图1 核黄素对血清SOD、CAT活性的影响
4 肾组织的抗氧化酶活性变化
糖尿病大鼠肾组织中抗氧化酶SOD、CAT活性较对照组明显降低(P<0.01),见表2,与此相应,MDA含量明显升高(P<0.01),见表2,表明组织抗氧化作用下降;核黄素组大鼠肾组织SOD、CAT活性较糖尿病组显著提高,MDA含量明显降低(P<0.01),见表2,显示经核黄素治疗,糖尿病大鼠肾组织抗氧化作用有所改善。
表2 核黄素对SOD、CAT活性及MDA含量的影响Table2.Effects of riboflavin on the activities of SOD,CAT,and the content of MDA in the kidney(.n=10)
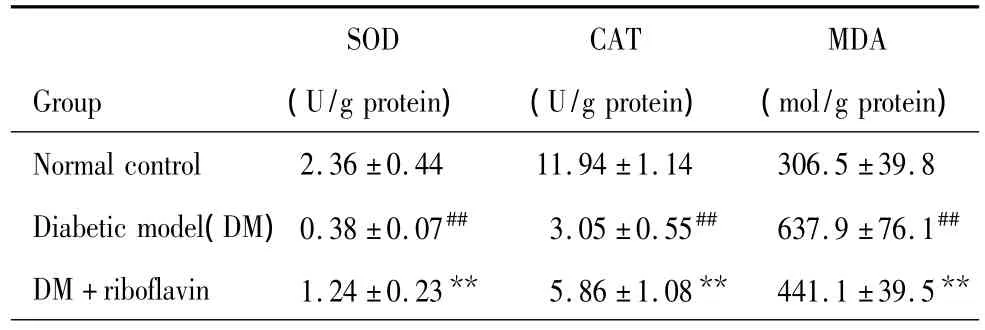
表2 核黄素对SOD、CAT活性及MDA含量的影响Table2.Effects of riboflavin on the activities of SOD,CAT,and the content of MDA in the kidney(.n=10)
##P <0.01 vs normal control;**P <0.01 vs diabetic model.
SOD CAT MDA Group (U/g protein) (U/g protein) (mol/g protein)Normal control 2.36 ±0.44 11.94 ±1.14 306.5 ±39.8 Diabetic model(DM)0.38 ±0.07## 3.05 ±0.55## 637.9 ±76.1##DM+riboflavin 1.24 ±0.23** 5.86 ±1.08** 441.1 ±39.5**
5 Western blotting检测结果
糖尿病组和核黄素治疗组大鼠肾脏皮质都检测到TGF-β1、PAI-1蛋白的表达,核黄素治疗组大鼠肾皮质中TGF-β1和PAI-1的表达均明显低于糖尿病模型组,见图2。
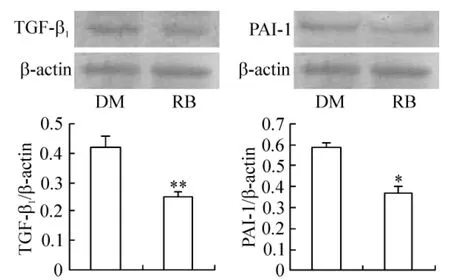
Figure2.Effects of riboflavin on TGF-β1and PAI-1 in kidney.DM:diabetic model;RB:DM+ribofavin..n=6.*P <0.05,**P <0.01 vs DM.图2 核黄素对肾组织TGF-β1和 PAI-1的影响
6 肾组织形态学改变
糖尿病组大鼠肾小球明显充血水肿,体积增大,肾小管上皮细胞变性坏死脱落,基底膜破坏,部分结构不清。核黄素治疗组大鼠肾脏只有较轻微的充血,管腔分开,基底膜完整,结构清晰,肾小球和肾小管结构接近正常,见图3。
讨 论
DN是糖尿病中发病率较高的慢性并发症,也是终末期肾衰竭(end stage renal disease,ESRD)及糖尿病病死率增加的重要因素[11]。已成为当前医学界重点研究课题。
研究显示,DN的发生、发展与氧化应激密切相关。近年研究表明持续的高血糖引起的肾血流动力学改变、糖代谢异常伴蛋白及脂代谢异常是DN病变的基础,细胞因子被激活是DN病变的直接机制,氧化应激是它们的共同机制[4,12]。我们推测作为抗氧化维生素之一的核黄素对DN可能具有保护作用。本实验,我们以核黄素喂养糖尿病大鼠对其进行一段时间的治疗,检测大鼠24 h尿蛋白量、肾脏脏器指数均低于糖尿病大鼠,表明经治疗后的大鼠肾脏损伤减轻。本实验研究结果提示核黄素可减轻或延缓DN的发生发展,对糖尿病肾脏具有一定的保护作用。

Figure3.Kidney pathology of rats from NC,DM,RB groups(HE,×400).NC:normal control;DM:diabetic model;RB:DM+riboflavin.图3 NC、DM、RB组肾组织病理比较
在本研究,我们对大鼠血清和肾皮质组织中抗氧化酶SOD和CAT活性的检测发现,经核黄素治疗,糖尿病大鼠的抗氧化酶SOD和CAT活性有明显的提高,提示核黄素能够改善STZ诱导的糖尿病大鼠肾脏的抗氧化能力,与在肾组织中检测的过氧化产物丙二醛的含量相一致。表明核黄素可能是通过提高抗氧化、抗炎能力的机制保护糖尿病大鼠肾脏。
DN在病理上主要表现为肾脏肥大、基底膜增厚及肾小球和肾小管间质细胞外基质(ECM)进行性积聚[13],在这一过程中,TGF - β1、PAI-1 参与并发挥重要作用。TGF-β1是一种强效的致纤维化因子,是DN发展过程中的核心因子[8]。糖尿病的重要表现是高血糖,高糖可激活PKC,导致TGF-β1表达升高[8],促使肾脏细胞发生细胞肥大、增加系膜细胞胞外基质的产生、并通过增加基质降解酶抑制物活性,抑制基质降解酶合成而减少细胞外基质的降解,从而加速DN的发生发展,造成肾脏的持续损害。
PAI-1主要由血管内皮细胞合成,可抑制纤溶酶原的活化,降低ECM的降解,促进组织ECM的积聚,加速DN的发生。研究发现高糖、TGF-β1和由糖氧化酶产生的过氧化氢能上调PAI-1 mRNA及蛋白的表达,同时显著抑制纤维蛋白溶酶活性,抗氧化剂能抑制这种作用[14,15]。PAI-1 的表达与糖尿病患者肾损害(蛋白尿)的程度呈正相关。通过基因转染技术使PAI-1基因在肾脏中定位表达,结果显示,随PAI-1表达水平增加,局部出现ECM过度积聚[11],在肾小球纤维化区域也可检测出 PAI-1表达增高。以上表明 PAI-1是引起肾脏损伤的重要物质。另有研究证实,肾脏局部TGF-β1增加时,PAI-1的合成增加,PA的活性降低,基质中PAI-1的沉积增多。用抗TGF-β1的抗体可阻断PAI-1的增加[15]。因此,一定程度上抑制糖尿病肾脏TGF-β1、PAI-1的表达可以减轻糖尿病肾脏的损伤。
本研究Western blotting结果显示,糖尿病大鼠经核黄素治疗后,肾皮质TGF-β1蛋白及PAI-1蛋白表达明显降低,提示核黄素可能通过提高机体的抗氧化能力抑制肾组织TGF-β1、PAI-1蛋白表达,减轻糖尿病肾脏损伤。核黄素具有明显的抗氧化作用[10],本研究也证明核黄素可提高STZ诱导的糖尿病大鼠的抗氧化能力,提示核黄素对DN的保护作用机制可能是通过提高机体的抗氧化性,抑制肾皮质TGF-β1蛋白及PAI-1蛋白表达,使肾小管间质细胞外基质减少,或降解相对增多,从而减轻或延缓DN的发生发展。
[1]向红丁.糖尿病肾病的预防措施[J].临床内科杂志,2005,22(3):147 -149.
[2]李晓博,牟忠卿,陈 丽,等.糖尿病大鼠肾脏组织氧化应激及其在糖尿病肾病发病中的意义[J].中国病理生理杂志,2006,22(4):806 -809.
[3]Suzuki D,Toyoda M,Yamamoto N,et al.Relationship between the expression of advanced glycation end-products(AGE)and the receptor for AGE(RAGE)mRNA in diabetic nephropathy[J].Intern Med,2006,45(7):435 -441.
[4]Evans JL,Goldfine D,Maddux BA,et al.Oxidative stress and stress-actived signaling pathways:a unifying hypothesis of type 2 diabetes[J].Endocr Rev,2002,23(5):599-622.
[5]舒 冏,曾龙驿,林可意,等.伊贝沙坦联合舒洛地特对糖尿病大鼠肾脏协同保护作用的研究[J].中国病理生理杂志,2009,25(2):361 -366.
[6]Naito Y,Uchiyama K,Aoi W,et al.Prevention of diabetic nephropathy by treatment with astaxanthin in diatetic db/db mice[J].Bifactors,2004,20(1):49 -59.
[7]Onozato ML,Tojo A,Goto A,et al.Radical scavenging effect of gliclazide in diabetic rats fed with a high cholesterol diet[J].Kidney Int,2004,65(3):951 - 960.
[8]Bernd H,Christoph D,Birgit H,et al.Correlation of enhanced thrombospondin-1 expression,TGF-β signalling and proteinuria in human type - 2 diabetic nephropathy[J].Nephrol Dial Transplant,2008,23(12):3880 -3887.
[9]Dutta P,Serafi J,Halpin D,et al.Acute ethanol exposure alters hepatic glutathione metabolism in riboflavin deficiency[J].Alcohol,1995,12(1):43 -47.
[10]Higashi-Okai K,Nagino H,Yamada K,et al.Antioxidant and prooxidant activities of B group vitamins in lipid peroxidation[J].UOEH,2006,28(4):359 -368.
[11]Groop PH.The presence and severity of chronic kidney disease predicts all-cause mortality in type 1 diabetes[J].Diabetes,2009,58(6):1651 -1658.
[12]Kang D,Hamasaki N.Mitochondrial oxidative stress and mitochondrial DNA[J].Clin Chem Lab Med,2003,41(10):1281-1288.
[13]Wolf G,Ziyadeh FN.Molecular mechanisms of diabetic renal hypertrophy[J].Kidney Int,1999,56(2):393 -405.
[14]Hirano T,Kashiwazaki K,Moritomo Y,et al.Albuminuria is directly associated with increased plasma PAI-1 and factor V levels in NIDDM patients[J].Diabetes Res Clin Pract,1997,37(1):11 -23.
[15]Yang C,Patel K,Harding P,et al.Regulation of TGF-β1/MAPK -mediated PAI-1 gene expression by the actin cytoskeleton in human mesangial cells[J].Exp Cell Res,2007,313(6):1240-1250.

