茶树ISSR-PCR 反应体系的正交优化
宁静,黄建安,李娟,钟兴刚,朱旗
(1.湖南省茶叶研究所,湖南 长沙410125;2.茶学教育部重点实验室,湖南 长沙 410128;3.湖南农业大学 园艺园林学院,湖南 长沙 410128)
茶树的遗传基础研究目前还比较薄弱.传统育种方法依赖表现型选择,局限性较大.简单重复间序列 (ISSR)能反映出比RFLP、SSR 和RAPD 更丰富的多态性,具有多态性高、稳定性强、操作简单、成本低等优点,近年来在品种资源鉴定[1-4]、遗传多样性研究[5-6]、遗传图谱构建[7-8]中得到了广泛的应用.利用正交设计方法优化茶树ISSR-PCR 反应体系的研究尚未见报道.由于该方法是基于PCR 的一种标记,其反应条件易受到各因素浓度的影响.为了确保ISSR 分析结果的可靠性和重复性,通常需要对其反应体系进行优化,严格控制反应条件.笔者对茶树ISSR-PCR 反应体系进行正交优化,旨在为利用ISSR 分子标记对茶树种质资源鉴定、遗传多样性分析等提供理论依据.
1 材料与方法
1.1 供试材料与主要仪器
2009年4月,于湖南省茶叶研究所种质资源圃采用茶树1芽2叶新梢,提取其DNA作为ISSR-PCR扩增的模板.
十六烷基三甲基溴化铵(CTAB)及其他试剂均为国产分析纯.Taq 酶(5 U/μL)、dNTP(10 mmol/L)、MgCl2(25 mmol/L)、Buffer 均为MBI 公司产品.标准分子量(Marker)B031-1 购自北京鼎国生物技术有限公司.ISSR 引物由上海生工生物工程技术服务有限公司合成.经筛选,把引物UBC827 (AC)8G 作为正交试验的引物.
主要仪器与设备为台式高速冷冻离心机(MIKR022R)、PTC-100TMPCR扩增仪、梯度PCR 扩增仪(Biometra)、凝胶自动成像系统(Gene Genius)、DYY-5型稳压稳流电泳仪(北京六一仪器厂)、DYY-Ⅲ水平电泳槽(北京六一仪器厂)、超低温冰箱、微波炉、电子天平、移液器、快速混匀器、高压蒸汽灭菌锅、超纯水器、超净工作台、恒温水浴锅、紫外分光光度计及其他分子生物学常用设备.
1.2 方 法
1.2.1 DNA 的提取
参照黄建安[9]等的方法,采用改良的CTAB 法提取茶树基因组DNA,在岛津紫外分光光度计上测定所提DNA 的浓度和纯度,用0.8%的琼脂糖凝胶电泳检测DNA 的相对分子质量及降解程度,并将其稀释至40 ng/μL,备用.
1.2.2 PCR 正交试验设计
采用正交设计[10]L16(45),对参与ISSR-PCR 反应的5 个因素在4 个水平上进行试验(表1).共16个处理,每处理2 个重复,按表1 中的数据加样.在PTC-100TMPCR 扩增仪上进行扩增,反应体系20 μL,除表中所列因素外,每管还有10×PCR Buffer.
1. 2. 3 PCR 扩增程序和退火温度选择
反应程序为94 ℃预变性5 min,94 ℃变性1 min,58 ℃退火45 s,72 ℃延伸2 min,共38 个循环,72 ℃延伸10 min,4 ℃保存.反应结束后,ISSR-PCR 产物用1.5%的琼脂糖凝胶(含0.5 μg/mL溴化乙锭)于3 V/cm 下电泳约80 min.电泳结果用凝胶成像系统拍照,用DPS 软件分析,得到茶树ISSR-PCR 反应各因素的最佳水平.选用引物ISSR1、UBC881,根据其Tm 值分别设置最低温度46、48 ℃,最高温度66.0、64.0 ℃,在梯度PCR扩增仪上自动生成12 个温度,对PCR 产物进行电泳检测,筛选出最适退火温度.
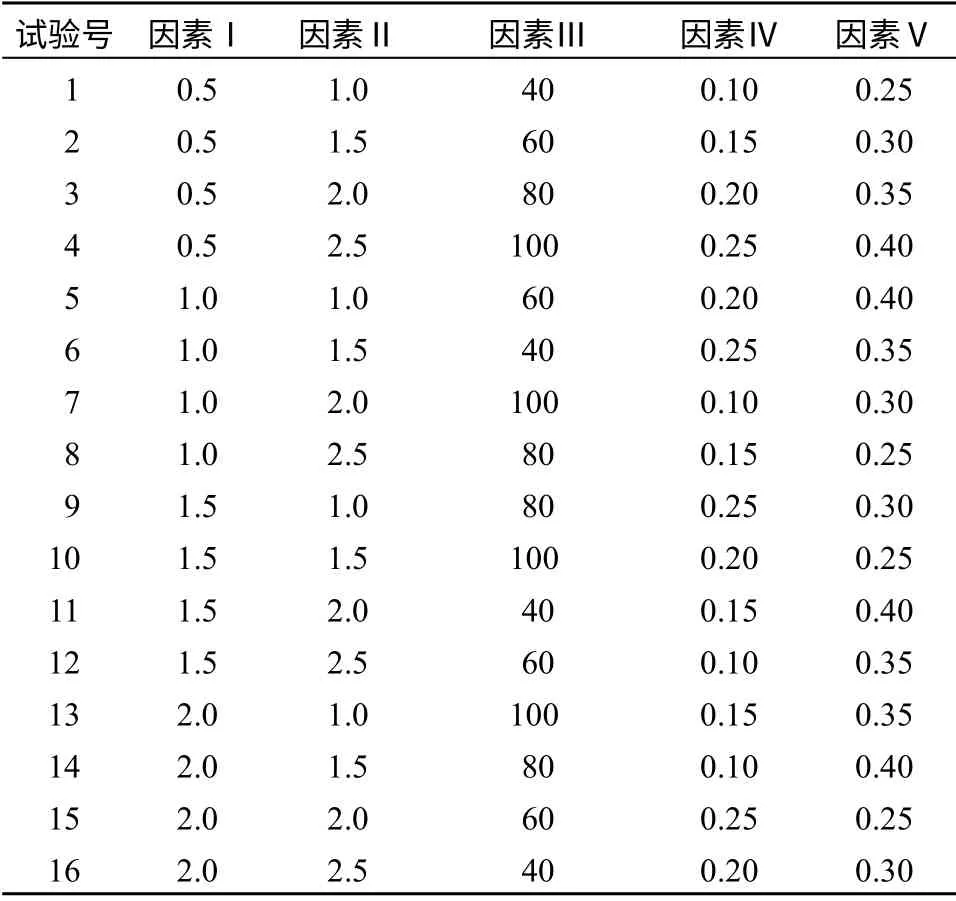
表1 ISSR-PCR 反应体系的正交试验设计Table 1 L16(45) orthogonal design for the factors and levels of PCR reaction
2 结果与分析
2.1 电泳结果评分
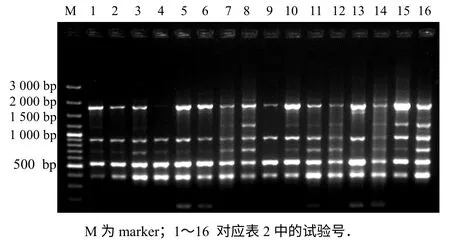
图1 正交试验ISSR-PCR 产物电泳结果Fig.1 Electrophoresis result of ISSR-PCR products
参照何正文等[11]的正交设计直观分析方法,根据图1 电泳结果和本试验目的,将16 个处理从高 到低依次评分,最佳产物(条带丰富,清晰度高,背景低)记为16 分,最差产物记为1 分.图1 中各处理从左至右重复记分结果依次为2、2;4、5;11、11;1、1;9、10;10、9;8、7;15、16;5、4;12、13;13、12;7、8;6、6;3、3;14、14;16、15.
2.2 各因素对ISSR-PCR 反应影响的差异
由表2 中F 值可知,dNTP 浓度、Taq 酶浓度、Mg2+浓度对反应结果影响较大,模板DNA 浓度的影响最小.由P 值可知,各因素水平间的差异均达到极显著水平.
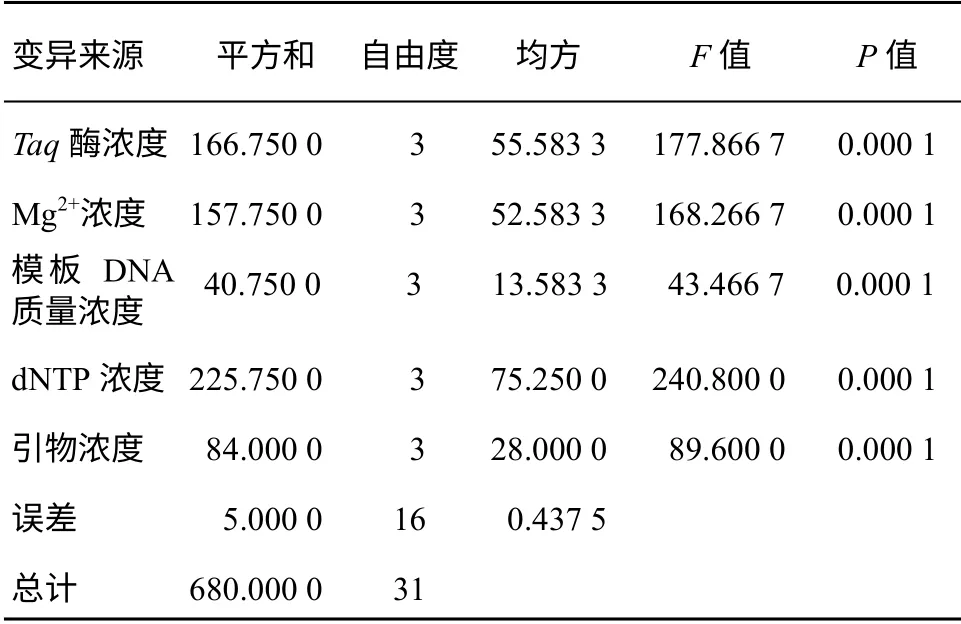
表2 ISSR-PCR 反应各因素间方差分析表Table 2 The variance analysis for the factors of ISSR-PCR reaction
2.3 各因素对ISSR-PCR 结果的影响
2.3.1 Taq 酶浓度的影响
当Taq 酶浓度为0.5~1.0 U/(20 μL)时,均值随Taq 酶浓度的增加急剧上升,在1.0 U/(20 μL)时达到峰值;Taq 酶浓度继续增加,均值下降,但下降趋势不明显,且1.5~2.0 U/(20 μL)时的结果差异不大.可见,Taq 酶浓度过低,PCR产物信号较弱,产物合成效率低;浓度过高,造成非特异性扩增,电泳背景加深,因此,选取1.0 U/(20 μL)作为茶树ISSR-PCR反应体系中Taq酶的最佳浓度.
2.3.2 Mg2+浓度的影响
当Mg2+浓度为1.0~2.0 mmol/L 时,反应结果差异明显;均值随浓度的增加急剧上升,2.0 mol/L时达到最高,2.5 mol/L 时有所下降,表明Mg2+浓度过低,Taq 酶作用效率低,PCR 产物多态性不高;浓度过高,容易产生非特异性弥散带,故选取2.0 mol/L 为茶树ISSR 反应体系中Mg2+的最佳浓度.
2.3.3 模板DNA 浓度的影响
当模板DNA浓度为40~60 ng/(20 μL)时,反应结果差异明显;均值随浓度的增加急剧下降,在60~100 ng/(20 μL)呈缓慢上升趋势,但均值变化不大,表明在60~100 ng/(20 μL),模板DNA浓度对ISSR-PCR反应结果影响不大,所以,选取40 ng/(20 μL)为茶树ISSR-PCR 反应体系中模板DNA的最适浓度.
2.3.4 dNTP 浓度的影响
当dNTP 浓度为0.1~0.2 mmol/L 时,均值随浓度增加而上升,在0.2 mmol/L 时达到最高;当dNTP浓度为0.2~0.25 mmol/L 时,差异明显,随浓度的增加而下降,表明dNTP 作为PCR 反应的原料,浓度太低会使扩增反应不完全,从而降低PCR 产物的产量;浓度过高会对Mg2+产生抑制作用,降低Mg2+的有效浓度,影响Taq 酶的活力,造成浪费,因此,选取0.20 mmol/L 为茶树ISSR 反应体系中dNTP 的最适浓度.
2.3.5 引物浓度的影响
当引物浓度为0.25~0.30 μmol/L 时,均值随浓度的增加明显下降;当引物浓度为 0.30~0.35 μmol/L 时均值无明显差异;当引物浓度为0.35~0.4 μmol/L 时,均值呈下降趋势,表明浓度过高容易使电泳背景加深,产生非特异性扩增,故选取0.25 μmol/L 为茶树ISSR 反应体系中引物的最佳浓度.
2.4 最适退火温度的确定
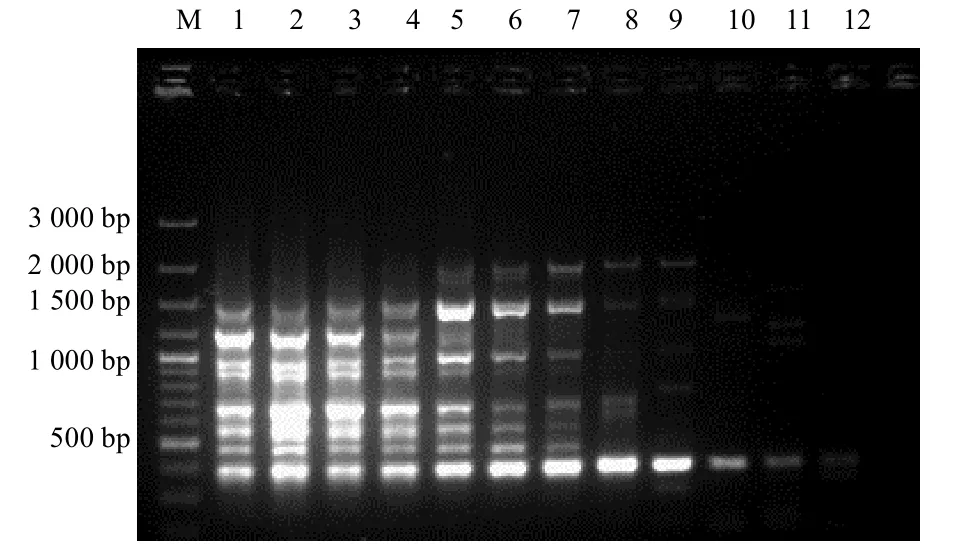
图2 引物ISSR1 梯度退火电泳结果Fig.2 Electrophoresis result of annealing temperature on ISSR amplification of primer ISSR1

图3 引物UBC881 梯度退火电泳结果Fig.3 Electrophoresis result of annealing temperature on ISSR amplification of primer UBC881
由图2 和图3 可知,退火温度过低时,扩增特 异性差,条带弥散,背景深;退火温度过高时,引物与模板结合差,PCR 产物多态性低,电泳条带亮度变弱,不同引物的最适退火温度也不同,所以,确立引物ISSR1、UBC881 的最适退火温度分别为52.4,59.0 ℃.
3 结论与讨论
20 μL茶树ISSR-PCR反应体系中,Taq DNA聚合酶为1.0 U/(20 μL),Mg2+为2.0 mmol/L,模板为40 ng/(20 μL),dNTP 为0.20 mmol/L,引物为0.25 μmol/L.引物ISSR1、UBC881的最适退火温度分别为52.4、59.0 ℃,表明最适退火温度因引物而异.
目前,建立茶树ISSR-PCR反应体系使用较多的方法是单因素试验法[12-13].该方法过程繁琐,既不能考察各因素间的交互作用,也不能保证各因素最佳浓度的组合就是反应的最佳体系.正交试验设计具有均衡分散、综合可比及可伸缩、效应明确等特性,既能考察各因素的交互作用,又可分析每一因素不同水平对扩增结果产生的影响,克服了单因素试验顾此失彼、试验规模大的缺点,从而快速地找到最优的水平组合[14-16].本试验结果为进一步利用ISSR分子标记技术对茶树进行种质资源鉴定、遗传多样性分析及遗传图谱构建等研究奠定了基础.
[1]Zietkiewiez E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
[2]Blairm W,Panaud O,Mccouch S R.Inter-simple sequence repeat (ISSR )amplication for analysis of micro- satellite motif requency and fingerprinting in rice(Oryza sativa L.)[J].Theor Appl Genet,1999,98:780-792.
[3]沈永宝,施季森,赵洪亮.利用ISSR DNA标记鉴定主要银杏栽培品种[J].林业科学,2005,41(1):202-204.
[4]王英,庄南生,高和琼,等.甘蔗种质遗传基础的ISSR分析[J].湖南农业大学学报:自然科学版,2007,33(4): 176-183.
[5]杨传平,魏利,姜静,等.应用ISSR-PCR对西伯利亚红松19个种源的遗传多样性分析[J].东北林业大学学报,2005,33(1):1-3.
[6]唐玉海,郭春芳.ISSR标记在茶树品种遗传多态性研究中的应用[J].福建农林大学学报:自然科学版,2007,36(1):51-54.
[7]张仁兵,易克,许勇,等.用重组自交系构建西瓜分子遗传图谱[J].分子植物育种,2003,1(4):481-489.
[8]黄福平,梁月荣,陆建良,等.应用RAPD和ISSR分子标记构建茶树回交l代部分遗传图谱[J].茶叶科学,2006,26(3):171-176.
[9]黄建安,黄意欢,罗军武,等.茶树基因组DNA的高效提取方法[J].湖南农业大学学报:自然科学版,2003,29(5):402-407.
[10]董如何,肖必华,方永水.正交试验设计的理论分析方法及应用[J].安徽建筑工业学院学报:自然科学版,2004,12(6):103-106.
[11]何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4): 403-404.
[12]姚明哲,王新超,陈亮,等.茶树ISSR-PCR反应体系的建立[J].茶叶科学,2004,24 (3):172-176.
[13]林郑和,陈荣冰,陈常颂.茶树ISSR-PCR反应体系优化研究[J].福建农业学报,2006,21(3):247-252.
[14]王家保,刘志媛,徐碧玉,等.用正交设计优化荔枝RAPD反应体系[J].武汉植物学研究,2005,23(4): 363-368.
[15]谢运海,夏德安,姜静,等.利用正交设计优化水曲柳ISSR-PCR反应体系[J].分子植物育种,2003,3(3): 445-450.
[16]汪结明,项艳,吴大强,等.杨树ISSR反应体系的建立及正交设计优化[J].核农学报,2007,21(5): 470-473.

