捻转血矛线虫H11蛋白提取及其氨肽酶活性分析
赵媛媛,韩彩霞,李晓云,宋铭忻,路义鑫
(东北农业大学动物医学学院,哈尔滨 150030)
捻转血矛线虫(Haemonchus contortus)是圆线目,毛圆科,血矛属线虫,主要寄生于牛羊等反刍动物皱胃黏膜,偶见小肠中,因吸血导致宿主贫血、消瘦,严重的可引起幼畜尤其是羔羊大批死亡,死亡率可高达30%以上,给畜牧业造成巨大的经济损失[1]。目前主要采用化学药物治疗该病,但药物残留严重,如多拉菌素药物残效期为50 d[2],加之抗药性虫株的出现和蔓延,使得传统的治疗受到严重挑战,迫切需要一种有效的防治方法以控制其感染和流行,对疫苗的开发研制成为捻转血矛线虫病防治研究中的热点。
捻转血矛线虫H11蛋白是一种分子质量在110 ku的完整膜糖蛋白复合物,为现今疫苗最佳候选抗原,具有很好的免疫效果,其仅在L4期幼虫和成虫小肠微绒毛上表达,可引起与血清抗体有关的高水平的保护作用。天然H11免疫动物后,可使雄虫减少70%、雌虫减少80%、虫卵减少90%,且对不同年龄阶段的绵羊均具有保护作用,且其保护率与抗体水平也呈正相关[3]。由于原核系统对表达产物的翻译后加工、修饰、糖基化等作用不能达到真核系统的要求,其重组形式仅能提供很小的免疫保护,免疫效果远不及天然抗原。为了能够对H11蛋白有进一步的了解,本试验对体外培养的L4期幼虫和自然感染的成虫的H11天然蛋白分别进行了提取和纯化,并进一步测定其酶活性及酶抑制剂敏感性,为利用天然抗原进行疫苗研制进行了初步探索。
1 材料与方法
1.1 材料
1.1.1 捻转血矛线虫成虫
采于自然感染的山羊皱胃,经形态学特征鉴定为捻转血矛线虫雌性成虫。
1.1.2 捻转血矛线虫L4期幼虫
采用体外培养法获得捻转血矛线虫L4期幼虫[4]。
1.2 方法
1.2.1 捻转血矛线虫H11蛋白的提取
自然感染的成虫虫体与离体培养至L4晚期的虫体的H11蛋白的提取方法相同。将虫体用PBS彻底清洗干净,放入大约和虫体等重的含0.02%叠氮化钠的PBS(PBS/a)中,-20°C保存备用。
取虫体15~25 g,在少量PBS/a中用剪刀剪碎,然后加入约10倍虫体体积的冰预冷的PBS/a在匀浆器里进行组织匀浆,匀浆液15 000 r·min-1离心。弃掉上清液(包含大量捻转素和其他盐溶性蛋白质),沉淀用PBS/a再次重悬后离心。为了去除沉淀表面的膜蛋白和残留的捻转素,将沉淀在PBS/a中用1%Tween 20萃取,并于冰水混合物中静置1 h,然后10 000 r·min-1离心弃上清。所得沉淀在PBS/a中用1%Thesit(Polyoxyethylene 9 lauryl ether,Boehringer mannheim gmbH)或TritonX-100以同样步骤萃取4次,所得上清浓缩备用。
1.2.2 捻转血矛线虫H11蛋白的纯化
将上述获得的上清液装入透析袋,外加聚乙二醇覆盖即撒在透析袋外置于4℃下,透析好后-20℃保存备用。
在对含H11蛋白的溶液纯化之前所要用的缓冲液先用PDl0柱更换成含下述成分的溶液,5 mmol·L-1CH3COONa,pH 5.2,100 mmol·L-1NaCl,1 mmol·L-1CaCl2,1 mmol·L-1MnCl2,0.02%NaN3包含0.1%Thesit(Con A buffer)。先用1 mol·L-1NaCl和0.1 mol·L-1NaCl充分洗涤Con A柱,再把用PDl0柱更换的缓冲溶液加入到伴刀豆球蛋白A-交联结合的琼脂糖柱上,流洗5~10个柱床体积平衡柱子备用。
将浓缩后的蛋白样品加至Con A凝集素亲和琼脂糖柱上,4℃旋转反复循环上柱以保证样品充分吸附后,平衡缓冲液流洗10个柱床体积(流速0.10 mL·min-1),至吸收峰 280 nm降至基线后,500 mmol·L-1的α-D-吡喃葡萄糖苷开始洗脱(流速0.10 mL·min-1),每管收集1 mL,至吸收峰280 nm降至0.1以下终止洗脱,收集各管洗脱液,每管各取50 μL进行SDS-PAGE电泳分析。
1.2.3 测定H11蛋白的氨基肽酶活性
1.2.3.1 氨肽酶M(ApM)活性测定
用250 μL HEPES(羟乙基哌嗪乙磺酸,50 mmol·L-1,pH 7.4)分别溶解 1、2、4、8、16、32 μg成虫H11蛋白和L4 H11蛋白,于37℃保温10 min 后,加入 10 μL 底物(25 mmol·L-1L-亮氨酸-P-硝基苯胺),于37℃反应15 min后,分别测定其D405值。
1.2.3.2 氨肽酶A(ApA)活性测定
方法同氨肽酶M(ApM)活性测定,底物为25 mmol·L-1L-谷氨酸-P-硝基苯胺。
1.2.4 H11氨基肽酶酶抑制剂敏感性
取成虫及L4期幼虫H11蛋白各8 μg溶解于250 μL HEPES 缓冲液(50 mmol·L-1,pH 7.4)中,分别加终浓度为0、0.01、0.05、0.1、0.5、1.2 mg a.i.·L-1的蛋白酶抑制剂:EDTA、邻二氮杂菲,37℃保温10 min后加10 μL底物(同氨基肽酶活性测定),37℃反应15 min,分别测定D405值。
2 结果与分析
2.1 H11蛋白的提取与纯化
SDS-PAGE结果表明,用PBS和1%Tween预提取后再用1%Thesit提取整个虫体,如图1所示,泳道1最上面的箭头所示条带为成虫H11蛋白,H11下面的条带为虫体杂蛋白。泳道2箭头所示为L4体内H11蛋白。泳道3箭头所示为捻转素,分子质量为56 ku,富含H11的条带中没有捻转素。
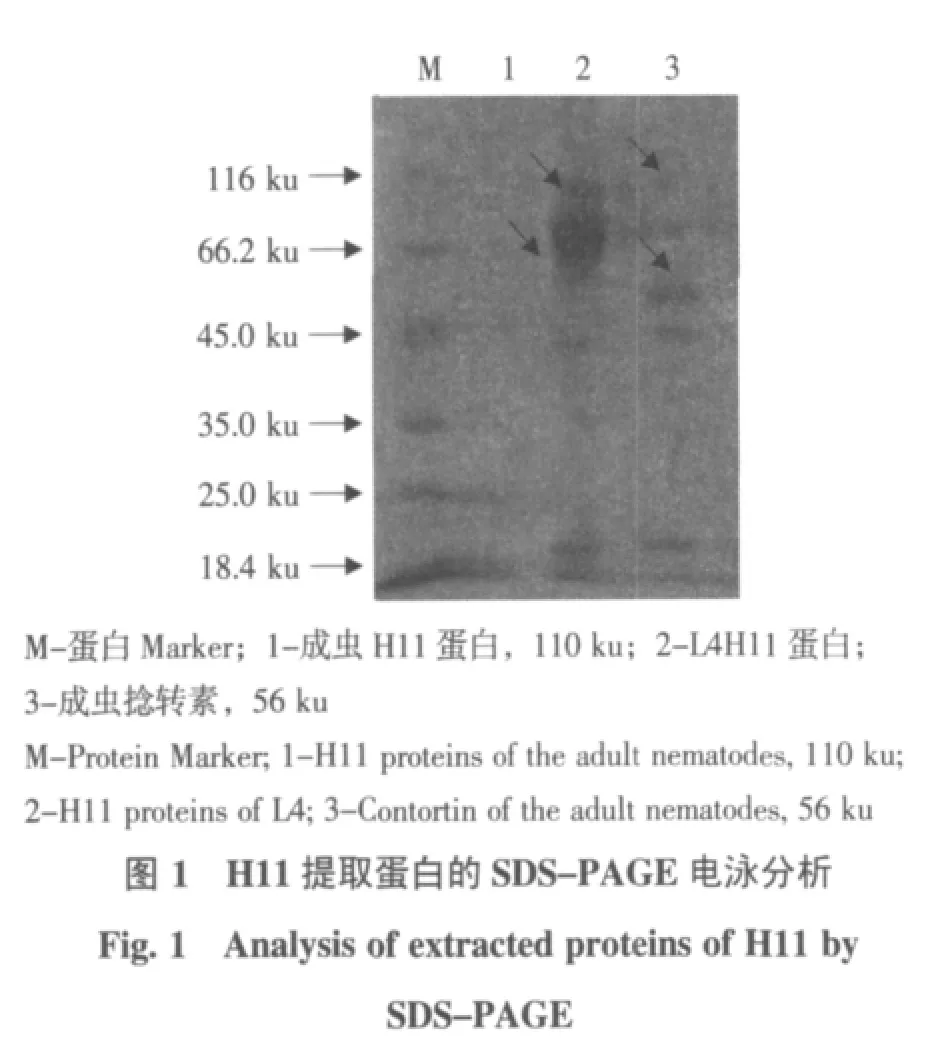
H11蛋白(抗原)是捻转血矛线虫成虫消化过程中所必需的一种酶类。由图1可知,H11蛋白在体外培养的L4期幼虫体内也有表达,可能是因为L4期幼虫已经开始利用形成的口囊从体外获取血源物质,并利用此蛋白作为消化酶进行消化,以此来获取虫体进一步成长发育的营养物质。
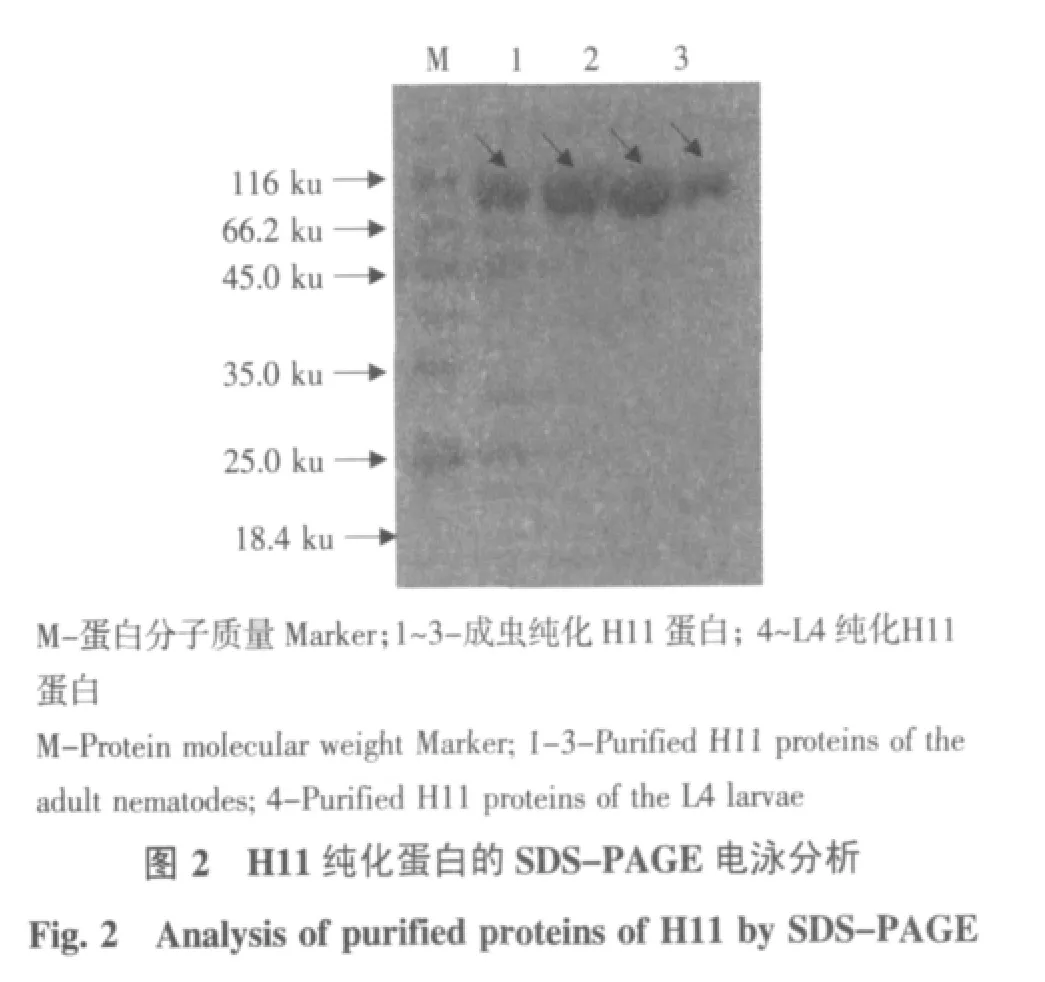
纯化的H11蛋白进行SDS-PAGE电泳,结果如图2所示。在虫体用量相同的情况下,L4期幼虫H11蛋白经ConA凝集素亲和琼脂糖柱后,收集各管洗脱液,所跑条带不明显,需要在ConA柱上再纯化一遍,但条带仍较成虫条带窄、颜色浅。用紫外分光光度计分别测定纯化的成虫及L4晚期幼虫体内H11蛋白浓度,测定其OD260和OD280值,以稀释液作为空白对照,测定结果为15 g成虫和15 g L4期幼虫体内H11蛋白含量分别为0.59和0.28 mg。
由此可知,H11蛋白主要存在于成虫体内,原因可能是由于成虫虫体大,吸血多,发育完全,而L4期幼虫在体外只靠吸血获得营养物质,虫体似乎不能完成L4至成虫的发育,表明皱胃内容物及皱胃粘膜中的某些成份也是虫体生长发育必不可少的营养物质。L4体内的H11蛋白含量少,且较成虫提取步骤繁琐。因此对L4期幼虫的体外培养还需进一步的研究,以尽早得到在体外培养条件下使L4幼虫发育到成虫的培养系及培养条件。
2.2 酶活性测定
2.2.1 氨肽酶M(ApM)活性分析
测定不同含量的成虫H11蛋白和L4 H11蛋白对底物L-亮氨酸-P-硝基苯胺的酶促反应速度关系。结果如图3所示,两组蛋白都能对底物L-亮氨酸-P-硝基苯胺有酶解能力,且D405值随着蛋白量的增加而增加,H11-成虫比H11-L4活性稍高,其D405值可达0.35左右。
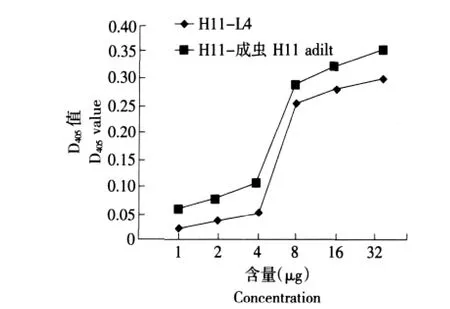
图3 H11蛋白量与酶促反应速度关系Fig.3 Relationship of H11 proteins concentration with enzymatic reaction velocity
2.2.2 氨肽酶A(ApA)活性分析
测定不同含量的成虫H11蛋白和L4幼虫H11蛋白对底物L-谷氨酸-P-硝基苯胺的酶促反应速度关系。结果如图4所示,两组蛋白都能对底物L-谷氨酸-P-硝基苯胺有酶解能力,且D405值随着蛋白量的增加而增加,H11-成虫比H11-L4活性稍高,其D405值可达0.36左右。
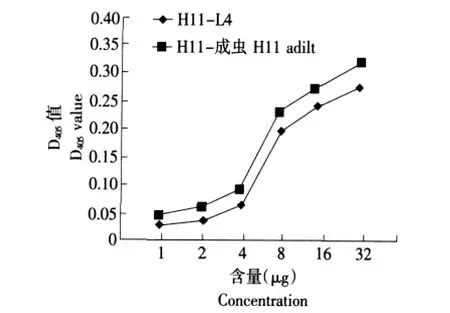
图4 H11蛋白量与酶促反应速度关系Fig.4 Relationship of H11 proteins concentration with enzymatic reaction velocity
总之,酶活性测定结果表明,两组蛋白都能对合成底物L-亮氨酸-P-硝基苯胺和L-谷氨酸-P-硝基苯胺有酶解能力,且D405值随着蛋白量的增加而增加,说明H11作为氨肽酶既具有氨肽酶M(ApM)活性也具有氨肽酶A(ApA)活性,H11-成虫比H11-L4活性稍高,其D405值可达0.35~0.36。
H11蛋白作为寄生阶段捻转血矛线虫小肠微绒毛上皮细胞中的一种跨膜糖蛋白,具有氨基肽酶活性,这是H11之所以具有较好的免疫保护作用的主要原因[5]。H11-成虫比H11-L4的氨肽酶活性稍高,可能是由于虫体发育程度的差异,成虫虫体大,吸血量大,体内H11含量较L4多,进一步表明H11的氨肽酶活性可能存在阶段性表达。
2.3 H11蛋白酶抑制剂敏感性测定
测定两组H11蛋白对酶抑制剂的敏感性表明,H11-成虫、H11-L4对非特异性蛋白酶抑制剂EDTA和哺乳动物氨肽酶抑制剂邻二氮杂菲均敏感(见图5、6),且D405值随着酶抑制剂的增加而减少,H11-成虫比H11-L4敏感性稍高,两组蛋白对邻二氮杂菲较EDTA更为敏感。

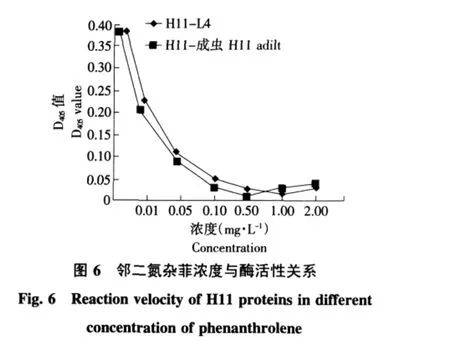
EDTA是非特异性蛋白酶抑制剂,EDTA能与酶活性中心的金属离子鳌合抑制蛋白酶的活性。有试验结果可知,EDTA对氨基肽酶活性有抑制作用,所以分析可得,该酶是金属依赖性酶类。H11对哺乳动物氨肽酶抑制剂邻二氮杂菲均敏感,H11对氨肽酶A和氨肽酶M在同源性上均有一定的相似,大约有30%的氨基酸一致,这表明与哺乳动物氨肽酶保守区域周围位点有很高水平的同一性。
3 讨论与结论
H11蛋白是寄生阶段捻转血矛线虫小肠微绒毛上皮细胞中的一种跨膜糖蛋白,具有氨基肽酶活性,氨基肽酶是成虫消化过程中必须的一种酶类,由于成虫虫体大,吸血多,发育完全,通过对L4及成虫体内H11的纯化及含量测定可以看出,与成虫相比L4期幼虫体内H11含量少(约不到成虫的一半),而且较成虫H11蛋白提取步骤繁琐,存在一定难度。可见捻转血矛线虫H11蛋白的提取纯化还需进一步的研究,以尽早得到在体外培养条件下使L4幼虫发育到成虫的培养系及培养条件。
H11之所以具有较好的免疫保护作用,Smith等认为,该抗原(氨基肽酶)是成虫消化过程中所必需的一种酶类,成虫吸血后,血液中抗H11抗体与捻转血矛线虫微绒毛上的H11结合,使得该酶活性降低或丧失[5]。因为雌虫虫体较雄虫大,吸血多,抗H11抗体也多,所以其代谢受到的影响大。由H11天然蛋白的免疫保护结果可以看出,雌虫减少率高于雄虫,虫卵减少率高于雌虫和雄虫。Clare等在研究疟疾时发现,氨基肽酶抑制剂能有效抑制Plasmodium falciparum的生长发育,并推测氨基肽酶在分解血红蛋白多肽中发挥重要作用[6]。
对L4幼虫及成虫H11蛋白的氨基肽酶活性分析表明,H11天然蛋白同时具有氨肽酶M活性和氨肽酶A活性。在测定H11蛋白的活性时发现,H11-成虫的酶活性比H11-L4稍高。由于试验没有氨基肽酶阳性对照,H11蛋白的酶促动力学常数无法给出,只能定性地反映氨肽酶活性。
对H11酶抑制剂敏感性测定得出EDTA和邻二氮杂菲对其酶活性均有抑制作用。H11是一种功能性酶,它的氨肽酶M(ApM)是锌结合的金属酶类,对N端残基二肽有比较宽泛的专一性,EDTA是非特异性蛋白酶抑制剂,能与酶活性中心的金属离子鳌合。本试验中EDTA对氨基肽酶活性有抑制作用,证明该酶是金属依赖性酶类。因H11对EDTA等敏感,在提取过程中要注意避免接触此类物质以防蛋白变性。氨肽酶A(ApA)是钙结合的酶类,优先分解以酸性氨基酸为残基的底物。H11对哺乳动物氨肽酶抑制剂邻二氮杂菲均敏感,H11对氨肽酶A和氨肽酶M在同源性上均有一定的相似,大约有30%的氨基酸一致,这表明与哺乳动物氨肽酶保守区域周围位点有很高水平的同一性。Munn等使用十二烷基磺酸钠(SDS)和二硫苏糖醇(DTT)处理H11,改变H11的天然构象,再分别免疫绵羊,发现虫卵减少率分别为85%、79%,成虫减少率分别为79%、54%,说明H11变性后,仍有较强的免疫保护作用,从而证明H11存在大量线性化的抗原表位[7]。但变性后的H11与天然H11相比,虫卵和成虫减少率均有所下降,这表明H11不仅存在大量线性化的抗原表位,且具有一些构象依赖性抗原决定簇。
[1]Knox D P,Smith W D.Vaccination against gastrointestinal nematode parasites of ruminants using gut-expressed antigens[J].Veterinary Parasitology,2001,100(1/2):21-32.
[2]高玉红,郭照成,刘方悦,等.多拉菌素的研究进展及应用[J].东北农业大学学报,2009,40(4):141-144.
[3]Newton S E,Munn E A.The development of vaccines against gastrointestinal nematodeparasites,particularly Haemonchus contortus[J].Parasitol Today,1995,15(3):116-122.
[4]严若峰,徐立新,李祥瑞.捻转血矛线虫纯净3期幼虫制备方法的改进[J].Animal Husbandry&Veterinary Medicine,2009,41(1):86-88.
[5]Smith T S,Munn E A,Graham M,et al.Purification and evaluation of the integral membrane protein H11 as a protective antigen against Haemonchus contortus[J].Int J Parasitol,1993,23(2):271-280.
[6]Clare S G,John P D,Angus B.The role of aminopeptidase in haemoglobin degradation in plasmodium falciparum infected erythrocytes[J].Mol Biochem Parasitol,2001,17:37-48.
[7]Munn E A,Smith T S,Smith H,et al.Vaccination against Haemonchus contertus with denatured forms of the protective antigen H11[J].Parasitol Immunol,1997,19:243-248.

