15N标记法研究不同精粗比底物对山羊瘤胃内原虫与细菌间蛋白质微循环的影响
扬州大学动物科学与技术学院 刘 翔 张红伟 董淑红 王洪荣* 熊 浩
反刍动物瘤胃内的微生物既能降解代谢粗饲料资源供宿主动物利用,又是宿主动物的优质微生物蛋白饲料源,他们对缓解资源紧缺、节约蛋白质饲料、保持畜牧业可持续发展有重要的意义。反刍动物对氮源的利用效率较低 (0%~35%)(Lobley,1992),而瘤胃内原虫对细菌的吞噬是造成瘤胃内微生物蛋白(MCP)再循环、氮利用效率低下的主要因素之一。反刍动物日粮的组成不同,会通过影响瘤胃发酵而影响原虫群体。如饲喂大量精料后瘤胃pH值可能降至6.0以下,原虫将全部消失(Brown 等,2006;Franzolin 等,1996);不同结构日粮显著影响瘤胃内原虫种群结构 (王梦芝等,2007)。而这些由于日粮带来的原虫的变化除了直接影响MCP产量外;还将不可避免地影响原虫对细菌的吞噬,即通过影响瘤胃微生态的微生物循环而间接影响MCP量、氨基酸组成和氮利用效率,这也是利用反刍动物营养生理特点,通过调节饲料类型以达到调控消化道氮素营养的契机之一。
近些年来,随着同位素示踪技术在动物营养上的不断发展和应用,尤其是利用稳定性同位素15N研究含氮物质在动物机体内的吸收、利用和循环,已成为一个研究的热点。本试验拟以不同精粗比底物条件下瘤胃原虫与细菌间蛋白的周转规律为研究目标,以瘤胃原虫对细菌的吞噬速率及吞噬量为研究重点,采用稳定性同位素标记示踪技术,测定不同精粗比底物条件下山羊瘤胃原虫对细菌的吞噬速率,探讨底物精粗比对微生物蛋白微循环量和细菌周转率的影响规律,为通过日粮类型调控微生物蛋白,进而提高反刍动物生产性能和蛋白质饲料利用效率提供试验依据。
1 材料与方法
1.1 试验动物 4头体重为 (25±3)kg的健康徐淮山羊,安装永久性瘤胃瘘管,用以采集混合瘤胃液。单圈饲养,自由清洁饮水。粗饲料为铡短的(3 cm)羊草,精料为玉米、豆粕、NaCl 0.5%、添加剂1%,参照NRC(1981)的山羊营养需要推荐量,试验羊每日代谢能供给量为推荐量的1.2倍,每日08∶00 和 18∶00 等量饲喂。
1.2 体外发酵装置 发酵装置由恒温振荡水浴锅和250 mL三孔(进气孔、出气孔及采样通道)的橡皮塞的锥形瓶组成。锥形瓶用橡皮塞塞好后,通二氧化碳并调节气体流量,使其在39℃条件下培养。
1.3 人工唾液 按照Menke和Steingass(1988)的方法配制。
1.4 试验设计 试验采用单因子四水平试验设计。
1.5 吞噬试验
1.5.1 试验分组 试验分为细菌组(180 mL培养体系)和原虫组(150 mL培养体系)。培养底物为精料(玉米:豆粕=65∶35)和粗饲料(羊草),其中细菌组1.8 g/瓶,原虫组1.5 g/瓶。处理仍按精粗比不同分为 A(1∶9)、B(3∶7)、C(5∶5)、D(7∶3)四个组,每组 3个重复。 标记物为15N-(NH4)2SO4(由上海化工研究院购买,丰度为99.14 atom%),添加量为 350 mg/L(细菌组)。
1.5.2 试验步骤 (1)采集混合瘤胃液,四层纱布过滤,与人工唾液盐(事先通CO2至饱和,于39℃水浴30 min)2∶1的比例放入装有培养底物(细菌组1.8 g/瓶;原虫组1.5 g/瓶)的锥形瓶,细菌组共180 mL,原虫组共150 mL,塞好橡皮塞,通过进气通道通入二氧化碳气体,进气口于瓶底,调节气体流速,39℃恒温水浴振荡 (125 r/min)培养6 h;(2)培养到6 h时,将细菌组培养液300目滤布过滤,200 g离心15 min,上清液转入装有相同培养底物并加有15N标记物的培养瓶内继续在原来的条件和环境下培养(标记细菌);(3)标记1.5 h时从细菌组各取30 mL样待测标记率 (刘翔等,2010)及计数细菌。同时将原虫组200 g离心15 min,沉淀转移至对应的细菌组,进行吞噬试验。(4)分别于 0、15、30、45、60 min 和 75 min 取 20 mL,立即加等量的甲醛溶液。之后200 g离心15 min无损失的转移至10 mL离心管中,200 g离心15 min,弃上清,沉淀真空冷冻干燥 24 h;(5)将干燥后的沉淀准确称重,记录结果即为原虫产量,之后无损失的转至凯氏消化管内,消化2 h后全微量法凯氏定氮;(6)吸收液中加入0.1 mol/L的盐酸几滴,75℃下水浴浓缩至1~3 mL,上质谱仪测定样品中15N丰度。(7)吞噬末取样1 mL,并与1 mL MFS混合,用于计数原虫。
1.6 瘤胃微生物的计数
1.6.1 原虫 以MFS染液(NaCl 8 g,甲基绿0.6 g,福尔马林溶液100 mL,定容至1000 mL)染色,用血球计数板在光镜下计数(100×,400×)。

式中N为计数的四个中方格的总数;D为稀释倍数。
1.6.2 细菌 以结晶紫溶液染色和做倍比稀释,用计数板在油镜下计数(×1000)。

式中N为计数方格的总数;S为计数方格数;D为稀释倍数。
1.7 计算公式
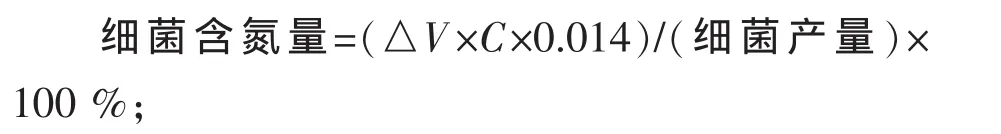
式中△V为滴定时所用盐酸标准溶液的体积,mL;C为盐酸标准溶液摩尔浓度,mol/L;0.014为氮的毫摩尔质量。
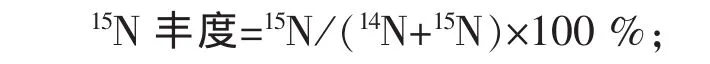
15N 富 集 量=(微 生 物 产 量 ,mg)×(N%)×(15N%);
细菌对 (NH4)2SO4利用率=细菌中15N量/添加硫酸铵中15N量×100%;
细菌蛋白循环率=原虫吞噬细菌N量/细菌总N量×100%。
1.8 统计方法 试验数据采用Excel软件进行整理,运用SPSS 13.0统计软件进行统计分析,差异显著性采用LSD法进行多重比较。
2 结果与分析
2.1 不同精粗比底物条件对瘤胃细菌15N标记率的影响 见表1。
由表1可以看出:细菌产量以D组最高,B组与D组间差异不显著,B、D两组极显著高于A、C组,而A组与C组间差异不显著;A组和C组的细菌含氮量极显著高于B、D组,而A组与C组间、B组与D组间差异均不显著,其中以A组的细菌含氮量最高,达到9.32%,而B组仅为5.69%;细菌的15N丰度为B组与C组极显著高于A组和D组,且B组与C组间、A组与D组间差异均不显著,B组的15N丰度为四组中最高,15N丰度最小的是A组,为5 atom%;细菌15N富集量以B组最高,达到258.79 μg/30 mL,B组与D组间差异不显著,而极显著高于A、C两组,D组与C组间差异不显著,而极显著高于A组,且A组与C组间差异不显著;细菌对硫酸铵利用率以B组最高,达到11.72%,B组与D组间差异不显著,而极显著高于A、C两组,D组与C组间差异不显著,而极显著高于A组,且A组与C组间差异不显著,其中A组细菌对硫酸铵利用率最低,仅为4.91%;细菌15N标记率以A组最高,其次为C组,D组的标记率为四组中最低,仅达到53.86%。
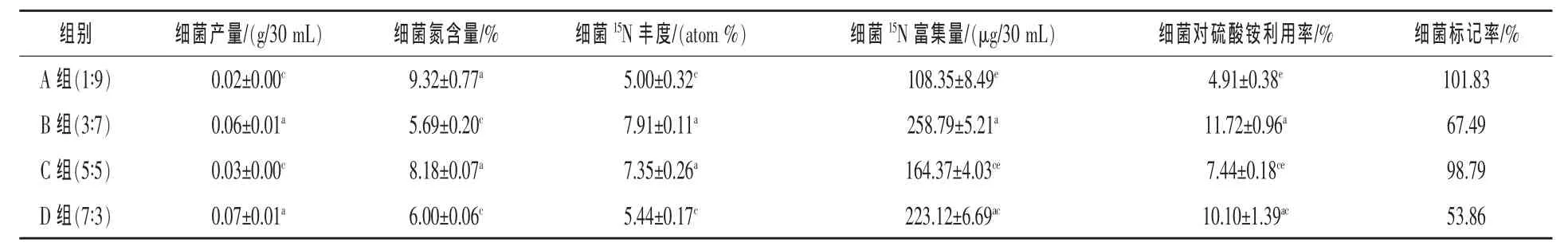
表1 不同精粗比对瘤胃细菌15N标记的影响
2.2 不同精粗比底物对瘤胃原虫吞噬细菌的吞噬量与吞噬N速率的影响 吞噬量与吞噬时间的线性关系是吞噬速率的计算的基础,确定摄食试验的时间对保证试验结果的可靠性尤为重要。由于原虫的摄食特性受内外因素影响较大,而目前对其摄食规律了解并不深入,因此每一次试验应该以摄食预试验的结果为参考。据本次试验预试验结果分析,综合考虑后将原虫的吞噬速率计算时间定到75 min。如图1所示,在75 min内吞噬量线性上升,未达到平台与下滑期;进一步对75 min内吞噬量与时间线性回归分析,各组拟合方程的R值都在0.939之上,也反映了吞噬量与吞噬时间的良好线性关系,说明在该时间段之内吞噬试验结果的可靠性较高。因此针对本研究的具体情况摄食试验时间确定为75 min较为客观可靠。
对原虫的吞噬量与时间进行75 min内线性回归分析,回归方程为:
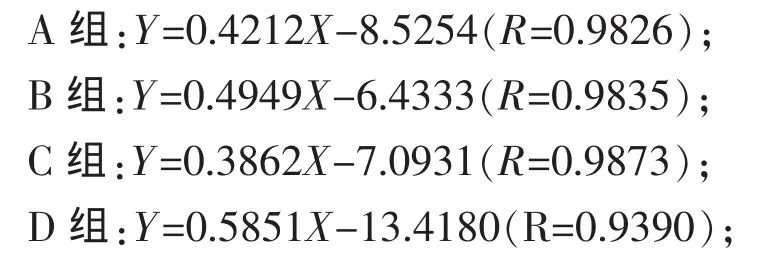
式中:Y为原虫吞噬细菌N量(pg/cell),X为吞噬时间(min)。
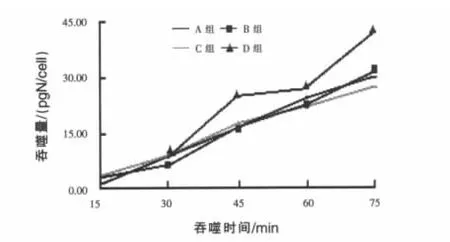
图1 不同精粗比底物下原虫吞噬量随时间的变化
由回归方程可以计算原虫的吞噬N速率,A、B、C、D 组分别为 25.27、29.69、23.17 pg/(cell·h)、和 35.11 pg/(cell·h)。
2.3 不同精粗比底物对瘤胃微生态的影响 见表2。
由表2可见,瘤胃原虫的密度以C组(5∶5)最高,极显著高于其他三组,D组极显著高于A、B两组,而A组与B组差异不显著,B组(1∶9)为四组中最低,仅为7.13×104cells/mL;在本试验设置的日粮条件下,原虫密度有随着精粗比上升而上升的趋势,但在精粗比最高的D组(7∶3)又有所下降。瘤胃细菌密度以 B 组(3∶7)最高,达 2.02×1010cells/mL,极显著高于A、C两组,而与D组差异不显著,A 组(1∶9)细菌密度最低。
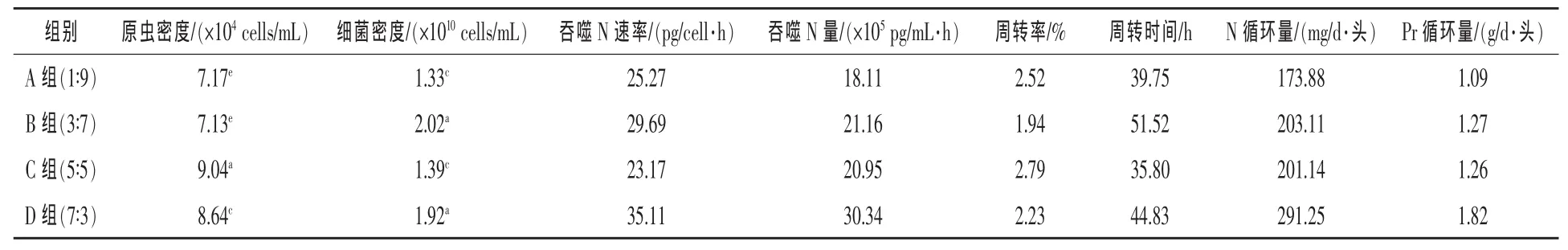
表2 饲料精粗比对瘤胃微生态的影响
A、B、C、D 四组吞噬 N 速率(见表 2)分别为:25.27、29.69、23.17 pg/(cell·h)和 35.11 pg/(cell·h)。四组间差异明显,以D组最高,C组最低。
根据原虫的密度计算原虫对细菌的吞噬N量结果(表2)表明:以D组最高,为30.34×105pg/(mL·h), 以下依次为 B 组 21.16×105pg/(mL·h),C 组 20.95×105pg/(mL·h),A 组最低,为 18.11×105pg/(mL·h),这与原虫吞噬 N的速率高低顺序有所不同,造成的原因是由于作为吞噬者的原虫细胞密度不同所致。结合细菌的密度再计算由于原虫吞噬造成的细菌蛋白循环的周转时间和周转率,结果表明:以 B 组(3∶7)周转率最低,为 1.94%(即每小时约有1.94%的细菌被原虫吞噬),周转时间最长为51.52 h(即因为原虫吞噬经过51.52 h细菌可周转更新一轮);以 C 组(5∶5)周转率最高为2.79%,周转时间最短为35.80 h;另外A组(1∶9)拥有较高的周转率(2.52%)和较短的周转时间(39.75 h),与细菌吞噬量最高的 D 组(7∶3)基本接近。
2.4 不同精粗比底物对瘤胃内MCP微循环的影响 据所测定的各组的细胞密度,以4 L来估计山羊瘤胃内容物(冯仰廉,2004),估测 A、B、C 和D各组每天每头山羊因原虫吞噬导致的细菌N循环量分别为:173.88、203.11、201.14、291.25 mg。以系数6.25转换成各组菌体蛋白循环量也列于表2,其中D(7∶3)组每天每头山羊MCP循环量最大,达到 1.82 g,接下来是 B 组(1.27 g)和 C 组(1.26 g),A 组(1∶9)最低,仅为 1.09 g。
3 讨论
3.1 不同精粗比底物对15N标记瘤胃细菌的影响 底物不同精粗比对细菌产量、细菌含氮量、瘤胃细菌15N富集量以及对硫酸铵的利用率均有显著影响,从而造成15N标记细菌的标记率方面存在一定差异(刘翔等,2010)。本试验结果发现,细菌产量以B组和D组较高,极显著高于A、C两组,这与表3中所体现的细菌密度具有一致性,由于在精粗比为3∶7和7∶3时细菌密度较高,所以在此处理下细菌的产量较大。这也是造成B组和D组瘤胃细菌15N富集量高于其他两组的原因。而B组虽然具有最高的15N富集量和最高的硫酸铵利用率,但细菌标记率却只有67.49%,这是因为瘤胃细菌中可以利用硫酸铵的种类相对固定,虽然在精粗比为3∶7时细菌对硫酸铵的利用率很高,也使得15N在瘤胃细菌中的绝对含量达到最高,但由于B组细菌数量为四处理中最高,因此其相对比例并不高,即在精粗比为3∶7的条件下瘤胃细菌标记率较低的原因。
3.2 不同精粗比底物对瘤胃微生物细胞密度的影响 原虫以吞噬和降解淀粉与多糖为主,但日粮中一定范围比例的粗饲料有利于原虫的生长,粗饲料的比例在40%~50%时原虫的密度最大,其种类也最丰富;精料比例过高会导致瘤胃pH剧降,而使原虫群体减少甚至消失。本研究中原虫的密度以5∶5组最高,并有随精粗比上升而上升的趋势,与以上观点有一定的一致性。但在精粗比最高的7∶3组原虫的密度又下降,这可能是由于精粗比进一步上升导致了pH迅速下降,在一定程度上限制了原虫生长所致。
精粗比不合理是影响MCP合成效率及动物生产的重要因素之一。杨红建和冯仰廉(2003)研究表明RSI发酵罐中72 h时微生物N的产量以培养底物的纤维素与淀粉比率最高时最小,回归分析认为在可利用N相同条件下,MCP合成效率取决于底物中结构性和非结构性碳水化合物比率。Firkins(1996)认为,为了实现MCP的最大合成,反刍家畜日粮中应含有适宜的谷物和脂肪比例。本试验结果也印证了日粮的组成是影响MCP合成的这一观点;结果同时表明精粗比为1∶9组原虫和细菌的密度都较低,提示粗饲条件下不利于MCP合成。
微生态系统中的原虫与细菌之间在既定条件下是相互影响的。原虫对细菌的捕食可能导致细菌群体减少;而细菌的密度、生态位也反过来影响原虫对其的捕食,有些细菌甚至对原虫的捕食有抵御能力。因此,瘤胃微生态中细菌群体的减少可能是由于原虫对细菌的捕食而导致。Nhan等(2007)研究20 d试验期内牛瘤胃微生物的动态变化,结果表明,细菌密度有伴随着原虫密度下降而提高的趋势,并指出瘤胃原虫与细菌之间的互作关系基本上是已经定论。本试验中细菌的密度C组小于B组,除了日粮的影响外,还可能与原虫密度从B组到C组变大,而导致对细菌的捕食增加有一定的关系。
3.3 不同精粗比底物对瘤胃原虫吞噬速率的影响 本试验中,徐淮山羊瘤胃原虫吞噬细菌N的速率为 23 ~ 30 pg/(cell·h),且通过计算得出的蛋白微循环量也与Coleman等(1979)估算的原虫每日可吞噬2.5~4.5 g细菌干物质相近,表明本研究的可靠性。但原虫生长环境的理化状况(pH、NH3等)、原虫本身(种属、生长期、繁殖周期和细胞密度)、食物精粗比、细菌密度等诸多因素均影响原虫吞噬细菌速率(洪华生等,2001)。食物的影响则表现在当细菌浓度低时,摄食速率与食物浓度成正比;当食物浓度到了一定程度后食物浓度再提高摄食速率也不再增加。如当细菌的浓度达到80~100 mg/L后,原虫的摄食速率不再增加;食物浓度继续提高将导致其摄食、繁殖速率的下降(梁鹏等,2003)。本试验结果发现,随着精料添加量的增加,培养体系的pH值不断下降,D组(7∶3)原虫密度极显著低于C组(5∶5),原虫数目的减少说明原虫的活性受到了抑制作用,进而对原虫的种类及其摄食活动产生了影响。
前面也已经提到,底物结构的改变将通过影响瘤胃的理化状况、原虫的种属结构而影响原虫对细菌的吞噬速率。在一定范围内增加多糖与淀粉的比例能提高原虫的活力和促进原虫的生长。本试验也发现,在一定的精粗比范围内,瘤胃原虫数量有随精料比例上升而上升的趋势,且原虫吞噬细菌速率的结果也表现出比较大的差异,其中以 D 组(7∶3)最高,而 C 组(5∶5)为四处理中最低。其从 A 组(1∶9)到 B 组(3∶7)吞噬速率的上升可能是由于上述原因,即细菌浓度低时,摄食速率与食物浓度成正比所致;而由C组到D组原虫吞噬率升高的原因也与细菌密度有直接的关系,或者也可能因为特定的日粮选择了特定的原虫种属,而不同种属原虫其吞噬速率有所不同 (Simek等,1995)所致。由于瘤胃微生态系统十分复杂,影响原虫吞噬速率的因素又较多,加之此领域研究中目前还没有很多的文献可以参考,因此以上研究结果或推断需在进一步的试验中加以验证。
3.4 不同精粗比底物对瘤胃微生态和微生物蛋白微循环的影响 若以通常报道的瘤胃原虫吞噬细菌的速率102~104cells/mL、 原虫105~106cells/mL、细菌109~1011cells/mL计,则由于原虫的吞噬约12 h可使得细菌更替一次。研究同时表明原虫不存在时细菌的更替率为0.3%~2.7%,而原虫存在时更替率增加为2.4%~3.7%。反刍动物瘤胃内的原虫无法利用氨合成自身蛋白,必须利用饲料和微生物中的蛋白质作为其主要的氮源。尽管原虫具有部分降解蛋白质的能力,但其降解速度很慢,细菌还是瘤胃中降解蛋白质的主要微生物。细菌先将可溶性蛋白吸附在细胞表面或是吸附到不溶性蛋白质上,再由其胞联酶发挥降解作用。瘤胃细菌所分泌的蛋白分解酶为混合型,不同种类细菌在蛋白降解中有互补特异性的协同效应,而利于饲料蛋白质的降解。
由于原虫对细菌和真菌的吞噬作用,会导致MCP的产量下降,增加宿主动物对蛋白质的维持需求,同时由于原虫在瘤胃内的滞留时间较长,且在反刍过程中与氧气接触的机会多,大部分原虫会因为自溶而死亡,因此原虫氮很少能够进入真胃和十二指肠为宿主所利用。反刍动物日粮组成不同,导致发酵后瘤胃pH值变化不同,因此日粮结构被认为是影响瘤胃原虫数量和种属变化的主要因素。通常情况下,采食全粗饲料的奶牛瘤胃内含 4×105~6×105个/mL内容物,随着日粮中精料的增加,日粮能量也随之提高,动物瘤胃内的原虫数量也将随之提高(Dehority等,1997)。当日粮中粗饲料含量占到40%~50%时,瘤胃内原虫数量最大,种类也最丰富。
本试验中D组具有较高的原虫密度和最高的吞噬速率,因此其蛋白循环量最高,为1.82 g/(d·头)。C组吞噬速率最低,但由于原虫密度最高而细菌密度很低,所以具有最高的循环率和最短的周转时间。B组虽然吞噬速率相对较高,但由于原虫密度最小,而细菌密度最高,所以循环率最低,为1.94%,被更新一次的时间最长,需51.52 h,计算得出,该组菌体蛋白循环量为1.27 g/(d·头),仅为D组的69.78%,提示该底物组合能够较好的减少微生物蛋白的循环量。值得注意的是A组,虽然吞噬量最低,菌体蛋白循环量也仅为1.09 g/(d·头),但由于其细菌密度为四组中最小,所以细菌的循环率依然较高,为2.52%,并可在39.75 h内被周转更新一次。这提示:在粗饲条件下原虫的吞噬更容易影响微生物蛋白产量和宿主蛋白质营养,而且研究也表明,在缺乏外源蛋白情况下原虫会迅速降解瘤胃内源蛋白,并摄入和消化细菌蛋白(Wallace等,1997)。
4 结论
4.1 日粮精粗比显著影响瘤胃微生物细胞的密度。原虫密度以C组(5∶5)最高,而细菌密度则以B 组(3∶7)最高,A 组(1∶9)原虫和细菌的密度均较低。
4.2 日粮精粗比显著影响瘤胃原虫吞噬细菌N的速率及吞噬量。各组吞噬N量分别为:18.11×105、21.16 ×105、20.95 ×105、30.34 ×105pg/(mL·h),以A组最低。
4.3 日粮精粗比显著影响山羊瘤胃内菌体蛋白的微循环。每天每头山羊因原虫的吞噬而带来的菌体蛋白内循环量各组分别为:1.09、1.27、1.26、
1.82 g,其中以 C 组(5∶5)循环率最大(2.79%),D组(7∶3)蛋白循环量最高,而 B 组(3∶7)循环率最低(1.94%),且蛋白质周转量仅为 D 组(7∶3)的69.78%,可有效减少菌体蛋白循环量。
[1]冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.2~102,131~143.
[2]洪华生,柯林,黄邦钦,等.用改进的荧光标记技术测定具沟急游虫的摄食速率[J].海洋与湖沼,2001,32(3):260 ~ 266.
[3]梁鹏,黄霞,钱易,等.污泥减量化技术的研究进展[J].环境污染治理技术与设备,2003,4(1):44 ~ 52.
[4]刘翔,王洪荣,王欢莉,等.不同精粗比底物对瘤胃细菌标记率的影响[J].上海畜牧兽医通讯,2010,1:15 ~ 17.
[5]王梦芝,王洪荣,李国祥,等.不同淀粉与滤纸纤维比例底物体外培养条件下对瘤胃发酵和微生物的影响[J].动物营养学报,2007,19(6):654~662.
[6]杨红建,冯仰廉.不同纤维素与淀粉比率等氮纯化底物瘤胃发酵微生物蛋白质合成量[J].中国畜牧杂志,2003,39(4):7 ~ 9.
[7]Brown M S,Ponce C H,Pulikanti R.Adaptation of beef cattle to highconcentrate diets:Performance and ruminal metabolism1[J].Journal of Animal Science,2006,84(E.Suppl.):E25 ~ E33.
[8]ColemanGS.Theroleofrumenprotozoainthemetabolismofruminantsgiven tropicalfeeds[J].TropicalAnimalHealthandProduction,1979,4(3):199 ~ 213.
[9]Dehority B A,Orpin C G.Development of,and natural fluctuations in,rumen microbial populations[A].The Rumen Microbial Ecosystem[C].Hobson P N,Stewart C S.Blackie Academic&Professional,1997.196 ~ 245.
[10]Firkins J L.Maximizing microbial protein synthesis in the rumen[J].Journal of Nutrition,1996,126:1347S ~ 1354S.
[11]Franzolin R,Dehority B A.Effect of prolonged high-concentrate feeding on ruminal protozoa concentrations[J].Journal of Animal Science,1996,74:2803~2809.
[12]Lobley G E.Control of the metabolic fate of amino acids in ruminants:a review[J].Journal of Animal Science,1992,70(10):3264 ~ 3275.
[13]Menke K H,Steingass H.Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen flued[J].Animal Research and Development,1988,28:7 ~ 55.
[14]Nhan N T H,Ngu N T,Thiet N,et al.Determination of the optimum level of a soybean oil drench with respect to the rumen ecosystem,feed intake and digestibility in cattle.Livestock Research for Rural Development.http://www.cipav.org.co/lrrd/lrrd19/8/nhan 19117.htm,2007,19,Article#117.
[15]Simek K,Bobková J,Macek M,et al.Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum:A study at the species and community level[J].Limnology and Oceanography,1995,40:1077~1090.
[16]Wallace R J,Onodera R,Cotta M A.Metabolism of nitrogen containing compounds[A].Hoson P N,Stewart C S.The Rumen Microbial Ecosystem[C].Blackie Academic and Professional,London,1997:283 ~ 328.

