外源亚精胺(Spd)对盐胁迫下番茄幼苗生理生化指标的影响
张纪涛,胡晓辉,李翠
(1.西北农林科技大学资环学院,陕西杨凌,712100;2.西北农林科技大学园艺学院)
土壤盐渍化是影响农业生产和生态环境的主要的非生物胁迫之一,它对农业的影响是一个全球性的问题,全球20%的耕地和近半数的灌溉土地都受到不同程度的盐害威胁[1]。设施农业由于其自身的特点,一般都会产生不同的次生盐渍化问题,严重限制设施农业的发展。盐胁迫对植物造成的伤害主要有3种:渗透胁迫、离子毒害、营养失衡[2],表现为植物生长受限、光合速率下降、衰老加快等。
亚精胺(Spd)是生物代谢过程中产生的一种具有生物活性的低分子量脂肪族含氮碱,是多胺家族的一个重要成员。多胺广泛作用于植物生长、形态建成、衰老和对环境胁迫的反应,在多种逆境条件下,植物体内多胺含量迅速发生变化[3,4]。许多研究表明,适宜浓度的外源Spd可以提高植物的耐盐性[5~7]。番茄(Lycopersicon esculentumMill.)属于中度盐敏感植物,是设施农业栽培的主要蔬菜作物之一。盐胁迫影响番茄种子的发芽、幼苗的生长发育,导致番茄植物体组织水分亏缺、营养失衡、离子毒害,从而降低番茄产量和品质。因此通过研究Spd对番茄盐胁迫的缓解效应,对改善番茄的生长和生产,具有十分重要的意义和广阔的应用前景。
1 材料与方法
1.1 试验材料
试验选择耐盐性不同的两个番茄品种:“江蔬14号”(耐盐性弱)和“白果强丰”(耐盐性强)。于2007年9~12月在西北农林科技大学园艺场玻璃温室进行试验。
1.2 试验设计
选取大小一致、均匀、饱满的番茄种子经消毒、催芽,播种于装满珍珠岩的穴盘中,早晚浇水各1次,子叶展平后每2 d浇灌1次1/2剂量的山崎番茄配方营养液。当幼苗3叶1心时定植在玻璃温室中装有1/2剂量水培槽中。营养液pH值调至6.5~7.0。每3 d调1次pH值,4 d更换1次营养液。当幼苗长到7~8叶片时进行处理(试验设4个处理,①CKN:培养液+0 mmol/L NaCl+0 mg/L Spd;②CKP:培养液+0 mmol/L NaCl+100 mg/L Spd;③N:培养液+100 mmol/L NaCl+0 mg/L Spd;④P:培养液+100 mmol/L NaCl+100 mg/L Spd),每天于下午4:00喷施Spd一次,喷施到叶片上有欲滴的水珠为止。在处理12 d时,取样测定植株的干、鲜质量。在胁迫 0(处理前1 d)、4 d、8 d的时候,取样测定生理指标,每个处理重复3次。
1.3 试验方法
①番茄幼苗地下、地上部分的干鲜质量的测定处理12 d后,随机选取10株番茄幼苗,将幼苗用清水洗净,把地上和地下部分分开,用吸水纸擦干后称取鲜质量。然后在105℃下杀青15 min,70℃烘干至恒重,称取干质量。计算根冠比。
②叶片电导率的测定 选择完整的番茄幼苗叶片洗净擦干,用打孔器打取12个原片,放入洗净的试管中,加入10 mL蒸馏水,用真空泵抽气10 min至呈半透明状,用电导仪测定初电导值(S1),然后,置于沸水中5 min,冷却后测定电导值(S2)。按下面的公式计算相对电导率。
相对电导率(L)=(S1-S0)/(S2-S0),S0表示空白电导率。
③叶片丙二醛(MDA)含量的测定 采用硫代巴比妥酸 (TBA)染色法测定,取样品叶片1 g加10%TCA 10 mL研磨提取,离心后取2 mL上清液,加入2 mL 0.6%的TBA溶液,沸水浴反应15 min,冷却后于450 nm,532 nm,600 nm下测定吸光值,计算丙二醛的含量[8]。
④叶片脯氨酸(Pro)含量的测定 取0.5 g洗净的叶片,用3%的磺基水杨酸研磨提取,离心后取上清液用酸性茚三酮染色,于520 nm下比色测定[8]。
⑤叶绿素含量的测定 采用80%丙酮浸提法,在663 nm、646 nm波长下测定吸光值,计算叶绿素a、叶绿素b的含量。
1.4 数据处理
采用SPSS16.0软件对试验数据进行处理,Duncan's多重比较进行统计分析,Excel作图。
2 结果与分析
2.1 外源Spd对番茄幼苗地上及地下部干鲜质量的影响
试验结果如表2所示,盐胁迫总体上降低了两个品种番茄幼苗的根干质量、冠干质量和根冠比。在非盐胁迫下,外源Spd对这三个指标没有明显的影响。而在盐胁迫下,外源Spd虽然也在一定程度的上降低了两个番茄品种根、冠干质量,提高了根冠比,但这种影响作用不明显。
2.2 外源Spd对番茄幼苗叶片细胞质膜透性的影响
试验结果如图1所示。盐胁迫显著影响细胞膜透性,盐处理的白果强丰和江蔬14号番茄幼苗在处理4 d,8 d的细胞膜透性分别比对照增加了113.46%,41.92%,37.39%,68.52%。非盐胁迫下,外源Spd能降低电解质渗出率,处理4 d,8 d时,白果强丰分别比对照降低了4.62%,3.08%,江蔬14号分别降低了0.90%,20.66%。盐胁迫下,外源Spd能显著降低细胞膜透性,在处理4 d,8 d时,白果强丰番茄幼苗的相对电导率分别比对照降低了53.69%,17.34%;江蔬14号番茄幼苗的相对电导率分别比对照降低了0.66%,33.66%。说明外源Spd能保护细胞膜的完整性,减少盐胁迫对细胞膜的伤害。
2.3 外源Spd对番茄幼苗叶片中丙二醛(MDA)含量的影响


表1 外源Spd对番茄幼苗根质量、地上部质量及根冠比的影响
MDA是膜脂过氧化的产物,可用丙二醛的含量高低来代表膜脂过氧化的程度。试验结果(图2)显示,非盐胁迫下外源Spd能降低番茄幼苗叶片MDA的含量,处理4 d时白果强丰和江蔬14号中MDA含量分别比对照降低了24.29%,11.55%,处理8 d则分别降低了27.50%,18.45%。盐胁迫增加了番茄幼苗叶片内MDA的含量,处理4 d时白果强丰和江蔬14号中MDA含量分别比对照增加了50.29%,68.91%;处理8 d时分别升高了68.17%,106.55%。盐胁迫下喷施Spd能降低番茄幼苗叶片内MDA的含量,处理4 d测定白果强丰和江蔬14号两个品种中MDA含量分别比盐胁迫处理降低了22.81%,33.71%;处理8 d时两个品种分别降低了48.25%,49.17%。说明盐胁迫下番茄幼苗叶片膜脂过氧化程度加重,并随盐胁迫时间的延长伤害程度增大;喷施Spd能显著降低番茄幼苗叶片MDA的含量,即降低膜脂过氧化程度。
2.4 外源Spd对番茄幼苗叶片游离脯氨酸(Pro)含量的影响
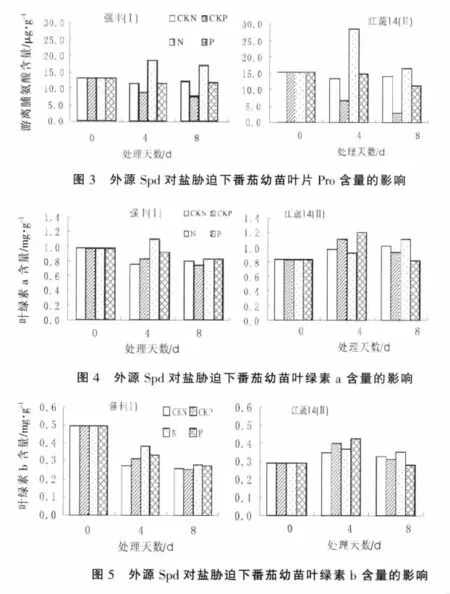
试验结果(图3)显示,盐胁迫处理的番茄幼苗Pro含量明显升高,白果强丰和江蔬14号两品种在4 d,8 d时Pro含量分别比对照升高了58.31%,39.30%,112.73%,15.60%。非盐条件下喷施Spd能降低番茄幼苗叶片内Pro的含量,白果强丰和江蔬 14号两品种在处理 4 d,8 d时Pro的含量分别比对照降低了26.69%,37.34%,50.79%,79.78%。在盐胁迫下外源Spd能使叶片Pro的含量明显降低,白果强丰和江蔬14号两品种在处理4 d,8 d时的Pro含量分别比对照降低了37.44%,30.60%,47.67%,30.89%。 说明盐胁迫下番茄幼苗叶片中Pro含量增加,外源Spd能降低Pro的含量,减小盐胁迫对植物体的伤害程度。
2.5 外源Spd对番茄幼苗叶绿素含量的影响
试验结果(图 4,5)表明,在处理 4 d时,在非盐胁迫下外源Spd在一定程度上提高了白果强丰和江蔬14号的叶绿素a、b含量,其中白果强丰幼苗的叶绿素 a、b的含量分别比对照增加了10.35%,13.82%;江蔬14号幼苗的叶绿素 a、b的含量分别比对照增加了13.74%,15.07%;盐胁迫增加白果强丰幼苗的叶绿素a、b的含量,分别比对照增加了44.43%,41.09%;江蔬14号幼苗叶绿素b增加了6.38%,而叶绿素a含量降低了4.55%。盐胁迫下外源Spd降低了白果强丰幼苗的叶绿素a、b的含量;在一定程度上增加了江蔬14号幼苗叶绿素a、b的含量。处理后8 d的结果显示,非盐胁迫下外源Spd降低了叶绿素a、b的含量。盐胁迫处理提高了番茄幼苗的叶绿素a、b的含量。盐胁迫下外源Spd对抗盐性较强的白果强丰幼苗影响很小,而对江蔬14号幼苗的叶绿素a、b的含量则有一定的降低,分别比单独盐处理的降低了25.38%,21.65%。
3 小结与讨论
植物耐盐性是多基因控制的复合遗传性状,同时也受生长环境的影响。试验结果表明,喷施外源Spd能降低盐胁迫下番茄幼苗叶片的相对电导率、MDA含量、Pro含量,减少盐胁迫对细胞结构和生理生化反应的伤害,提高根冠比,增加了植物的耐盐性。但是对干物质积累量,叶绿素a、b的含量也有明显的影响,因处理时间和品种不同而产生不同的作用效果。盐胁迫对抗盐性较强的白果强丰影响较小,对耐盐性较弱的江蔬14号影响较大,而外源Spd的效果在耐盐性较弱的品种上更明显。胡晓辉等[10~13]的研究也表明,通过Spd浸种可以改善盐胁迫下番茄种子发芽、幼苗的耐盐性。这也更充分证明Spd可以作为有效的外源物质,应用在番茄生产上。
植物体是一个相互联系的综合体,各种生命活动是相互影响的,因此需要对植物体生理途径进行综合研究,阐明之间的联系。目前对多胺代谢及外源应用做了大量的研究,而对于外源Spd对植物体的调控作用机理还没有从内在机制阐明,仍然需要从生理和分子水平继续做深入的研究。
[1]赵可夫.植物抗盐生理[M].北京:中国科学出版社,1993:1-5.
[2]Zhu J K.Plant salt tolerance[J].Trends in plant science,2001(6):66-71.
[3]Groppa M D,Benavides M P.Polyam ines and abiotic stress:recent advances[J].Amino Acids,2008,34(1):35-45.
[4]Bouchereau A,Aziz A,Larher F,et al.Polyam ines and environmental challenges:recent developments[J].Plant Science,1999,140(2):103-125.
[5]李憬,郭世荣,胡晓辉.外源亚精胺对低氧胁迫下黄瓜根系多胺含量和呼吸代谢酶活性的影响[J].西北植物学报,2006,26(1):92-97.
[6]宋士清,贺字典,郭世荣,等.外源亚精胺对黄瓜幼苗盐胁迫逆境的诱抗作用机理 [J].河北科技师范学院学报,2006,20(3):1-6.
[7]王素平,贾永霞,郭世荣,等.多胺对盐胁迫下黄瓜(Cucumis sativusL.)幼苗体内 K+、Na+和 Cl-含量及器官间分布的影响[J].生态学报,2007,27(3):1 122-1 129.
[8]Majerus V,Bertin P,Lutts S.Effects of iron toxicity on osmotic potential,osmolytes and polyam ines concentrations in the African rice(Oryza glaberrimaSteud.)[J].Plant Science,2007,173(2):96-105.
[9]郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:104-108.
[10]胡晓辉,王素平,曲斌.NaCl胁迫下亚精胺对番茄种子萌发及幼苗抗氧化系统的影响[J].应用生态学报,2009,20(2):446-450.
[11]胡晓辉,邹志荣,杨振超.亚精胺对盐胁迫下番茄种子萌发的影响[J].北方园艺,2009(7):1-3.
[12]胡晓辉,杜灵娟,邹志荣.Spd浸种对盐胁迫下番茄(Solanum lycopersicum)幼苗的保护效应[J].生态学报,2009,29(9):5 152-5 157.
[13]胡晓辉,邹志荣,杨振超,等.Spd诱导NaCl胁迫下番茄种子萌发和幼苗耐盐性效应研究[J].北方园艺,2009(10):5-8.

