巨噬细胞移动抑制因子与冠状动脉病变的关系
杨丽霞,苗贵华,齐 峰,王先梅,石燕昆,吕晋琳,李明秋
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)现认为是一种慢性炎症性疾病,急性冠脉综合征(acute coronary syndrome,ACS)的发生与冠状动脉斑块的易损性增高有关,多种炎性因子在易损斑块的形成过程中发挥了重要作用。研究证实,巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)在炎症反应和免疫应答中起介导作用,参与了动脉粥样硬化斑块的形成和进展[1]。本研究通过检测经冠状动脉造影证实的CHD患者血浆MIF浓度,与冠状动脉造影正常者进行对比,探讨MIF与冠状动脉粥样硬化病变的关系,为CHD的防治提供新的依据。
1 资料与方法
1.1 临床资料 选择于2006年10月至2007年5月期间在成都军区昆明总医院心内科住院,行冠状动脉造影病例142例,根据冠状动脉造影结果进行分组。
1.1.1 冠心病组 经选择性冠状动脉造影发现左主干(left main,LM),左前降支(left anterior de-scending,LAD),左回旋支(left circumflex coronary artery,LCX),右冠状动脉(right coronary artery,RCA)中至少一支血管内径狭窄≥50%而确诊为CHD病例 107例,男 73例,女 34例,年龄40~78岁,平均61岁。CHD组根据临床诊断分为稳定型心绞痛(stable angina pectoris,SAP)32例和ACS 75例,后者包括不稳定型心绞痛(unstable angina pectoris,UAP)33例和急性心肌梗死(acute myocardial infarction,AMI)42例。根据冠状动脉狭窄病变累及血管范围将CHD组分为单支病变组42例、双支病变组39例和三支病变组26例,如果显著累及左主干记为2支病变。根据主要冠状动脉内径的狭窄程度,采用Gensini评分标准[2]对血管病变程度进行定量评定:狭窄≤25%为1分,25%~50%为2分,50%~75%为4分,75%~90%为8分,90%~99%为16分,100%(闭塞)为32分。不同节段冠状动脉评分系数按Gensini标准,每例患者冠状动脉病变程度的最终积分为各分支积分之和。冠状动脉狭窄的严重性按Gensini积分评估。狭窄程度评分再乘以一个标志病变位置在冠脉树中重要性的参数后得出最终分数。
1.1.2 对照组 经选择性冠状动脉造影排除冠状动脉病变者35例,男29例,女 6例,年龄48~82岁,平均64岁。
所有病例经询问病史、体检及查肿瘤标志物、血常规、炎性标志物、免疫标志物及行相关检查均排除恶性肿瘤、肝纤维化、近期手术、严重感染、急性脑血管病、周围血管病变等情况。
1.2 生化指标的检测 受检者于入院后次日清晨空腹抽取静脉血3 ml,在该院化验室全自动生化检测仪上检测血清总胆固醇、甘油三酯、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDLC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、血糖、尿酸等生化指标。
1.3 MIF的测定 检测标本于患者行冠状动脉造影时经鞘管抽取,肝素抗凝后于4℃,离心半径25 cm,3000 r/min离心5 min分离血浆,置于-80℃冰箱保存,统一检测。MIF浓度由ELISA法测定,试剂盒购自美国Uscn life Science﹠Technology Company,具体步骤按照试剂盒说明书进行。
1.4 冠状动脉造影 采用Judkins法,常规投照体位显示左右冠状动脉病变情况,根据具体情况加照其他体位。由经验丰富的两位专业心血管介入医师于造影后分别对LM、LAD、LCX和RCA管腔内径狭窄程度进行评价。
1.5 统计学方法 所有数据分析采用SPSS 11.5统计学软件进行处理。计量资料以¯x±s表示,组间比较采用方差分析检验,计数资料采用χ2检验,检验水准为0.05。用多元逐步回归分析法分析冠状动脉病变Gensini评分与各危险因素的关系。
2 结 果
2.1 CHD组与对照组MIF浓度的比较 CHD组MIF水平明显高于对照组〔(14.97±4.11)vs(9.07±1.28)μ g/L,P<0.01〕。
2.2 ACS组与SAP组间冠状动脉病变情况及MIF浓度的比较 ACS组与SAP组间冠脉病变范围差异有统计学意义。冠状动脉病变范围SAP组以单支病变(78.1%)为主,ACS组以双支病变(44.0%)和三支病变(33.3%)为主。ACS组MIF浓度明显高于SAP组,差异有统计学意义(表1)。
2.3 CHD组内不同冠状动脉病变范围组MIF浓度的比较 不同冠状动脉病变范围组间比较发现三支病变组MIF浓度高于双支病变组,双支病变组高于单支病变组,各组间两两比较差异均有统计学显著意义(表2)。

表2 CHD组中不同冠脉病变范围组间MIF浓度的比较

表1 SAP组与ACS组间冠状动脉病变情况的比较〔例数(%)〕
2.4 CHD组内不同Gensini积分组间MIF浓度的比较 不同Gensini积分组间比较发现,MIF浓度随Gensini积分的增加而增加,各组间两两比较差异均有统计学显著意义(表3)。

表3 CHD组中Gensisn评分组间MIF浓度的比较
2.5 多元逐步回归分析法分析Gensini评分与各危险因素的关系 以冠状动脉病变Gensini评分为应变量,以各危险因素为自变量进行多元逐步回归分析,有三个因素进入回归方程,依次为HDL-C、LDL-C、MIF,结果示 HDL-C与冠状动脉病变Gensini评分呈负相关,LDL-C、MIF与之呈正相关(表 4)。
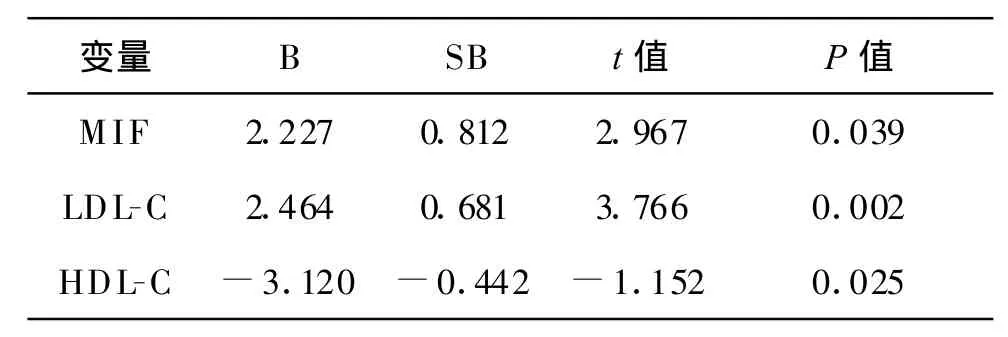
表4 冠脉病变Gensini评分的多元回归分析
3 讨 论
现认为动脉粥样硬化是一种慢性炎症性疾病,多种炎症介质参与了粥样硬化斑块的形成和发展。在粥样硬化斑块形成过程中,巨噬细胞发挥了重要作用。其既可通过摄取胆固醇转化生成泡沫细胞,参与构成脂核,又可释放各种炎症因子,加重局部损伤。
体内MIF主要来源于单核巨噬细胞。研究证实MIF是炎症性疾病中的一种关键介质,其可以诱导黏附分子的产生、促进单核巨噬细胞的黏附、抑制内膜下聚集的巨噬细胞的移动、促进泡沫细胞的形成及血管局部炎症过程,导致动脉粥样硬化产生[1~3]。Pan等[4]证实,MIF增高可以明显促进动脉粥样硬化的进展。本研究结果显示,CHD组MIF浓度明显高于对照组,说明MIF增高与CHD的发病有关,MIF在动脉粥样硬化发生过程中起到重要作用,MIF增高可以促进粥样硬化斑块的形成及进展。
粥样硬化斑块不稳定性增加是导致急性冠脉事件的重要原因。粥样斑块纤维帽强度是决定斑块稳定性的主要因素。当纤维帽内胶原减少,其强度降低,导致斑块不稳定性增加。巨噬细胞可通过释放基质金属蛋白酶(MMPs),降解胶原,减少细胞外基质,促进斑块不稳定。MIF可促进MMPs表达,导致斑块不稳定性增加。Kong等[5]发现,在易损斑块内血管平滑肌细胞(vascular smooth muscle cell,VSMC)表达MIF增高;同时发现MIF可以直接刺激VSMC,使其表达MMP-1 mRNA和蛋白增加,使MP-1数量及活性增加。此现象在纤维性斑块中有发现。他证实此过程与巨噬细胞蓄积、MMP-1强表达和胶原溶解相关。同时Kong等[6]发现,在易损斑块内巨噬细胞和VSMC中MIF对MMP-9表达有相同作用,可以增加MMP-9的数量及活性,同样在纤维性斑块中没有见到此现象。说明MIF通过提高MMPs分泌量,参与了易损斑块中纤维帽的减弱过程,导致斑块不稳定性增加。MIF还可以通过增加泡沫细胞数量、减少VSMC胶原分泌及促进粥样硬化斑块不稳定标志物的产生来影响斑块稳定性[7,8]。因此MIF与动脉粥样硬化斑块的稳定性有关,MIF增高能够促进斑块不稳定性增加。
本研究发现,CHD组MIF浓度明显高于对照组,ACS组MIF浓度又明显高于SAP组,随冠脉病变程度和病变类型的加重,MIF浓度明显增高,说明MIF与粥样硬化斑块严重性密切相关,尤其与ACS的关系更为密切,MIF浓度越高,冠脉斑块病变越重,CHD发生率越高。冠状动脉造影Gensini积分是一种非常有效的评估冠状动脉病变程度的方法,冠状动脉病变越严重,Gensini积分越高,因此Gensini积分可以表示冠状动脉病变的弥散程度。本研究显示,MIF浓度随Gensini积分的增加而增加,说明MIF浓度的增高可促进粥样硬化斑块的形成及进展,导致复杂病变的形成,对斑块的不稳定可能起到促进作用。另外多元回归分析显示,MIF、LDL-C水平与冠脉病变的Gensini积分呈正相关,说明MIF、LDL-C对粥样硬化斑块的形成有促进作用,可导致冠状动脉病变范围的扩大;而HDL-C与冠脉病变Gensini积分呈负相关,说明其对粥样硬化斑块具有保护作用,可减少斑块的形成,促进斑块面积减小。
现在诊断冠脉斑块稳定性的方法主要有血管内超声、血管镜等多种技术,根据冠状动脉造影观察到的冠状动脉病变情况判断冠状动脉斑块是否属于易损斑块有一定的局限性。但是从本研究结果可以看出,SAP患者冠状动脉病变以轻度病变为主,病变类型以A型病变为主,即轻度低危病变。而ACS患者冠状动脉病变程度以中重度病变为主,病变类型以B型、C型为主,即中重度高危病变。B型或C型改变多为易损斑块,即ACS患者病变斑块多属于易损斑块,因此笔者认为MIF增高可能可以作为临床上判断患者冠状动脉斑块是否属于易损斑块的一个指标,MIF浓度越高,斑块越不稳定。
总之,本研究发现CHD患者MIF浓度明显高于正常者,ACS患者MIF浓度又明显高于SAP组,并且 MIF浓度随着冠状动脉病变范围的加重和Gensini积分的增加而增高,说明MIF增高可促进粥样硬化斑块的形成,并可能导致斑块不稳定性增加,是影响冠状动脉斑块不稳定的一个因子。因此,在临床中MIF增高似可作为预测冠状动脉斑块是否稳定的一个指标。
[1]Burger-kentischer A,Goebel H,Seiler R,et al.Expression of macrophage migration inhibitory factor in different stages of human atherosclerosis[J].Circulation,2002,105(13):1561-1566.
[2]Gensini GG.A more meaningful scoring system for determining the severity of coronary heart disease[J].Am J Cardiol,1983,51(3):606.
[3]Lin SG,Yu XY,Chen YX,et al.De novo expression of macrophage migration inhibitory factor in atherogenesisinrabbits[J].CircRes,2000,87(12):1202-1208.
[4]Pan JH,Sukhova GK,Yang JT,et al.Macrophage migration inhibitory factor deficiency impairs atherosclerosis in low-density lipoprotein receptor-deficient mice[J].Circulation,2004,109(25):3149-3153.
[5]Kong YZ,Huang XR,Oouyang X,et al.Evidence for vascular macrophage migration inhibitory factor in destabilization of human atherosclerotic plaques[J].Cardiovasc Res,2005,65(1):272-282.
[6]Kong YZ,Yu X,Tang JJ,et al.Macrophage migration inhibitory factor induces M MP-9 expression:implications for destabilization of human atherosclerotic plaques[J].Atherosclerosis,2005,178(1):207-215.
[7]Schober A,Bernhagen J,Thiel M,et al.Stabilization of atherosclerotic plaques by blockade of macrophage migration inhibitory factor after vascular injury in apolipoprotein E-deficient mice[J].Circulation,2004,109(3):380-385.
[8]Schmeisser A,Marquetant R,Illmer T,etal.The expression of macrophage migration inhibitory factor1-alpha(MIF 1alpha)in human atherosclerotic plaques is induced by different proatherogenic stimuli and associated with plaque instability[J].Atherosclerosis,2005,178(1):83-94.

