Lj20和St24发酵液粗提物对番茄体内防御性酶活性的影响
武江,马林,韩巨才,王美琴
(山西农业大学农学院,山西太谷 030801)
Lj20和St24发酵液粗提物对番茄体内防御性酶活性的影响
武江,马林,韩巨才,王美琴
(山西农业大学农学院,山西太谷 030801)
为明确植物内生放线菌对植物体内防御性酶活性的影响,以植物内生放线菌Lj20和St24发酵液粗提物处理番茄植株,测定其根、茎、叶中过氧化氢酶(CAT)、多酚氧化酶(PPO)、过氧化物酶(POD)和超氧化物歧化酶(SOD)的活性变化。测定结果表明,用Lj20和St24粗提物处理番茄植株后,除SOD处理和对照没有明显差异外,CAT、PPO和POD酶的活性都有所增强,但酶活性随时间变化规律各不相同。其中Lj20粗提物处理的番茄茎和叶中PPO的活性增加最明显,在测定时间内呈直线上升趋势。这表明Lj20和St24的代谢物不仅对病原菌具有直接抑制作用,而且可通过提高植物体内防御性酶活性来提高植物的抗病性。
植物内生放线菌;防御性酶活性;番茄植株
植物内生菌是定殖在健康植物组织内,并与植物建立和谐联合关系的一类微生物,包括内生真菌、内生放线菌和内生细菌[1,2]。自Stierle A等[3]1993年从短叶紫杉中发现产紫杉醇的内生真菌后,有关内生菌的研究引起了人们越来越多的兴趣。近年来的大量研究表明,内生菌广泛存在于绝大多数植物中,开发与应用潜力巨大。其中,放线菌是产生抗生素及多种生物抗性物质的重要微生物资源,广泛存在于植物体内[4,5]。
随着有机和绿色食品的发展,利用微生物进行生物防治越来越受到人们的重视,特别是植物抗病性的诱导已成为一个重要的发展方向和现代农药的新理念[6]。目前,国内外关于植物内生菌在植物病害防治中应用的报道多集中于内生真菌和内生细菌,关于内生放线菌应用报道较少。前期研究工作已证实植物内生放线菌St24和Lj20对番茄灰霉病菌、叶霉病菌等多种病原菌具有抑制作用,盆栽试验证实具有良好的开发应用前景[7]。为进一步探究内生放线菌的防病机制,本文测定了St24和Lj20代谢物对番茄植株内防御酶活性的影响,为进一步开发该菌株奠定基础。
1 材料与方法
1.1 材料
植物内生放线菌Lj20和St24菌株由山西农业大学农药学实验室提供。番茄灰霉病菌为山西农业大学农药学实验室保存菌种。
1.2 方法
1.2.1 植株处理
制备浓度为1×105mol◦mL-1的灰霉病菌孢子悬浮液,在番茄幼苗三、四叶时接种,30℃保湿光照培养3 d,用St24和Lj20菌株发酵液粗提物叶面喷雾处理,粗提物浓度为500 mg◦L-1,在喷雾12 h及 2、4 、6、8 d 后分别测定植株根 、茎、叶的过氧化氢酶、多酚氧化酶、过氧化物酶和超氧化物歧化酶的活性,以清水为对照。
1.2.2 酶液提取
准确称量植物根、茎、叶各0.3 g,冰上剪碎,加0.05 mol◦L-1pH6.0的磷酸缓冲液3.0 mL,0.03 g聚乙烯吡咯烷酮(PVP),加少量石英砂,在冰浴中研磨成匀浆,于10000 r◦min-14℃离心 10 min,取上清液,即为粗酶液。
1.2.3 酶活性测定
CAT和PPO的测定方法见邹崎《植物生理生化试验指导》[8],POD的测定方法见汤章成《现代植物生理学试验指南》[9],SOD的测定方法见王金胜《农业生物化学研究技术》[10]。
2 结果与分析
2.1 过氧化氢酶(CAT)的活性变化
2.1.1 植株根内CAT的活性变化(图1)
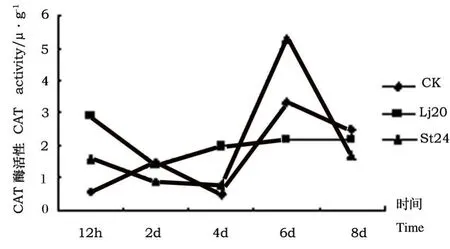
图1 Lj20和St24发酵液粗提物对植株根内CAT活性影响Fig.1 Effects of extracts of Lj20和St24 metabolites on CAT activity in roots
从图1可看出,经Lj20发酵液粗提物处理后,番茄植株根中CAT活性在处理当天和处理后4 d的酶活性高于对照,其中处理当天的活性最大,酶活性为2.93 U◦g-1。而在其它测定时间内酶活性都小于对照酶活性。经St24发酵液粗提物处理番茄植株根,CAT活性在处理12 h、4 d和6 d时酶活性都高于对照,6 d时达到最高峰,为5.3 U◦g-1。到8 d时,两个处理和对照酶活性相近,差异不显著。
2.1.2 植株茎内CAT的活性变化(图2)
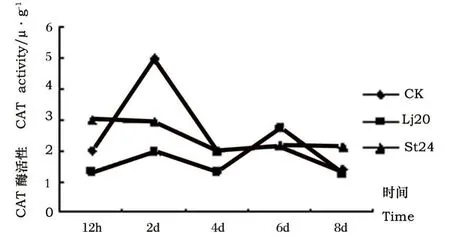
图2 Lj20和St24发酵液粗提物对植株茎内CAT活性影响Fig.2 Effects of extracts of Lj20和St24 metabolites on CAT activity in stems
从图2可以看出,经过Lj20和St24发酵液粗提物处理后,随时间延长植株茎的酶活性变化都较小。经Lj20发酵液粗提物处理后的番茄植株,茎中的CAT活性只有在处理后6 d时略高于对照组酶活性,在其它测定时间内均小于对照酶活性。而经St24发酵液粗提物处理后,酶活性只有在2 d时低于对照,其它时间都高于对照。
2.1.3 植株叶内CAT的活性变化(图3)
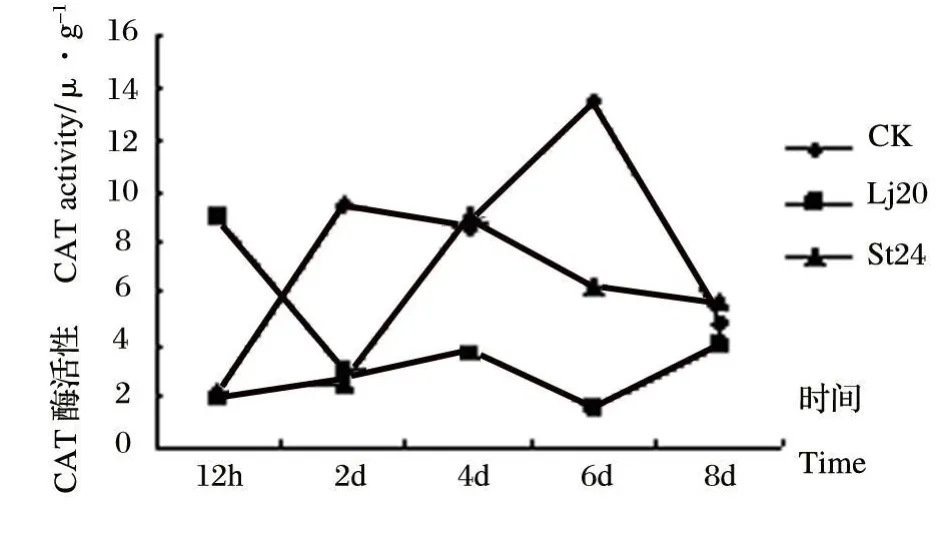
图3 Lj20和St24发酵液粗提物对植株叶内CAT活性影响Fig.3 Effects of extracts of Lj20和St24 metabolites on CAT activity in leaves
从图3可以看出,经Lj20发酵液粗提物处理后的番茄植株,叶中的CAT活性在处理当天显著高于对照,但在之后6 d都低于对照水平,在8 d时略高于对照。经St24发酵液粗提物处理的番茄叶,在处理当天与对照相比无明显差异,至测定第四天酶活性达峰值,为9.1 U◦g-1,且高于对照,而在其它测定时间内都低于对照。
2.2 多酚氧化酶(PPO)的活性变化
2.2.1 植株根内PPO的活性变化(图4)

图4 Lj20和 St24发酵液粗提物对植株根内PPO活性影响Fig.4 Effects of extracts of Lj20和St24 metabolites on PPO activity in roots
从图4可以看出,Lj20发酵液粗提物处理番茄后,植株根内PPO活性基本保持平衡,8 d内的变化不大。经St24发酵液粗提物处理后,植株根内的PPO活性在处理前4 d活性变化趋势与对照相同,在2 d达到最高,且显著高于对照水平,最大值为120 U◦g-1;到6 d时达到另一活性高峰,为90 U◦g-1,且明显高于对照酶活性。
2.2.2 植株茎内PPO的活性变化(图5)
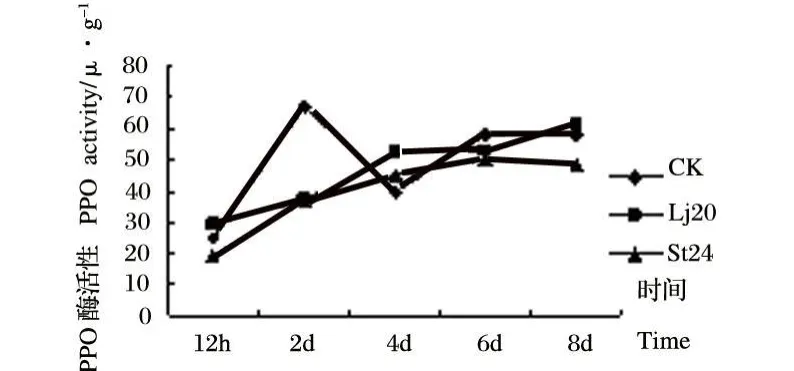
图5 Lj20和St24发酵液粗提物对植株茎内PPO活性影响Fig.5 Effects of extracts of Lj20和St24 metabolites on PPO activity in stems
从图5可以看出,用Lj20和St24发酵液粗提物处理植株后,茎内的PPO活性都呈增长趋势,且Lj20发酵液粗提物处理后 PPO活性始终大于St24发酵液粗提物处理后的酶活性。但在4 d以后两个处理组都与对照组酶活性接近。
2.2.3 植株叶片内PPO的活性变化(图6)
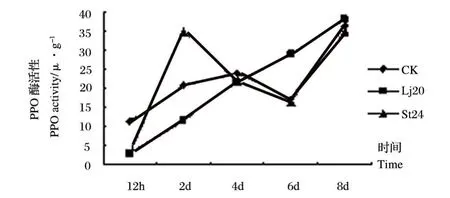
图6 Lj20和St24发酵液粗提物对植株叶内PPO活性影响Fig.6 Effects of extracts of Lj20和St24 metabolites on PPO activity in leaves
从图6可看出,处理组叶片PPO活性在12 h时均低于对照组,到8 d时三组叶片的酶活性接近。Lj20发酵液粗提物处理番茄后,叶片内的PPO活性呈直线上升趋势,至8 d达到最高,酶活性为38 U◦g-1,且略高于对照水平;经St24发酵液粗提物处理后,叶片内的PPO活性迅速增加,在处理2 d达到最高,达到35 U◦g-1,且显著高于对照水平,从处理后4 d开始,活性变化与对照组相同,且略低于对照。
2.3 过氧化物酶(POD)的活性变化
2.3.1 植株根内POD的活性变化(图7)
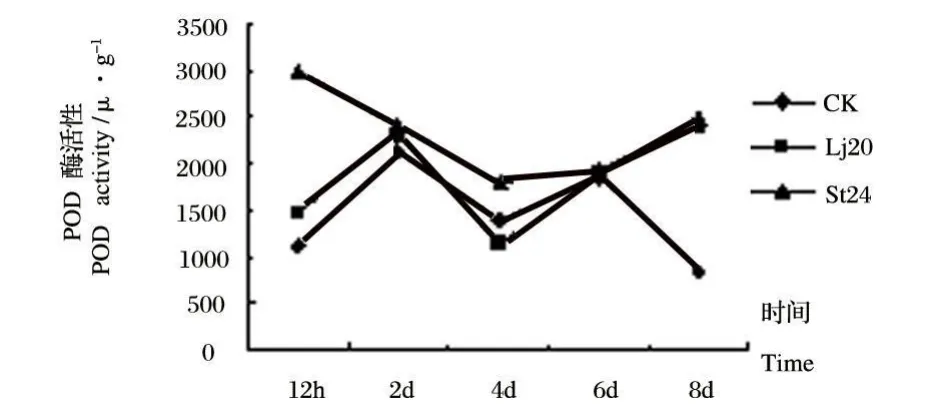
图7 Lj20和St24发酵液粗提物对植株根内POD活性影响Fig.7 Effects of extracts of Lj20和St24 metabolites on POD activity in roots
从图7可以看出,经Lj20发酵液粗提物处理后的番茄植株根内POD酶活性的变化,只有在处理后6 d时低于对照,其它时间都高于对照。经St24发酵液粗提物处理后,番茄植株根中的POD活性都高于对照,在处理当天即达到最大值,为2982.22 U◦g-1,在处理后的四天中呈较快下降趋势,并在第四天降至最低,在随后的时间中,POD活性持续增加。
2.3.2 植株茎内POD的活性变化(图8)
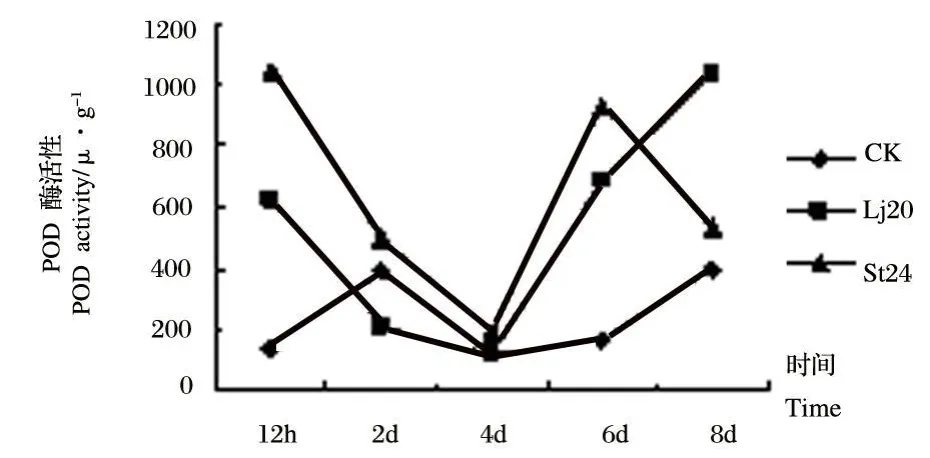
图8 Lj20和St24发酵液粗提物对植株茎内POD活性影响Fig.8 Effects of extracts of Lj20和St24 metabolites on POD activity in stems
从图8可以看出,Lj20发酵液粗提物处理后的番茄植株茎内的 POD酶活性在4 d时活性最低,且低于对照,在处理后的其他时间内都明显高于对照,处理后8 d时达到最大值,为1 040 U◦g-1。St24发酵液粗提物处理的番茄植株茎的POD活性在试验的前6 d都明显高于对照,在8 d时,酶活性下降到了对照数值以下。
2.3.3 植株叶内POD的活性变化(图9)

图9 Lj20和St24发酵液粗提物对植株叶内POD活性影响Fig.9 Effects of extracts of Lj20和St24 metabolites on POD activity in leaves
由图9可以看出,Lj20发酵液粗提物处理后的番茄叶中的POD活性在处理前6 d,酶活性变化不大,在6~8 d,酶活性增加,达到最大值316.44 U◦g-1。St24发酵液粗提物处理的番茄植株后的酶活性都高于对照酶活性,6 d时活性最大,为562.67 U◦g-1。
2.4超氧化物歧化酶(SOD)的活性变化
对照组和处理组根、茎、叶的SOD活性变化相同,说明Lj20和St24发酵液粗提物对植株体内的SOD酶活性没有影响。
3 结论与讨论
寄主植物受到病源菌侵染后,其防御酶系会被激活。植物体内的SOD是一种典型的诱导酶,可以清除O2◦-,减少对植物的毒害作用。植物在逆境下受到伤害以及植物对逆境的抵抗能力往往与体内SOD活性水平有关,抗逆性强的植物SOD活性降低幅度小或相对稳定,有时甚至升高。CAT和POD是细胞内保护酶系统的重要组成部分,能有效清除生物体内的过氧化氢对细胞的氧化作用,从而增强植物对各种不良环境的抵抗能力。PPO广泛存在于植物中,已有研究报道,健康叶片中PPO活性与作物抗病性呈显著相关。在正常情况下,PPO和底物是分开的,当细胞受到轻微破坏组织衰老时,有些细胞结构解体时,PPO和底物接触发生反应,将酚氧化成对微生物有毒的醌,可防止植物感染。这些酶的活性变化可反应某一时间段内植物体内代谢的变化情况[11,12]。
本研究结果表明经Lj20和St24发酵液粗提物处理番茄植株后CAT、POD活性均表现出明显的波动,其中根、茎、叶中CAT活性在处理前期均低于对照,可能是因为细胞受到活性氧的毒害,损害了CAT使其活性下降,但POD在处理后始终保持较高的活性,从而缓解了活性氧对CAT的毒害作用。处理后期CAT、POD活性明显增强并逐渐达到高峰,此阶段CAT、POD在清除H2O2对植物毒害方面发挥重要作用,细胞内O2◦-积累很少。
而SOD活性与对照无明显差异,这可能是由于处理后植物体内的一些可溶性蛋白首先参与到防御系统中,蛋白质含量增加以抵御植物受毒素的伤害,但之后由于外界胁迫时间的增加,毒素浓度逐渐升高,蛋白质合成受阻,同时相对加速了一些储藏蛋白质的水解使蛋白质含量降低,从而抗逆能力降低,植物体内活性氧含量升高。也可能是PPO活性变化的影响,因为PPO活性在处理后变化比较明显,一直呈上升趋势并在第8天达到峰值,说明经Lj20和St24发酵液粗提物处理后植株体内的代谢活动不断增强,从而提高植物抵抗外界病原菌感染的能力,具体原因有待于进一步分析。
随着外界胁迫程度的增强,SOD、POD、CAT、PPO相互协调,组成植物体内完善的抗氧化保护系统,使活性氧对细胞的损害程度维持在相对稳定的状态。本试验结果表明:经Lj20和St24发酵液粗提物处理后,番茄植株体内各种酶的活性显著发生变化,说明寄主植物受到病源菌侵染后,其防御酶系被激活,起到调节并恢复植物体内各种生理生化活动的作用,维持植物健康生长。因此,Lj20和St24菌株除对多种病原菌都有很好的抑制作用,在适当的浓度下也可作为激活植物抗病机制的诱导剂,从而提高作物的抗逆能力。有关两菌株是否具有提高寄主对病原菌侵染的防卫能力有待进一步研究。
[1]Hallmann J,QuadtHall mann A,Mahaffee WF,et al.Bacterial Endophytes in argricultural rops[J].Can J Microbiol,1997,43:895-914.
[2]Saracchi M,Sardi P.Growth promoter streptomyces employed in seed bacterization institute of plant pathology[M].Milano,Italy,1992:212-217.
[3]Stierle A,Strobel G,Stierle D.Taxol and taxane production by T axomy ces andreanae,an endophytic fungus of Pacific yew[J].Science,1993,260:214-216.
[4]Cao L,Qin Z,You J,et al.Isolation and characterization of endophytic Streptomy ces strains from surface-sterilized tomato(Lycopersicon esculentum)roots[J].Lett Appl Microbiol,2004,39:425-430.
[5]Igarashi Y,Minra SS,Fujita T,et al.Pterocidin,a cytotoxic compound from the endophytic Streptomyces hygroscopicus[J].Autibiet,2006,59:193-195.
[6]吴霞,张一宾.作物抗御病害新技术——由微生物诱导作物全株抗性[J].现代农药,2004,4:28-30.
[7]马林,陈红兵,韩巨才,等.植物内生放线菌Lj20的鉴定及其抗真菌物质的合成[J].微生物学报,2008,48(7):900-904.
[8]邹崎.植物生理生化试验指导[M].北京:中国农业出版社,1993:86-89.
[9]汤章城,魏家绵,陈因.现代植物生理学实验指南(第一版)[M].北京:科学出版社,1999:264-265.
[10]王金胜.农业生物化学研究技术[M].北京:中国农业出版社,2001:114-119.
[11]M adi L,Katan J.Penecillium janczewskiiand its metabolites,applied to leaves,elicit sy stemic acquired resistance to stem rot causedRhizoctonia solani[J].Phy siological and Molecular Plant Pathology,1998,53:163-175.
[12]王忠.植物生理学[M].北京:中国农业出版社,2003:422-423.
The Effects of Extracts of Lj20 and St24 Metabolites on the Protective Enzyme Activities in Tomato Plants
WU Jiang,MA Lin,HAN Ju-cai,Wang Mei-qin
(College of Agriculture,Shanxi Agricultural University,Taigu Shanxi 030801,China)
The protective enzyme activities in roots,stems and leaves of tomato seedlings were detected after treatment with extracts of endophytic actinomycetes St24 and Lj20 metabolites.The results showed that extracts of St24 and Lj20 metabolites could obviously increase the activities of PPO,POD and CAT except that of SOD,but the regularities for change of three enzymes were different with time.The effect of Lj20 metabolites extracts on PPO in stem and leaf was greatest.After treatment,the activity showed an upward trend in a straight line.Therefore,it is considered that the metabolites of St24 and Lj20 can not only directly inhibit pathogens,but also improve the disease resistance of tomato seedlings to a certain extent by prompting the activity of protective enzymes.
Endophytic actinomycetes;Protective enzyme activities;Tomato seedlings
S432.4+3
A
1671-8151(2010)01-0024-05
2009-09-07
2009-12-04
武江(1984-),女(汉),山西太原人,硕士研究生,主要从事园艺植物病害方面的研究。
韩巨才,教授,博士生导师。E-mail:sxndhjc@yahoo.com.cn
山西省自然基金(2008011066);山西省科技攻关项目(2007031039);山西省留学归国基金(2007061,2009043)
(编辑:马荣博)

