缺血后处理对大鼠局灶性脑缺血再灌注损伤热休克蛋白70影响
邢变枝 陈 晖 张苏明
在缺血性脑卒中的治疗中恢复梗死区的血液供应往往加重组织细胞功能代谢障碍及结构破坏,即再灌注损伤,寻找有效的细胞保护方法是临床上急待解决的问题。缺血后处理是指在缺血发生后长时间的再灌注之前对脏器进行数次短暂的再灌注/缺血循环的处理方法。与缺血预处理一样,缺血后处理能够减轻再灌注后脏器损伤[1~3],近年发现HSP70也可对脑缺血再灌注损伤发挥重要的保护作用[4~6],但HSP70是否参与了缺血后处理诱导的保护机制有待进一步证实。本研究先前工作证实缺血后处理可以减轻脑的再灌注损伤[7,8],但其具体机制目前少见报道。本研究观察缺血后处理对皮质内HSP70表达的影响,探讨脑缺血后处理可能的作用机制。
1 材料与方法
1.1 试剂 HSP70、β-actin单克隆抗体购自Senta cruz公司。引物由上海英俊生物有限公司提供。
1.2 实验分组 8周龄雄性SD大鼠45只,体重250~280 g,由华中科技大学同济医学院实验动物中心提供,随机分为假手术组(sham)、缺血再灌注组(I/R)、缺血后处理组(Postcond),每组各15只。
1.3 模型建立 大鼠均采用Koizumi等线栓法经右侧颈外一颈内动脉插线建立右侧大脑中动脉阻塞(m iddle cerebral artery occlusion,MCAO)再灌注模型[9]。栓线采用4-0尼龙单线,以10%水合氯醛(300 mg/kg)腹腔注射麻醉,仰卧固定,分离并暴露右侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA),结扎并切断ECA及其分支,沿根部结扎ICA颅外分支翼腭动脉;由ECA残端插入一根尼龙单线,沿 ECA、CCA分叉部和ICA轻轻推进,至ICA颅内分叉处时可阻断流入MCA的血流,进线长度18~20 mm;缺血时间为60 min,随后抽出插线使血流恢复实现再灌注。假手术组除不插线外,余步骤同上。缺血后处理组在MCAO 60min后将尼龙线拔出5mm,再灌30s后再将尼龙线放入初始位置,缺血30 s,反复6次[7,8]。
1.4 标本采集和处理 于再灌注24 h后一部分大鼠断头留取脑组织,速置液氮中保存待测,另一部分大鼠用4℃的40 g/L中性多聚甲醛灌流固定,断头取脑,于视交叉后1mm沿冠状位切片,制备石蜡切片。
1.5 免疫组化检测HSP70的表达水平 将石蜡切片再以新鲜配制的体积分数为3%的H2 O2灭活细胞内源性过氧化物酶,然后用血清封闭,根据测试指标分别滴加抗HSP70单克隆抗体(1∶500稀释)以及相应生物素化二抗,DAB显色,封片。应用同济千屏HPIAS2000型图像分析系统对免疫组织化学染色涂片进行分析。
1.6 Western blot检测脑皮质中HSP70蛋白含量
取液氮保存的右脑皮质组织,参照Matsumori等方法提取蛋白[10]。蛋白用考马斯亮蓝法定量,100℃加热5 min,取40μg/lane上样行电泳,样本用15%Tris-Glycine胶电泳分离蛋白后,电转到硝基纤维膜上,5%的脱脂牛奶封闭2 h,以1×TBST洗涤后与HSP70单克隆抗体(1∶500)4℃过夜,1×TBST洗涤后HRP标记的羊抗小鼠二抗(1∶2000),室温孵育1 h,TBST洗涤后混合等体积的试剂盒(Senta cruz)A液和B液,与硝基纤维膜共孵育1min,与X光片曝光1 h,显影、定影。用同样方法标记鼠单克隆抗体βactin作为胞浆蛋白内参照。
1.7 RT-PCR检测脑皮质中HSP70m RNA表达水平
取液氮保存的右脑皮质组织,采用Trizol一步法提取细胞总RNA,逆转录成cDNA。大鼠HSP70正义和反义引物分别为5'-GGGTTTGGGTACTTTGGTTA-3',5'-CCCATAAGTTGGGAAACAGT-3',扩增产物为317 bp;以β-actinmRNA 为内参照,其正义和反义引物为5'-TCATGAAGTGTGACGTTGACATCCGT-3',5'-CCTAGAAGCATTTGCGGTGCACGATG-3',其产物为 285 bp。PCR条件为94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min,扩增35个循环;最后一次为72℃延伸7min。取5 ul产物在含GOLDV IEW 的琼脂糖凝胶上(2%)电泳,用凝胶图像分析系统进行半定量分析,结果以目的基因β-actin比值表示。
1.8 统计学处理
实验所得数据以均数±标准差表示,应用SPSS软件(11.5版),采用方差分析,P<0.05为差异有统计学意义。
2 结 果
HSP70主要表达在细胞质。假手术组脑皮质组织神经细胞HSP70表达不明显或不表达(图1),缺血再灌注组和缺血后处理组缺血区脑皮质组织神经细胞表达较高,但是缺血后处理组脑皮质组织神经细胞HSP70表达显著高于缺血再灌注组(图1)。
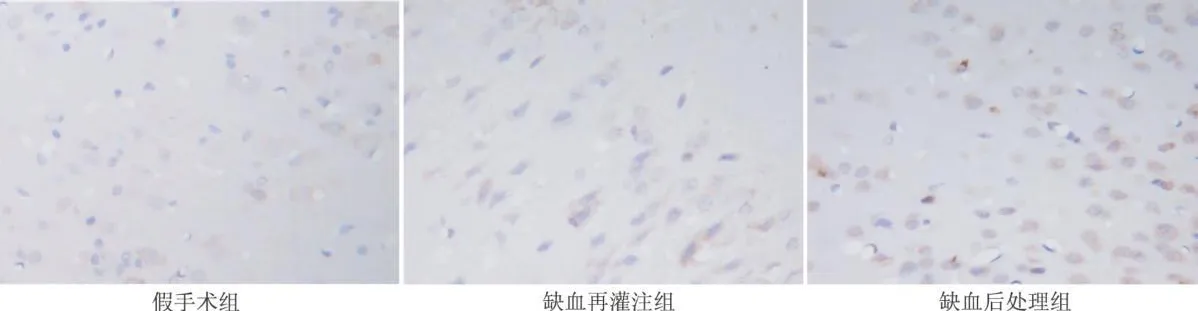
图1 各组HSP70免疫组化染色(×400)倍
Western blot检测显示:假手术组无明显HSP70表达,蛋白条带仅有清淡显影。缺血再灌注损伤24 h后,缺血再灌注组缺血再灌注区皮质内HSP70合成增加,缺血后处理组缺血再灌注区皮质内HSP70的合成较缺血再灌注组明显增多(P<0.05)(图2)。β-actin作为胞浆成分加等量蛋白的质控。
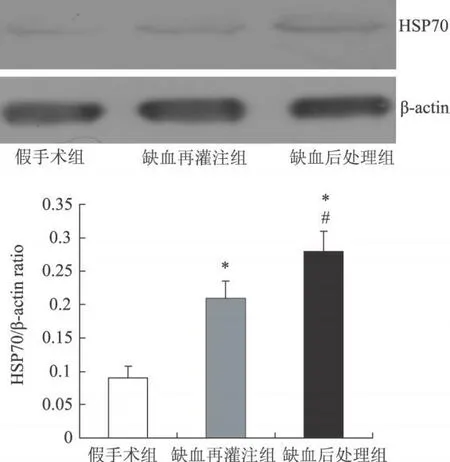
图2 Western b lot检测脑皮质组织中HSP70表达变化 与假手术组比较,*P<0.05;与缺血再灌注组比较,#P<0.05
RT-PCR检测显示假手术组大鼠大脑皮质内有微量的HSP70m RNA表达,缺血再灌注损伤24 h后缺血再灌注组缺血再灌注区大脑皮质内HSP70 mRNA表达增强(P<0.05),应用缺血后处理后缺血再灌注区大脑皮质内HSP70m RNA表达明显增强,显著高于假手术组和缺血再灌注组(P<0.05)(图 3)。
3 讨 论
研究发现缺血预处理能够降低缺血再灌注损伤,然而在临床实践中患者往往在出现缺血后才就诊,因此寻找一种脑缺血事件发生后的保护方法,具有十分重要的临床实用价值。缺血后处理发生在缺血事件后具有可控性,因此具有较大的临床价值。最早发现缺血后处理对心脏的保护作用[1],近年来国内外学者报道缺血后处理可以减轻大鼠的脑缺血再灌注损伤[11,12],这和本研究先前的研究结果一致[7,8],但这一现象发生的机制仍然不清楚。本实验研究发现HSP70表达水平在缺血后处理组中明显升高,可能参与后处理保护效应。
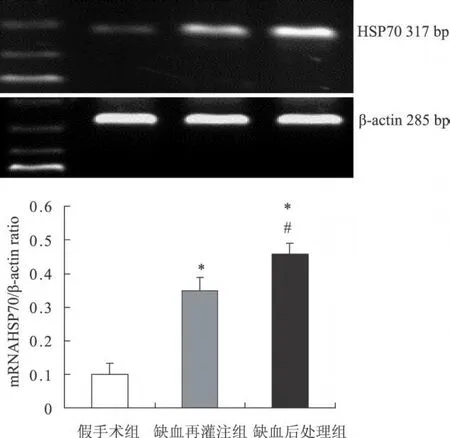
图3 RT-PCR检测脑皮质组织中HSP70mRNA表达变化 与假手术组比较,*P<0.05;与缺血再灌注组比较,#P<0.05
HSP70是一类最保守、最重要的HSPs,在正常细胞中水平较低,而在应激状态下显著升高,在缺血、缺氧等情况下例如局灶及全脑缺血后受损细胞内的变性蛋白可诱导HSP70表达。核蛋白变性,暴露出疏水区,并相互作用而聚合,并且与自胞质进入到胞核内的少量HSP70结合,使得本来与HSP70结合的热休克转录因子(HSF)分离,转移到胞核中与HSP70基因启动子中特定的核苷酸序列即热休克元件(HSE)结合,从而启动HSP的转录,HSP70 m RNA转移到核外大量合成 HSP70,在胞质中与变性蛋白结合,维持蛋白自身稳定;进入核内与核糖体前体及其他核内蛋白结合,防止变性引起生命信息紊乱[13]。
近来的研究证实,在脑缺血再灌注损伤中HSP70的合成增加与缺血耐受现象的产生关系密切,其机制包括降低ROS的产生、抑制炎症反应[4]、维持线粒体膜的稳定性[5]、抗神经元凋亡[6,14]等。本实验结果显示,假手术组仅有少量HSP70表达,缺血再灌注组表达明显,与假手术组比较有显著差异,这是由于缺血本身为一种应激反应,可诱导HSP70表达,这也是机体调动内源性保护机制,而发挥细胞保护作用。在缺血后处理组HSP70表达明显增强,提示刺激HSP70表达水平升高可能是缺血后处理的保护机制之一。因此本研究认为缺血后处理的保护作用可能是通过多次循环复灌复停减少了突然再灌注,从而促进HSP70 mRNA的转录和HSP70蛋白的翻译,进而保护线粒体,减少炎性因子的表达,抑制神经细胞凋亡等途径而发挥保护作用。
由于缺血后处理可在脏器缺血后应用,所以具有较大的临床应用价值。但是缺血后处理究竟通过什么分子途径刺激HSP70的表达和合成还有待进一步研究。研究如何启动脑缺血时机体的内源性神经保护作用,有助于寻找脑缺血的有效治疗途径,对防治脑梗死后再灌注损伤具有积极意义。
1 Zhao ZQ,Corvera JS,HalkosME,et al.Inhibition ofmyocardial in jury by ischem ic postconditioning during reperfusion:comparison w ith ischem ic preconditioning.Am JPhy siol H eart Circ Physiol,2003(3),285(3):579-588.
2 Zhao H,Sapolsky RM,Steinberg GK,etal.Interrup ting reperfusion as a stroke therapy:ischem ic postconditioning redu ces infarct size after focal ischem ia in rats.JCereb Blood Flow Metab,2006,26(9):1114-1121.
3 Liu X,Chen H,Zhan B,et al.A ttenuation of reperfusion injury by renal ischem ic postconditioning:The role of NO.Biochem ical and Biophysical Research Communications,2007,359(3):628-634.
4 Zheng Z,K im JY,Ma H,et al.An ti-inflammato ry effects of the 70kDa heat shock protein in experimen tal stroke.JCereb Blood Flow Metab,2008,28(1):53-63.
5 Ouyang YB,Xu LJ,Sun YJ,et al.Overexpression of inducible heat shock p rotein 70 and itsmutants in astrocytes is associated w ith m ain tenance of m itochond rial physiology during glu cose deprivation stress.Cell Stress&Chaperones,2006,11(2):180-186.
6 JohannesG,Lassmann MH,Johansen FF.An ti-apop totic signaling and failure of apoptosis in the ischem ic rat hippocampus.Neurobiology of Disease,2007,25(3):582-593.
7 Xing B,Chen H,Zhao D,et al.Ischem ic postconditioning inhibits apoptosis after focal cereb ral ischem ia/reperfusion inju ry in the rat.Stroke,2008,39(8):2362-2369.
8 Xing B,Chen H,Zhao D,et al.Ischem ic postconditioning p rotectsb rain and reduces inflamm ation in a rat model of focal cereb ral ischem ia/reperfusion.Journalof neurochem istry,2008,105(5):1737-1745.
9 Korzum i J,Yoshida Y,Nakazaw a T,et a1.Ex perimentalstudies of ischem ic brain edema.A new experimen talm odel of cereb ral embolism infarcts in the ischem ic area,Stroke,1986,8(5):l-8.
10 Matsumori Y,Hong SM,Aoyama K,et al.H sp70 overex pression sequesters A IF and reduces neonatalhypoxic/ischem ic b rain in jury.JCereb Blood Flow M etab,2005,25(7):899-910.
11 熊利泽,杨 静,徐 宁,等.缺血后处理对大鼠局灶性脑缺血再灌注损伤的影响.中华麻醉学杂志,2005,7(2):508-510.
12 Pignataro G,Meller R,Inoue K,et al.In vivo and in vitro characterization of a novelneuroprotective strategy fo r stroke:ischem ic postconditioning.JCereb Blood Flow Metab,2008,28(2):232-241.
13 Soncin F,Zhang X,Chu B,et al.Transcriptional activity and DNA binding of heat shock factor-l involve phosphorylation on th reonine 142 by CK2.Biochem Biophys Res Commun,2003,303(2):700-706.
14 鲍 娟,杨期东,罗红波,等.替普瑞酮诱导AD模型大鼠海马HSP70表达及其神经保护作用的研究.卒中与神经杂志,2008,15(2):80-82.

