维生素AD3E针剂对围产期奶牛乳蛋白表达的影响
张乐颖,王加启,杨永新,卜登攀,李珊珊,魏宏阳
(1.中国农业科学院 北京畜牧兽医研究所 动物营养国家重点实验室,北京 100193;2.河北工程大学 农学院,河北 邯郸 056021)
围产期是奶牛泌乳周期乃至一生中最为关键的时期.由于妊娠、分娩和泌乳的应激,易使奶牛处于免疫抑制状态[1],进而产后发生子宫内膜炎、乳房炎和胎衣不下等[2-4].通过补充维生素来缓解围产期奶牛免疫抑制,减少疾病发生,提高机体免疫力,国内外学者对此做了大量研究.曹荣等[5]在奶牛产前日粮中添加维生素D3(V-D3)缓解了围产期奶牛免疫球蛋白(Ig)的下降,提高了中性粒细胞含量.中性粒细胞是奶牛抵御乳房炎病原菌的第一道防线,是非特异性免疫系统最重要的细胞,添加V-D3后,中性粒细胞数量提高,表明日粮中添加V-D3提高了机体的非特异性免疫.何文娟等[6]在围产期日粮中添加β-胡萝卜素(V-A前体),不仅提高了产乳量,而且还降低了胎衣不下、子宫炎和乳房炎的发病率.产前一周,每毫升血清中的V-E含量每增加1 µg,胎衣不下的发生率将降低20%,V-A的含量每增加100 ng,临床性乳房炎的发病率将降低60%[7].然而,迄今尚未有关于复合V-AD3E注射液对围产期奶牛营养调控方面的报道.为此,笔者采用双向电泳结合高效液相色谱串联离子阱质谱的方法,从乳蛋白整体规模探索了复合V-AD3E 对围产期奶牛乳蛋白表达的影响,现将结果报道如下.
1 材料与方法
1.1 样品采集及制备
于天津三元绿荷二牧牛场选取健康、体重接近、预产期相近的中国荷斯坦初产奶牛24头,其中12头在预产期前15 d注射V-AD3E 20 mL (每mL含V-A 50 000 IU、V-D325 000 IU、V-E 乙酸酯4.0 mg),另12头为对照组(不注射).奶牛以全混日粮(TMR)方式饲喂,日喂2次,挤奶3次,自由饮水.分别在产后第1天和第21天收集奶样,按早、中、晚4∶3∶3比例混合后,取120 mL制备乳蛋白样品.乳样在4℃、3 000 g离心15 min,弃上层乳脂,收集清液即为牛乳蛋白.经考马斯亮蓝G250进行蛋白定量后,-80 ℃保存备用.
1.2 2-DE
第一向等电聚焦(Isoelectric focusing,IEF)电泳:采用胶内溶胀法,将300 µg的乳蛋白样品与350 µL水化上样缓冲液(7 mol/L尿素,2 mol/L硫脲,4% CHAPS,65 mmol/L DTT,0.2 % IPG Buffer(pH3-10),0.001%溴酚蓝)混匀(漩涡振荡5 min),10 000 g离心2 min,吸取上清,均匀加入至聚焦盘中,进行等电聚焦.结束后,将胶条用2.0%DTT平衡缓冲液还原,2.5%碘乙酰胺平衡缓冲液烷基化[8],然后进行12%SDS-PAGE垂直电泳,循环水浴温度为12 ℃,程序设置为:1 W、30 min;2 W、1 h,最后48 W直到溴酚蓝指示剂到达胶的底部.
1.3 凝胶染色和图像分析
凝胶用考马斯亮蓝染色(0.12% G-250,10%(NH4)2SO4,10% H3PO4,20% Methanol)[9].Umax扫描仪采集图像,Image Master 6.0软件进行背景消减、斑点检测、自动匹配.试验重复3次.将注射组与不注射组凝胶图谱以斑点染色强度和面积2倍量的变化为标准进行差异分析,检测差异表达的蛋白斑点.
1.4 蛋白质酶解
切去枪头尖端,使其直径约2 mm,选取差异表达的区域,分离后置于1.5 mL离心管中.先用超纯水清洗2次,每次15 min,再向每管加入150 µL脱色液(50%乙腈+50% 25 mmol/L碳酸氢铵),室温放置30 min,重复1次.抽真空离心干燥(Savant,Speed Vac Concentrator)30 min ,然后向干燥凝胶颗粒中加入 10 µL 20 ng/µL 测序级胰蛋白酶,37 ℃过夜.吸出酶解液,加入8 µL 2.5%三氟乙酸+50%乙腈,30 ℃放置1 h,吸出的液体与前一次的合并,重复1次.
1.5 离子阱质谱检测
酶解肽混合物采用液相色谱串联离子阱质谱系统(LCQ Deca XP plus,Thermo Finnigan)分析.上样前,先用流动相 A(超纯水+0.1%甲酸)平衡色谱柱(C18, Milford, MA, USA),再用流动相B(乙氰+0.1%甲酸)线性梯度洗脱 120 min.样品上样量 20µL,流速 110 µL/min.质谱全扫描范围:m/z 400~2 000,MS/MS 数据依赖扫描 5次(喷雾电压 3.2 kV,温度160 ℃),数据采集在正离子模式下运行.所获数据用整合在质谱仪上的Bioworks中的SEQUEST搜索NCBI非冗余蛋白质数据库.检索结果输出后,采用Single threshold参数对数据库结果进行筛选,当 Xcorr 分数为1.9、2.2、3.75时,相应电荷为+1、+2、+3.
2 结果与分析
2.1 乳蛋白的差异表达检测
由图1可见,与不注射组第1天的凝胶图谱相比,注射组第1天的乳蛋白图谱上有5个蛋白点表达量上调(图 1-A、B);在第21天,注射组与对照组在蛋白表达上差异不明显(图1-C、D).

图1 乳蛋白表达图谱Fig.1 Analysis of expression protein patterns of bovine milk
2.2 差异表达蛋白的鉴定
经高效液相色谱串联离子阱质谱分析肽质量,并用整合在质谱仪上的Bioworks 软件中的检索软件 SEQUEST搜索NCBI非冗余蛋白质数据库,差异表达蛋白主要对应于2种蛋白——免疫球蛋白G (IgG)和白蛋白,如表1所示.
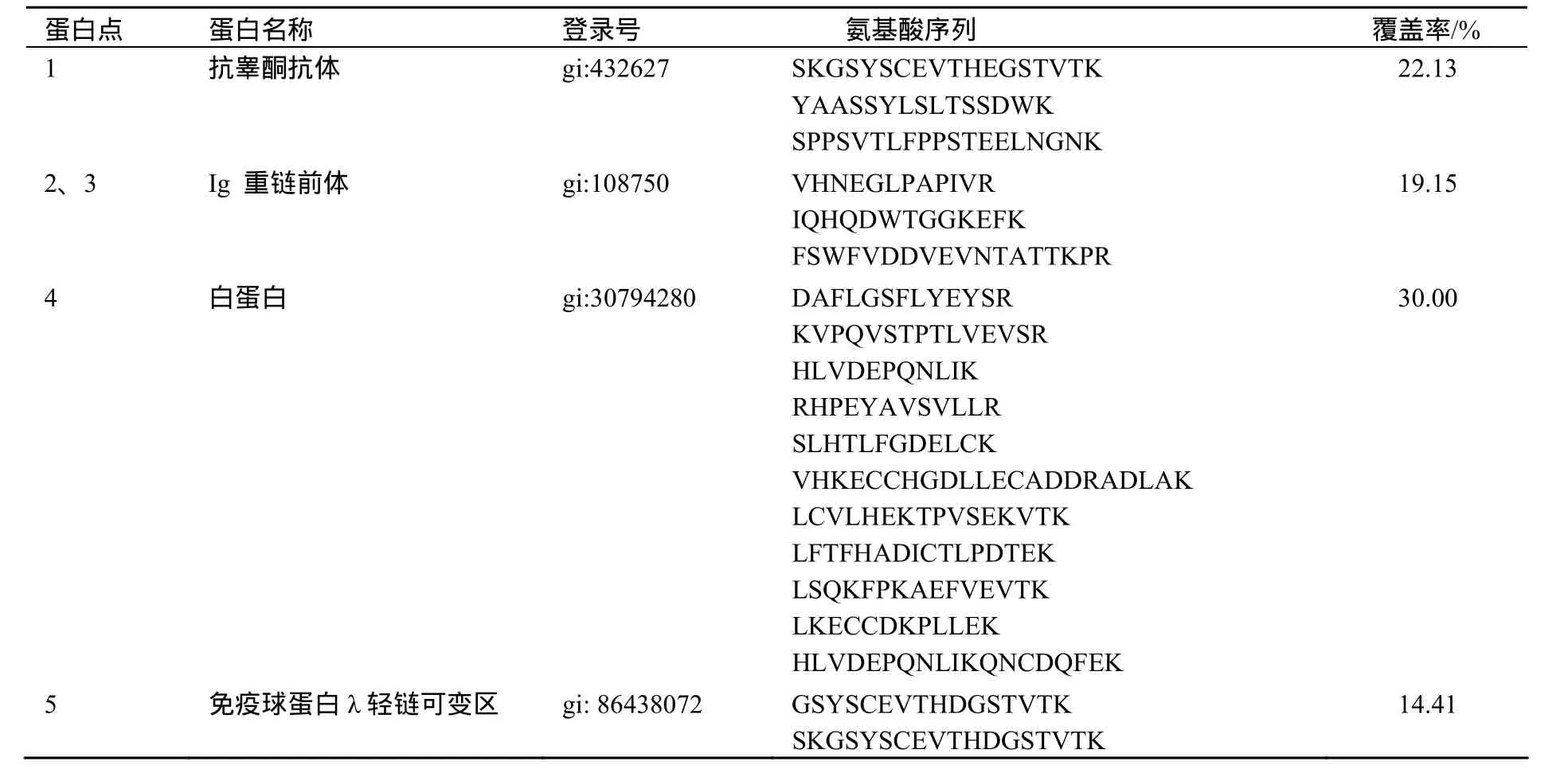
表1 液相色谱串联质谱鉴定初乳和常乳差异表达蛋白Table 1 Identification of differential expression protein from colostrum and milk by LC/MS/MS
3 小结与讨论
牛初乳中的IgG和白蛋白绝大部分来自血液[10],分娩前几周由于乳房的膨胀、血管渗透性增加,使得血液中IgG 和白蛋白等进入乳腺[8,11].新出生的犊牛血清中几乎没有抗体[12],因此犊牛对病原菌的抵抗主要依靠初乳提供的被动免疫.及时地让犊牛吃上初乳很重要,因为反刍动物胎盘不允许母源抗体通过,而且犊牛的自身免疫系统需要数周甚至数月才能成熟[13].
有关维生素对机体的作用,前人作了很多研究.产前一个月,每周给奶牛注射 V-AD3E 1次(每次注射量:V-A 80 000 IU、V-D340 000 IU,V-E 20 mg),可显著降低胎衣不下的发生率,而且还可缩短分娩后再次妊娠的时间[14].Waller 等给瑞典东南部21个牛群中的围产期奶牛每天补充V-E 乙酸盐1 610 mg(从产前 4 周到产后2周),显著降低了犊牛出生后 24 h内的死亡率[15].此外,给断奶前小母牛补充V-ADE,显著降低了腹泻率[16].体外试验表明,补充V-A 促进了幼龄动物脐带血合成IgM的量和成年动物外周血单核细胞合成IgG的量[16].V-A及其代谢产物作为免疫增强剂,使抗体对依赖抗原的T细胞做出应答反应,促进淋巴细胞增值、抑制细胞凋亡[18].本试验结果表明,V-AD3E联合作用,上调了初乳中IgG和白蛋白等蛋白的表达,这不仅为饲喂初乳的犊牛提供了更好的免疫保护,也为犊牛肠道的正常发育和母牛乳房功能的正常发挥提供了必要保障.此外,还提高了处于免疫抑制阶段母牛对疾病的抵抗力.
[1]Kimura K,Reinhardt T A,Goff J P.Parturition and hypocalcemia blunts calcium signals in immune cells of dairy cattle[J].Journal of Dairy Sci,2006,89:2588-2595.
[2]Cai T Q,Weston P G,Lund L A,et al.Association between neutrophil functions and periparturient disorders in cows[J].Am J Vet Res,1994,55(7):934-943.
[3]Kimura K,Goff J P,Kehrli M E,et al.Decreased neutrophil function as a cause of retained placenta in dairy cattle[J].Journal of Dairy Sci,2002,85(3):544-550.
[4]Hammon D S,Evjen I M,Dhiman T R,et al.Neutrophil function and energy status in Holstein cows with uterine health disorders[J].Vet Immunol Immunopathol,2006,113(1/2):21-29.
[5]曹荣,王加启,卜登攀,等.日粮添加维生素D3对围产奶牛外周血免疫球蛋白及T细胞亚群的影响[J].动物营养学报,2007,19(6):748-752.
[6]何文娟,孟庆翔,边四辈,等.围产期饲喂 β-胡萝卜素对奶牛生产性能的影响[J].动物营养学报,2007,19(2):157-162.
[7]LeBlanc S J,Herdt T H,Seymour W M,et al.Peripartum serum vitamin E,retinol,and beta-carotene in dairy cattle and their associations with disease[J].Journal of Dairy Sci,2004,87:609-619.
[8]Hogarth C J,Fitzpatrick J L,Nolan A M,et al.Differential protein composition of bovine whey:A comparison of whey from healthy animals and from those with clinical mastitis[J].Proteomics,2004(4):2094-2100.
[9]Candiano G,Bruschi M,Musante L,et al.Blue silver:A very sensitive colloidal coomassie G-250 staining for proteome analysis[J].Electrophoresis,2004,25:1327-1333.
[10]张佩华,王加启,贺建华,等.长沙地区奶牛养殖现状调查[J].湖南农业大学学报:自然科学版,2006,32(4):419-422.
[11]Brandon M R,Watson D L,Lascelles A K.The mechanism of transfer of immunoglobulin into mammary secretion of cows[J].Australian Journal of Experimental Biology Medicine Science,1971,49:613-623.
[12]Stormont C.The role of maternal effects in animal breeding I.Passive immunity in newborn animals[J].Journal of Animal Science, 1972, 35:1275-1279.
[13]Banks K L.Host defence in the newborn animal[J].Journal of the American Veterinary Medical Association,1982,181:1053-1056.
[14]Abdelhameed A M,Ahmed W M,Ekhnawy K I E, et al.Strategy trials for prevention of retained fetal membranes in a Friesian herd in Egypt[J].Global Veterinaria,2009,3(1):63-68.
[15]Waller K P,Sandgren C H,Emanuelson U,et al.Supplementation of RRR-а-tocopheryl acetateto periparturient dairy cows in commercial herds with high mastitis incidence[J].Journal of Dairy Sci,2007,90:3640-3646.
[16]Sivula N J,Ames T R,Marsh W E. Management practices and risk factors for morbidity and mortality in Minnesota dairy heifer calves[J]. Preventive Veterinary Medicine,1996, 27(3/4): 173-182.
[17]Semba R D. The role of vitamin A and related retinoids in immune function[J]. Nutrition Reviews, 1998, 56(Supp.1):38-48.
[18]Semba R D. Vitamin A,immunity, and infection[J].Clinical Infectious Diseases,1994,19:489 -499.

