维拉帕米对心肌细胞的保护与毒性作用
王达理,楼建英,张 伟,韩 燕,陈金安
回顾近十年文献,维拉帕米(verapamil,Ver)细胞保护作用和细胞毒性作用一直受到关注,一方面有研究证实它可减轻缺血心肌再灌注损伤[1],另一方面又有报道它可增强抗肿瘤药作用或直接杀伤癌细胞[2-4]。因此,Ver对心肌细胞具有保护的同时也可能存在毒性作用。本研究应用培养的心肌细胞,观察连续培养 96 h和模拟“缺血再灌注”状态下不同浓度Ver对细胞的影响;应用活细胞代谢染色比色分析(MTT法)测定损伤细胞释放酶活性,评估其细胞保护与细胞毒性作用及其与药物浓度间的关系。
1 材料与方法
1.1 实验材料 出生 1周内的 Wista大鼠由第四军医大学动物实验中心提供;小牛血清由第四军医大学附属唐都医院中心实验室提供。维拉帕米注射液(芬兰 Orion制药厂生产);用 Eagle(JRSUSA)干粉三蒸水配制培养基(MEM);胰蛋白酶 1∶250(Difco,USA);噻唑兰(MTT,Sigma)用 PBS配成 2%溶液;LDH试剂盒(Beckman,USA);国产分析纯试剂配制 Hang′s液和 PBS液。
1.2 心肌细胞的培养方法 Wista乳大鼠心肌剪成1.0mm ×1.0mm×1.0mm大小块,用 0.1%胰蛋白酶消化成单个心肌细胞,经 Hang′s液清洗后再以含 20%小牛血清的 MEM充分混悬成每毫升含心肌细胞 1×106个,分别按 1m l、8 ml接种到 24孔板和培养瓶中静置贴壁培养,每 24 h更换 1次培养基,培养 72 h后分组处理。
1.3 心肌细胞的代谢测定 分组处理后用 Hank′s液清洗心肌细胞 2次,以培养基正常培养 4 h,再以Hank's液清洗心肌细胞 2次,弃培养基后 24孔板每孔加 200μl、25ml培养瓶每瓶加 1.6ml噻唑兰溶液,37℃静置 4 h,弃液后加二甲基亚酚每孔 600μl、每瓶 5.0ml,振荡显色后测 540 nm处的吸光度值(A540)。
1.4 心肌细胞的酶活性测定 测定 A 540前取细胞培养液在 Backman自动生化分析仪上测定乳酸脱氢酶(LDH)、肌酸磷酸激酶(CK)的活性。
1.5 细胞损伤与药物保护作用
1.5.1 Ver对心肌细胞的毒性研究 培养 72h的心肌细胞 144孔分 6组,每组 24孔。正常培养组换用无血清培养基继续培养 96 h,药物组分别用含有 Ver 1.0、5.0、10.0、20.0、50.0 mg/L无血清培养基继续培养 96 h,每日观察心肌细胞形态和搏动情况,最后测定乳酸脱氢酶和 A540。
1.5.2 Ver对模拟缺血再灌注损伤时心肌细胞的保护作用 将培养 72 h心肌细胞 72瓶分 6组,每组 12瓶。正常对照组换用无血清培养基,再灌注组及含 Ver 0.5、1.0、2.0、4.0 mg/L组 (分别称为 Ver A组、B组、C组、D组)换用氮气预饱和无血清培养基后再以氮气充满培养瓶、旋紧瓶盖培养 1 h,换入氧气预饱和培养基正常培养4 h,留培养液测肌酸磷酸激酶活性;观察心肌细胞形态和搏动情况,最后行活细胞代谢试验测定比色值 A540。
1.6 统计学处理 采用 SPSS 15.0统计软件,建立数据库并对心肌细胞连续培养的毒性研究中维拉帕米各浓度组与正常对照组数据比较用配对 t检验;对模拟“缺血再灌注”中各药物浓度组和正常对照组、损伤对照组的数据比较用方差分析。对活细胞 MTT法比色值与损伤细胞释放的心肌酶活性作相关性分析;P<0.05表示差异有统计学意义。
2 结 果
2.1 Ver对心肌细胞的毒性
2.1.1 Ver对心肌细胞搏动及形态的影响 在噻唑兰代谢试验前观察细胞搏动,正常培养组的心肌细胞形成合胞体成片、快速(110~140次/分)、规律搏动,而未加药物的缺氧复氧对照组的心肌细胞搏动快慢不等且不规律,部分培养瓶内心肌细胞分割成多片搏动;维拉帕米组共 48瓶心肌细胞基本维持合胞体成片搏动,较高浓度组的搏动频率缓慢(40~ 80次 /分)。
观察心肌细胞形态时发现 Ver 20.0mg/L以下浓度组的形态与正常培养组相近,Ver 50.0组有成片脱落现象。连续培养到 96 h,正常培养组的 24孔心肌细胞多数停止搏动;但是,Ver 1.0组全部 24孔心肌细胞都维持缓慢、成片搏动,即便是 Ver 50.0组仍观察到多数培养孔内心肌细胞存有散在肌束搏动,噻唑兰代谢试验前,正常培养组全部恢复正常搏动。
2.1.2 Ver对心肌细胞的活性影响 维拉帕米对心肌细胞连续培养 96 h的毒性作用研究中,测得的乳酸脱氢酶活性与存活细胞代谢噻唑兰比色值及其比较如表 1所示。各培养孔乳酸脱氢酶活性与 A540呈直线相关,r=-0.989(P<0.01)。
表1 不同浓度的维拉帕米对心肌细胞的乳酸脱氢酶活性与 A540的影响(±s,n=24)
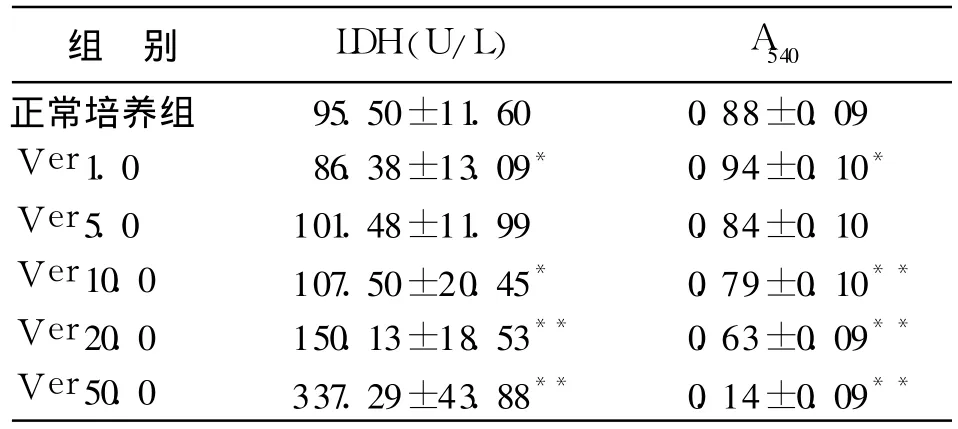
表1 不同浓度的维拉帕米对心肌细胞的乳酸脱氢酶活性与 A540的影响(±s,n=24)
注:与正常培养组比较,*P<0.05,**P<0.01
组 别 LDH(U/L) A540正常培养组 95.50±11.60 0.88±0.09 Ver 1.0 86.38±13.09* 0.94±0.10*Ver 5.0 101.48±11.99 0.84±0.10 Ver 10.0 107.50±20.45* 0.79±0.10**Ver 20.0 150.13±18.53** 0.63±0.09**Ver 50.0 337.29±43.88** 0.14±0.09**
2.2 Ver对缺血再灌注损伤时心肌细胞的保护作用 模拟缺血再灌注损伤各组,所测肌酸磷酸激酶活性与存活细胞代谢噻唑兰的比色值及其组间数据比较结果如表 2所示。各培养瓶肌酸磷酸激酶的活性与 A540呈直线相关,r=-0.986(P<0.01)。
表2 在心肌细胞模拟缺血再灌注损伤时维拉帕米对肌酸磷酸激酶活性与A540的影响(±s,n=12)
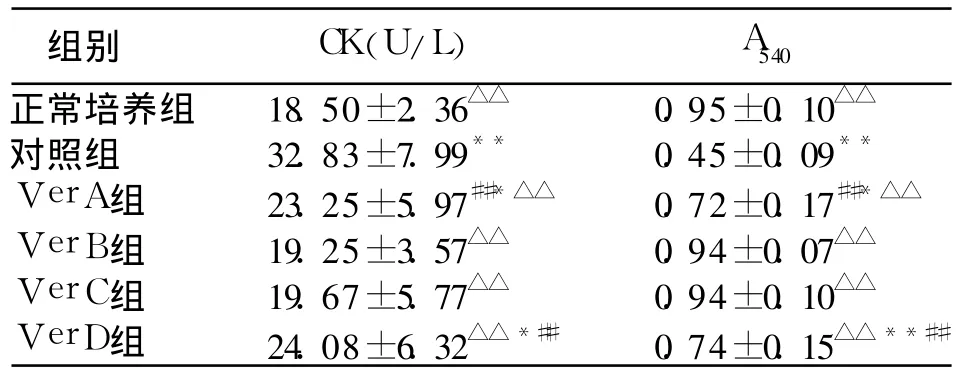
表2 在心肌细胞模拟缺血再灌注损伤时维拉帕米对肌酸磷酸激酶活性与A540的影响(±s,n=12)
注:与正常培养组比较,*P<0.05,**P<0.01;与Ver B组比较,##P<0.01;与缺血再灌注对照组比较,△△P<0.01
组别 CK(U/L) A540正常培养组 18.50±2.36△△ 0.95±0.10△△对照组 32.83±7.99** 0.45±0.09**Ver A组 23.25±5.97##*△△ 0.72±0.17##*△△Ver B组 19.25±3.57△△ 0.94±0.07△△Ver C组 19.67±5.77△△ 0.94±0.10△△Ver D组 24.08±6.32△△*## 0.74±0.15△△**##
3 讨 论
维拉帕米是钙通道阻滞剂,缺血再灌注损伤时存在钙负荷增加,含 Ver 150μg/kg的停搏液使心脏迅速停跳,钙蓄积降低,复跳后心功能接近正常[1]。用 0.3mg/L Ver预处理的狗心脏在缺血再灌注时线粒体谷胱苷肽及磷脂的改变明显减轻[5]。本实验研究发现 1.0、2.0mg/L Ver对心肌细胞没有明显毒性,对心肌细胞缺血再灌注损伤有明显保护作用。然而,Ver 5.0mg/L对连续培养的心肌细胞虽然未见有不良影响,但是 0.5mg/L Ver组心肌细胞在合并有缺氧再复氧时尽管相比损伤组显示保护作用,但相比无缺氧再复氧损伤因素的正常培养组却有明显受损。这提示较低浓度时的保护作用有限,较高浓度时同样达不到理想的结果,提示与其细胞毒性有关。
在连续培养时观察到 Ver 10.0 mg/L及更高浓度组心肌细胞明显受损。本实验仅观察 Ver在不同浓度时对心肌细胞的作用,其具体的作用机制尚不能确定。不过,有报道[2-4]Ver可抑制细胞 DNA、RNA和蛋白质的合成并直接杀伤细胞。然而,活体动物的毒性还与甲状腺功能有关,甲状腺功能减退鼠的半数致死量差不多只有正常者的一半。对氯化钙诱发的心律失常,以及有效的抗心律失常剂量都与甲状腺功能有关,甲状腺功能减退时两者的剂量都偏小[6];毒性还涉及糖代谢[7]。这些资料也提示其毒性作用途径较为复杂。
噻唑兰(MTT)为一淡黄色唑氮盐,被活细胞摄入经线粒体脱氢酶还原成紫色颗粒沉淀于细胞内或细胞周围,二甲基亚酚溶解这些紫色颗粒,因而染色的深浅可判断细胞存活、增殖及代谢情况[8]。紫色颗粒形成的量与细胞存活数有关,实验中酶学检测法研究结果与比色法结果相似,两者间有良好的负相关关系。此外,噻唑兰活细胞染色比色值还与细胞的代谢能力有关,保护心肌细胞时除了细胞存活以外,更重要的还要维持其正常功能。最近报道[9]心脏介入时,支架释放后即刻于靶血管内注入维拉帕米可显著改善冠状动脉灌注和心肌灌注水平。这说明维拉帕米对维持心肌细胞正常功能有着重要的价值。本实验结果中有关心肌细胞形态和细胞搏动情况,既涉及细胞存活数量更反应存活细胞的功能,虽然所观察到的结果有着较为重要临床意义,但是未作量化分析比较,这主要是考虑到主观指标的统计分析价值有限,因而仅作描述,这是本实验的不足之处。对涉及心肌细胞代谢和搏动功能,尚待完善观察指标作深入研究。
总之,无论是外科临床用作心脏停搏液的组成部分还是内科临床心脏介入时用作抗心律失常、改善心肌供血[1,9],参照本实验的结果,Ver所能达到的药物浓度均对心肌细胞没有直接的毒性。
[1]朱 平,程源恩,黄 立,等.异搏定加钾停搏液对心肌保护作用的实验研究[J].中华医学杂志,1988,68(6):316-318.
[2]邵宁生,金大年,张培炎,等.戊脉安对体外培养肿瘤细胞集落形成率及 DNA合成的影响[J].癌症,1989,8(1):39-41.
[3]刘乃丰,黄元伟,楼定安.维拉帕米抑制细胞 DNA、RNA和蛋白质合成的作用[J].浙江医科大学学报,1990,19(3):107.
[4]Perrotton T,Trompier D,Chang XB,et al.(R)-and(S)-verapamil differentially modulate the multidrug-resistant protein MRP1[J].JBiol Chem,2007,282(43):31542-31548.
[5]Kajiyama K,Pauly DF,HughesH,etal.Protection by verapam il ofmitochondrial glutathione equilibrium and phospholipid changes during reperfusion of ischemic canine myocardium[J].Circ Res,1987,61(2):301-310.
[6]Sokhanenkova AE,MIu S,EIu A,et al.Characteristics of pharmacologicaland toxic effects ofverapam ilduring cardiac arrhythmia in thyrotoxic and hypothyroid rats[J].Kardiologiia,2008,48(6):57-61.
[7]Bechtel LK,Haverstick DM,Holstege CP.Verapamil toxicity dysregulates the phosphatidylinositol 3-kinase pathway[J].Acad Emerg Med,2008,15(4):368-374.
[8]Ca rm ichael J,DeGraff WG,Gazdar AF,et al.Evaluation of tetrzolium based semiautomated colorimetric assay[J].Cancer Res,1987,47(4):936-942.
[9]乔志卿,卜 军,丁 嵩,等.冠状动脉内应用维拉帕米对急性心肌梗死急诊介入治疗后冠状动脉灌注、心肌灌注和临床预后的影响[J].中国介入心脏病学杂志,2009,17(4):185-190.

