3,4,5-三甲氧基苯胺的合成
3,4,5-三甲氧基苯胺是没食子酸的一种重要衍生物,是重要的药物合成中间体。以其为原料可以合成治疗由血小板致活因子(Prothrombin activation factor,PAF)引起的炎症、 哮喘、 溃疡等疾病的药物[1]。还可以合成黄酮类化合物如汉黄芩素、木蝴蝶素A和黄芩甙元等[2]。尤其在合成抗癌药物[3~8]方面有很好的应用前景。
作者参考相关文献[6],结合工业化生产的要求,以没食子酸为起始原料,经甲基化、硝基化以及还原等步骤合成了3,4,5-三甲氧基苯胺,合成路线如图1所示。

图1 3,4,5-三甲氧基苯胺的合成路线
还原硝基化合物的还原剂有很多,如铁粉或锌粉和其它盐类的混合还原剂[9]、二氯亚锡和浓盐酸的混合体系、硫粉和强碱体系[9,10]、水合肼和催化剂[11~16]体系等。作者在此以水合肼为还原剂、FeCl3·6H2O/C为催化剂,对3,4,5-三甲氧基硝基苯进行了还原,并探讨了此反应的影响因素。
1 实验
1.1 试剂与仪器
没食子酸、80%水合肼,天津科密欧化学试剂开发中心;硫酸二甲酯,上海科达化工有限公司;氢氧化钠,天津风船化学试剂科技有限公司;盐酸、乙醇、浓硝酸、冰醋酸、碳酸钠、六水合三氯化铁,国药集团化学试剂有限公司;以上试剂均为分析纯。
X-4型数字显示显微熔点仪(测定温度未校正),北京泰克;Nexus 470-FTIR型傅立叶红外光谱仪(KBr压片法);DF-101S型集热式磁力加热搅拌器,常州国立实验设备研究所;DZF-6020型真空干燥箱,上海精密实验设备有限公司;SHZ-Ⅲ型循环真空水泵,上海亚荣生化仪器厂;YP102N型电子天平(0.01 g),上海精密科学仪器有限公司。
1.2 方法
1.2.1 3,4,5-三甲氧基苯甲酸的合成
在氮气保护下,将20 g氢氧化钠、125 mL水、12.5 g没食子酸溶解到250 mL三口烧瓶中,冰水冷却搅拌10 min,25℃内滴入17 mL硫酸二甲酯,滴毕搅拌20 min,随后40℃内再次滴入17 mL硫酸二甲酯,滴毕保温搅拌10 min,升温至沸腾回流2 h,加入5 g氢氧化钠和7.5 mL水的混合溶液,继续沸腾回流2 h。自然冷却至室温,盐酸调pH值至1~2,析出固体,过滤,水洗,得白色固体。用水和乙醇(20∶1)重结晶,抽滤,干燥,得白色针状结晶,收率90.12%,m.p.170~171℃(文献值:170℃)。IR(KBr),cm-1:3019.32,2961.01,2836.83,2645.48,2582.13,2520.34,1685.23,1588.17,1506.23,1465.65,1417.03,1327.07。1HNMR(CDCl3,300 MHz),δ:3.771、3.835、3.852(3s,3×3H,3×CH3),7.252(2s,2×ArH)。
1.2.2 3,4,5-三甲氧基硝基苯的合成
将100 mL 65%硝酸和200 mL冰醋酸于冰水浴中搅拌均匀,分批加入50 g 3,4,5-三甲氧基苯甲酸,溶液由无色变为红棕色,并伴有气泡生成。在冰水浴中搅拌到无气泡生成,然后升温到室温,用TLC监控至原料点消失,此时溶液变为黄色。将溶液倒入1500 mL水中,搅拌,有大量淡黄色固体生成。抽滤,依次用水、饱和碳酸钠溶液、水洗涤,干燥。用无水乙醇重结晶,得针状晶体,于50℃真空干燥,得产物33.34 g,收率67%,m.p.99℃(文献值:95~97℃)。IR(KBr),cm-1:3114.42,2979.79,2848.43,2841.36,1620.03,1523.64,1470.58,1414.40,1338.94,1235.52,1219.23,1178.22,1127.30,1095.15,1028.90,990.94,919.47,853.74,796.97,771.72,744.23,686.22,535.29,491.25,457.17。1HNMR(CDCl3,400 MHz),δ:3.794、3.903(3s,3×3H,3CH3O-),7.560(2s,2×ArH)。
1.2.3 3,4,5-三甲氧基苯胺的合成
FeCl3·6H2O/C催化剂的合成:将20 mL无水乙醇和100 mL无水乙醚在常温下搅拌,混合均匀;快速加入3 g FeCl3·6H2O,搅拌溶解;然后加入20 g活性炭,在常温下搅拌2 h,蒸去溶剂,在100℃下烘干,即得到黑色粉末FeCl3·6H2O/C催化剂。
将3.17 g 3,4,5-三甲氧基硝基苯和50 mL无水乙醇及0.8 g FeCl3·6H2O/C加入100 mL三口瓶中搅拌,升温到80℃,滴加2.82 g 80%的水合肼,用TLC监控反应至原料点消失。抽滤,旋蒸部分溶剂。在冰水浴中冷却至0℃,析出大量黄色针状晶体,抽滤,用少量0℃的无水乙醇洗涤,得白色针状晶体,干燥,得产物2.99 g,收率94.5%,m.p.112℃(文献值:111~112℃)。IR(KBr),cm-1:3418.83,3327.35,3219.73,2945.29,2837.67,1588.55,1510.07,1470.83。1HNMR(CDCl3,300 MHz),δ:3.763(3s,3×3H,3×CH3),3.810(2s,2×H),5.940(2s,2×H)。
2 结果与讨论
2.1 水合肼用量对3,4,5-三甲氧基苯胺收率的影响(图2)
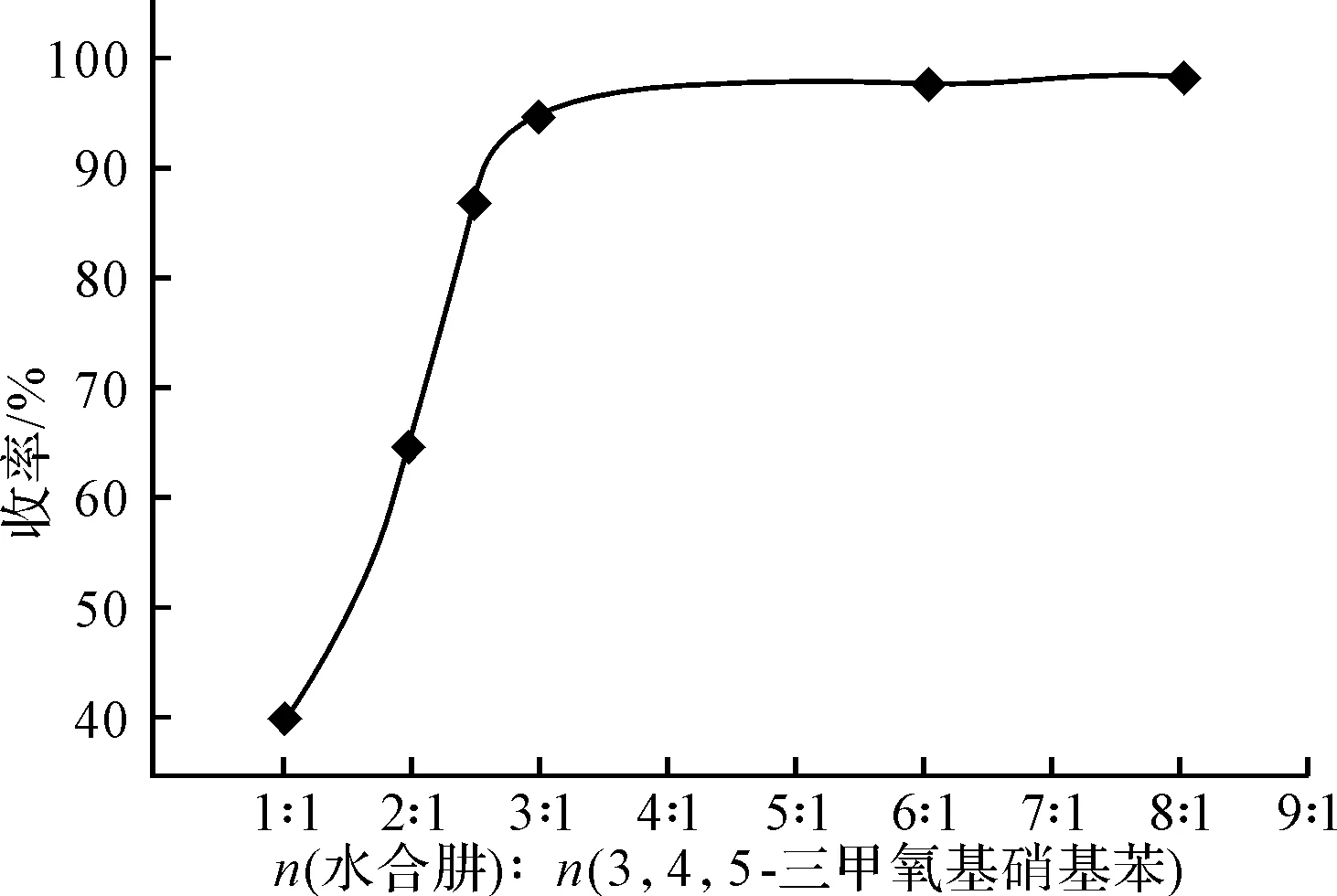
图2 原料配比对收率的影响
由图2可以看出,水合肼用量越大,3,4,5-三甲氧基苯胺收率越高;但n(水合肼)∶n(3,4,5-三甲氧基硝基苯)超过3∶1后,再增大水合肼用量,收率增幅不大。考虑成本因素,选择最佳配比n(水合肼) ∶n(3,4,5-三甲氧基硝基苯)为3∶1。
2.2 催化剂用量对反应时间和3,4,5-三甲氧基苯胺收率的影响(表1)

表1 催化剂用量对反应时间和收率的影响
由表1可以看出,当催化剂用量为0.80 g,即催化剂与原料质量比为0.25∶1时,反应时间最短,3,4,5-三甲氧基苯胺收率最高。选择最佳催化剂用量为0.80 g。
2.3 反应温度对反应时间和3,4,5-三甲氧基苯胺收率的影响(表2)

表2 反应温度对反应时间和收率的影响
由表2可以看出,反应温度太高,水合肼滴入后迅速分解,部分初生态氢来不及与硝基反应而结合为氢气逸出,水合肼不能被充分利用;反应温度太低,水合肼的分解速度慢,反应时间长。综合考虑,选择最佳反应温度为80℃。
2.4 反应时间对3,4,5-三甲氧基苯胺收率的影响(图3)
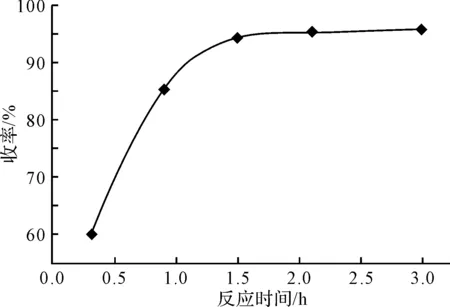
图3 反应时间对收率的影响
由图3 可以看出,随着反应时间的延长,3,4,5-三甲氧基苯胺的收率明显升高。当反应时间达到2.5 h后,再延长反应时间,收率上升不明显。因此,选择最佳反应时间为2.5 h。
3 结论
以没食子酸为起始原料,经甲基化、硝基化以及还原等步骤合成了3,4,5-三甲氧基苯胺,该合成路线成本低、操作简单、后处理方便、无污染、收率高。特别是3,4,5-三甲氧基硝基苯还原过程中,反应条件温和、耗时短、催化剂简单易得、无污染,所得产物品质很高,无需后处理就可以用于后续反应,容易实现工业化生产。
[1] 史鸿鑫,林辉,刘化章.3,4,5-三甲氧基溴苯的合成[J].精细化工,2001,18(8):453-455.
[2] Huang Wen-Hsin,Cheng Pei-Yu,Ching-Huey,et al.Novel synthesis of flavonoids of Scutellaria baicalensis Georgi[J].Chem Pharm Bull,2003,51(3):339-340.
[3] Choi Ha-Soon,Wang Zhicheng,Richmond Wendy,et al.Design and synthesis of 7H-pyrrolo[2,3-d]pyrimidines as focal adhesion kinase inhibitors.Part 1 [J].Bioorganic & Medicinal Chemistry Letters,2006,16(8):2173-2176.
[4] Choi Ha-Soon,Wang Zhicheng,Richmond Wendy,et al.Design and synthesis of 7H-pyrrolo[2,3-d]pyrimidines as focal adhesion kinase inhibitors.Part 2[J].Bioorganic & Medicinal Chemistry Letters,2006,16(10):2689-2692.
[5] Oscar Moradei,Silvana Leit,Zhou Nancy,et al.SubstitutedN-(2-aminophenyl)-benzamides,(E)-N-(2-aminophenyl)-acrylamides and their analogues:Novel classes of histone deacetylase inhibitors[J].Bioorganic & Medicinal Chemistry Letters,2006,16(15):4048-4052.
[6] Jin Yi,Zhou Zu-Yu,Tian Wei,et al.4′-Alkoxyl substitution enhancing the anti-mitotic effect of 5-(3′,4′,5′-substituted)anilino-4-hydroxy-8-nitroquinazolines as a novel class of anti-microtubule agents[J].Bioorganic & Medicinal Chemistry Letters,2006,16(22):5864-5869.
[7] Hu Lai,Li Zhuo-rong,Li Jian-nong,et al.3-(2′-Bromopropionylamino)-benzamides as novel S-phase arrest agents [J].Bioorganic & Medicinal Chemistry Letters,2007,17(24):6847-6852.
[8] Barbosa Euzébio G,Bega Luis A S,Beatriz Adilson,et al.A diaryl sulfide,sulfoxide,and sulfone bearing structural similarities to combretastatin A-4[J].European Journal of Medicinal Chemistry,2009,44(6):2685-2688.
[9] 徐克勋.精细有机化工原料及中间体手册[M].北京:化学工业出版社,1997:491.
[10] 章思规.精细有机化学品技术手册[M].北京:化学工业出版社,1993:743.
[11] 陈永杰,陈广新,尹红梅,等.邻乙基苯肼的合成[J].精细化工,1996,13(3):245-248.
[12] 孙汉洲,赵芳,邓集平,等.2,2-二(4-羟基-3-氨基)苯基丙烷的合成[J].合成化学,2004,12(5):508-510.
[13] 吕荣文,张竹霞,高昆玉.芳硝基物的水合肼催化还原研究进展[J].染料与染色,2003,40(3):160-162.
[14] Toshiyuki Miyata,Yoshio Ishino,Tsuneaki Hirashima.Catalytic reduction of aromatic nitro compounds with hydrazine hydrate in the presence of iron(Ⅲ)oxide hydroxide[J].Synthesis,1978,(11):834-835.
[15] Kumbhar Pramod S,Sanchez-Valente Jaime,Figueras Francois.Reduction of aromatie nitro compounds with hydrazine hydrate in the presence of the iron(Ⅲ) oxide-MgO catalyst prepared from a Mg-Fe hydrotalcite precursor [J].Tetrahedron Letter,1998,39(17):2573-2574.
[16] Larsen John W,Freund Michael,Kim Kwang Y,et al.Mechanism of the carbon catalyzed reduction of nitrobenzene by hydrazine[J].Carbon,2000,38(5):655-661.

