N,N-二羧甲基壳聚糖的制备及其盐的抑菌作用研究
甲壳素广泛存在于海洋生物蟹、虾的壳中和真菌的细胞壁中,其脱乙酰化产物壳聚糖是一种氨基多糖,具有良好的生物相容性和可降解性。壳聚糖分子结构中有大量氨基(或酰胺基)和羟基,能够选择性地螯合一些金属离子,但是壳聚糖不溶于水,限制了它的应用。为了改变其溶解性能,扩大应用范围,许多学者致力于其化学结构修饰研究[1~3],得到不同取代度、不同取代位置的羧甲基壳聚糖,羧甲基壳聚糖对Cu2+、Zn2+、Ag+等金属离子有较强的络合能力[4~6]。作者以单氯乙酸为改性剂对壳聚糖进行化学修饰,制备了N,N-二羧甲基壳聚糖 (N,N-Dicarboxymethylchitosan,DCMC)[7]及其锌盐(DCMC-Zn)、银盐(DCMC-Ag)、铜盐(DCMC-Cu),并考察了其对大肠杆菌和金黄色葡萄球菌的抑菌作用。
1 实验
1.1 原料、试剂和仪器
壳聚糖(脱乙酰度≥94%,80目),济南海得贝海洋生物工程有限公司;氯乙酸、碳酸钠、无水乙醇、氯化钠、硝酸银、硝酸锌、硫酸铜,均为分析纯。
肉汤培养基:NaCl 0.025 g,蛋白胨0.50 g,牛肉膏0.15 g,蒸馏水50 mL。
大肠埃希氏菌、金黄色葡葡球菌均为青岛科技大学药学研究室提供。
DF-101S型集热式恒温磁力搅拌器,河南予华仪器有限责任公司;PHS-25型数显酸度计,上海雷磁;FTIR8400型红外光谱仪,日本岛津;紫外可见分光光度计,北京普析通用仪器有限责任公司;SW-CJ-1F型单人双面净化工作台,苏州净化设备有限公司;RXZ智能型人工气候箱,宁波江南仪器厂。
1.2 方法
1.2.1N,N-二羧甲基壳聚糖的合成
取1 g壳聚糖溶胀于100 mL水中,膨化24 h,慢慢加入4 g单氯乙酸,剧烈搅拌至壳聚糖全部溶解,混合均匀;在剧烈搅拌下逐滴加入10%的Na2CO3溶液,调节pH值至8.0,得到均匀溶液;在90℃下反应3 h,冷却后过滤,滤出不溶物。滤液用1% HCl调pH值,析出沉淀,静置,去除上清液,沉淀先用90%乙醇水溶液洗涤,再用无水乙醇多次洗涤,60℃下干燥,粉碎,得到淡黄色粉末,即N,N-二羧甲基壳聚糖。
1.2.2N,N-二羧甲基壳聚糖锌、银、铜盐的制备
1.2.2.1N,N-二羧甲基壳聚糖锌盐的制备
在N,N-二羧甲基壳聚糖(0.40 g)的水溶液中加入0.06 g Zn(NO3)2,在pH值6.5、60℃条件下络合反应30 min,得到白色粉末络合物,产物不溶于水和乙醇,也不溶于碱性溶液,可溶于稀酸。
1.2.2.2N,N-二羧甲基壳聚糖银盐的制备
磁力搅拌下,在N,N-二羧甲基壳聚糖(0.40 g)水溶液中加入0.50 g AgNO3反应1 h,反应液用丙酮结晶抽滤后,先以无水乙醇反复洗涤,直至无Ag+检出,再用甲醇多次洗涤,于60℃真空干燥,得到褐色络合物。
1.2.2.3N,N-二羧甲基壳聚糖铜盐的制备[5]
称取0.40 gN,N-二羧甲基壳聚糖溶于50 mL水中,搅拌均匀,另加入0.40 g CuSO4·5H2O于5 mL蒸馏水中溶解完全,搅拌下将硫酸铜溶液逐滴加入到均一的羧甲基壳聚糖溶液中,在30℃、pH值6.5下反应2 h,得到蓝色络合物。
1.2.3 羧甲基壳聚糖及其锌、银、铜盐的抑菌作用考察
将壳聚糖、苯甲酸钠、N,N-二羧甲基壳聚糖及其锌、银、铜盐加入到已配制好的肉汤培养基中,使加入物的浓度分别为100×10-6、200×10-6、400×10-6、600×10-6、800×10-6,然后按照麦氏比浊管使用说明加入3 mL细菌近似浓度为300×106个·mL-1的菌悬液培养,24 h后在600 nm下测定吸光度以判断微生物的生长状况,以苯甲酸钠作为对照,评价N,N-二羧甲基壳聚糖及其锌、银、铜盐的抑菌作用。
1.2.4N,N-二羧甲基壳聚糖等电点的测定[8]
取9份1.2.1取代反应后的滤液20 mL,用10%HCl溶液分别调节其pH值至4.0、3.5、3.0、2.7、2.5、2.3、2.0、1.7、1.5,在231 nm处测定各溶液的透光率(T)。由于越接近等电点,N,N-二羧甲基壳聚糖的溶解性越差,导致其水溶液的透光率越小。因此,根据透光率-pH值曲线,确定产品的等电点。
1.2.5N,N-二羧甲基壳聚糖取代度的测定
精确称取0.25 g干燥至恒重的N,N-二羧甲基壳聚糖于100 mL烧杯中,用25 mL 0.1 mol·L-1盐酸标准溶液将其完全溶解后,用0.1 mol·L-1氢氧化钠标准溶液滴定。同时用酸度计检测溶液pH值的变化。利用二阶导数法确定拐点处的碱用量。N,N-二羧甲基壳聚糖取代度(DS)依下式[9]计算:
DS=0.161A/(1-0.058A)
A=(V2-V1)c/m
式中:A为每克样品中羧甲基的物质的量,mmol;V1为滴定过量盐酸的终点体积,mL;V2为滴定至RNH+(CH2COO-)2所消耗的氢氧化钠标准溶液的体积,mL;m为样品净重,g;c为氢氧化钠标准溶液浓度,mol·L-1。
2 结果与讨论
2.1 红外光谱分析(图1、图2)

图1 壳聚糖(a)和N,N-二羧甲基壳聚糖(b)的红外光谱图
由图1可知,壳聚糖红外图谱中3437 cm-1处是N-H、O-H键的伸缩振动吸收峰;2915 cm-1处为CH2上C-H伸缩振动吸收峰,另外2915 cm-1处的峰变宽可能是由于O-H和N-H基团形成了氢键,两振动峰重叠所造成;1597 cm-1附近只有一个明显的强吸收峰,归属于氨基的伸缩振动[10],此处N-H的弯曲振动峰证明了—NH2的存在;与脱乙酰度低的壳聚糖比较,1654 cm-1附近的二级酰胺中C=O伸缩振动吸收峰减少,说明此全脱化壳聚糖的脱乙酰度高。
和壳聚糖相比,N,N-二羧甲基壳聚糖在1597 cm-1附近N-H弯曲振动吸收峰减少,另外在3402 cm-1处存在较平的宽峰,尖峰的减少也说明N-H吸收峰减少,说明此处发生了N取代反应;1735 cm-1处为-COOH中C=O的特征吸收峰;1637 cm-1处为-COONa中C=O特征吸收峰、羧酸基团的C=O伸缩振动的特征吸收峰;1399 cm-1处为羧酸根上C-O伸缩振动吸收峰;1240 cm-1处为N,N-二羧甲基壳聚糖中C-O-C的伸缩振动吸收峰(壳聚糖环中O);1068 cm-1处为C6位上羟基吸收峰和C-O伸缩振动吸收峰。
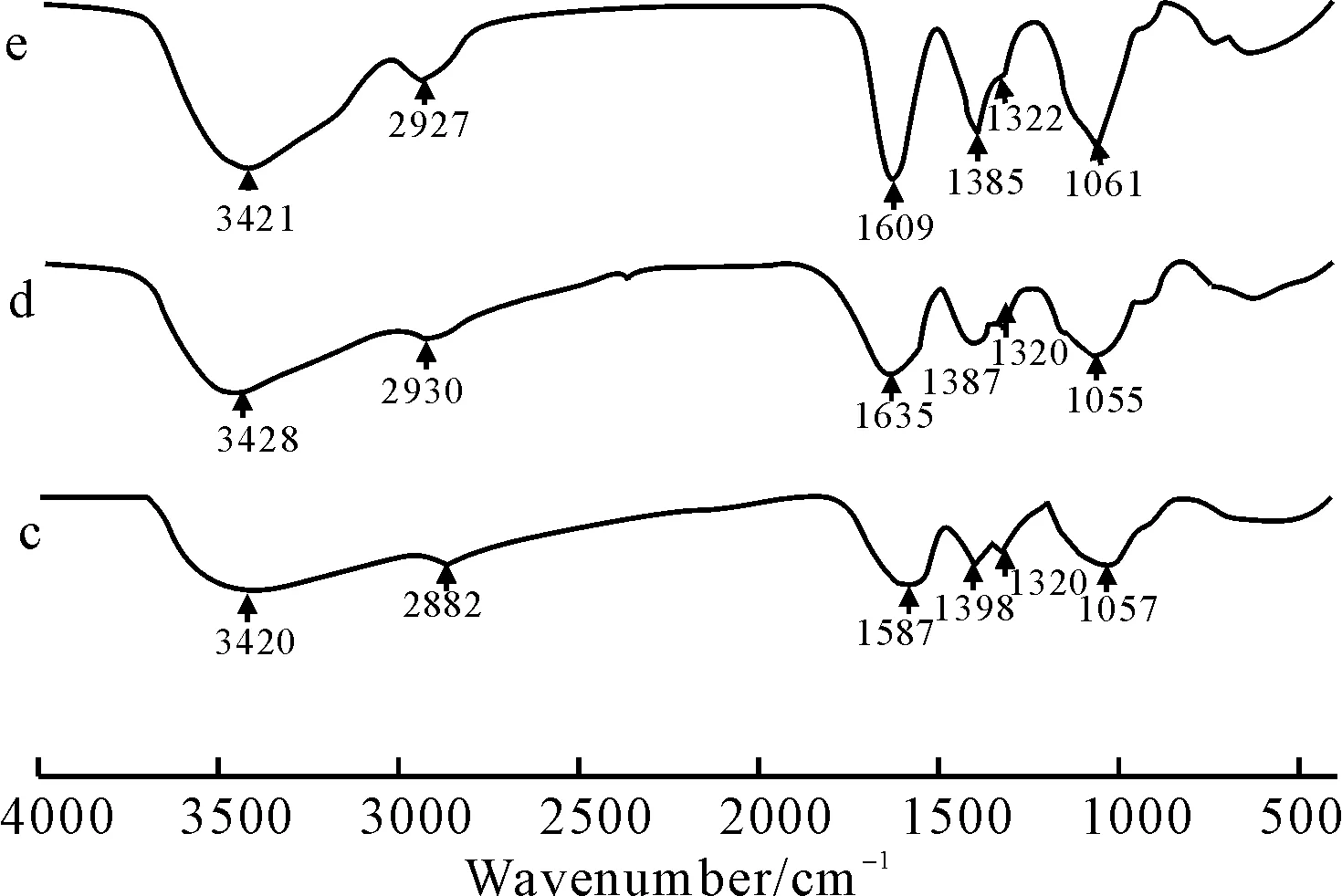
图2 N,N-二羧甲基壳聚糖银盐(c)、铜盐(d)、锌盐(e)的红外光谱图
由图2可知,络合反应前后,N,N-二羧甲基壳聚糖与DCMC-Zn、DCMC-Ag、DCMC-Cu的红外谱图最大的区别是N,N-二羧甲基壳聚糖1735 cm-1处吸收峰的消失,1637 cm-1处吸收峰DCMC-Zn、DCMC-Ag、DCMC-Cu分别移到了1609 cm-1、1587 cm-1、1635 cm-1,其余峰型无明显变化,这说明N,N-二羧甲基壳聚糖与Ag+、Cu2+、Zn2+的络合反应主要发生在COO-上。
2.2 N,N-二羧甲基壳聚糖的等电点
在231 nm波长下测定不同pH值下N,N-二羧甲基壳聚糖溶液的透光率,透光率随pH值变化的曲线见图3。
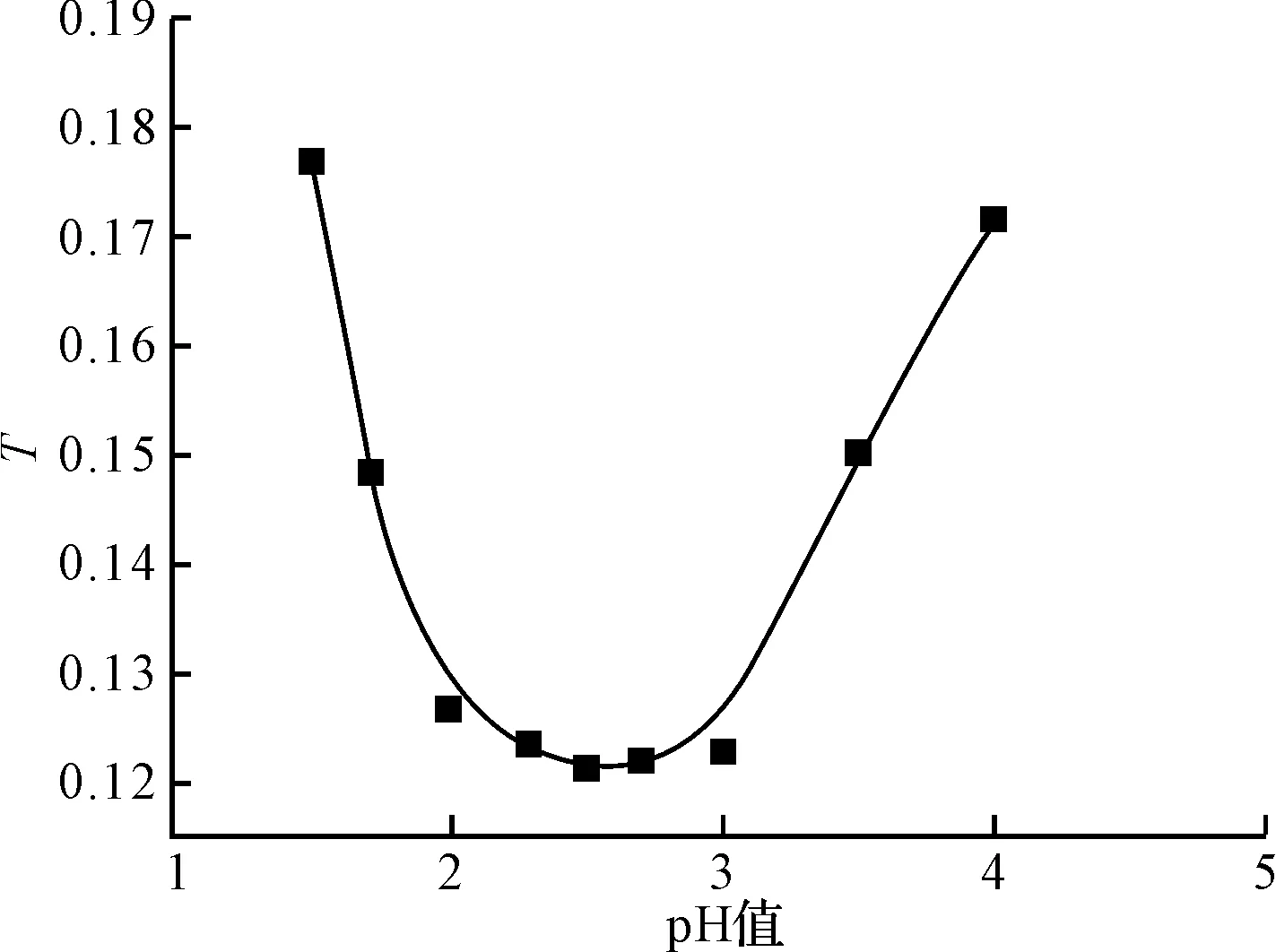
图3 不同pH值N,N-二羧甲基壳聚糖溶液的透光率曲线图
透光率最低时所对应的pH值即为等电点。由图3可知,N,N-二羧甲基壳聚糖的等电点为2.5。
2.3 N,N-二羧甲基壳聚糖的取代度
羧甲基壳聚糖的取代度一般以平均每个氨基葡萄糖(Glucosamine,GU)或N-乙酰氨基葡萄糖(N-Acetylglucosamine,AGU)单元上被羧甲基化的基团数目来表示。通常情况下,羧甲基壳聚糖的取代度均小于2。取代度的大小直接决定了羧甲基壳聚糖的溶解性,取代度大于0.6的CM-CTS易溶于水[3],随着取代度的提高,其溶解性相应加强,溶液的透明度也愈好。
图4为N,N-二羧甲基壳聚糖的电位滴定曲线图,其中pH=1.6所对应的横坐标V1为过量HCl的滴定终点,pH=2.5为N,N-二羧甲基壳聚糖的等电点,这与用分光光度法所确定的等电点一致。pH=4.7所对应的横坐标V2为RNH+(CH2COO-)2的滴定终点。其中V1=9.0 mL、V2=27.0 mL,按照1.2.5方法测得N,N-二羧甲基壳聚糖的取代度为1.99。

图4 N,N-二羧甲基壳聚糖的滴定曲线
2.4 N,N-二羧甲基壳聚糖及其盐的抑菌作用
测定了壳聚糖、N,N-二羧甲基壳聚糖及其锌、银、铜盐对大肠杆菌和金黄色葡萄球菌的抑菌作用,以苯甲酸钠作对照,结果见图5、图6。

图5 壳聚糖、苯甲酸钠、N,N-二羧甲基壳聚糖及其锌、银、铜盐对大肠杆菌的抑菌作用
由图5可知,壳聚糖、苯甲酸钠、DCMC-Cu、DCMC-Ag、DCMC-Zn、DCMC对大肠杆菌的抑制作用随着浓度的增大而增强,其抑菌作用强弱依次为:DCMC-Ag>苯甲酸钠>壳聚糖>DCMC-Zn>DCMC>DCMC-Cu;DCMC-Ag在浓度为100×10-6时的抑菌作用已经明显强于其它三者,这可能与Ag+本身有较强抑菌作用有关;壳聚糖对大肠杆菌的抑菌作用又强于N,N-二羧甲基壳聚糖及其锌、铜盐的抑菌作用,这与壳聚糖本身含有氨基、对大肠杆菌具有较强的抑菌作用有关;DCMC-Cu随着浓度增大吸光度增加,表示其抑菌作用减弱,这可能与Cu2+浓度增大时颜色加深而影响吸光度的测定有关。

图6 壳聚糖、苯甲酸钠、N,N-二羧甲基壳聚糖及其锌、银、铜盐对金黄色葡萄球菌的抑菌作用
由图6可知,DCMC-Ag、DCMC-Cu、DCMC-Zn、DCMC、壳聚糖及苯甲酸钠对金黄色葡萄球菌的抑制作用随着浓度的增大而增强,其抑菌作用强弱依次为:DCMC-Ag>DCMC-Cu>苯甲酸钠>壳聚糖>DCMC>DCMC-Zn;DCMC-Ag对金黄色葡萄球菌抑制作用最强,其次是DCMC-Cu,DCMC-Zn最弱。DCMC-Ag在100×10-6时已表现出很强的抑菌效果,DCMC-Cu抑菌效果仅次于DCMC-Ag,但明显强于DCMC-Zn及DCMC。浓度为200×10-6时DCMC-Zn的抑菌作用强于DCMC,当浓度超过300×10-6左右后DCMC-Zn的抑菌效果最弱。
3 结论
与壳聚糖相比,N,N-二羧甲基壳聚糖的水溶性增强,等电点为2.5,取代度为1.99,对Zn2+、Ag+、Cu2+都有很好的络合作用。高取代度的DCMC对金黄色葡萄球菌、大肠杆菌的抑菌作用不如壳聚糖;DCMC-Ag对金黄色葡萄球菌、大肠杆菌均有抑菌作用,且抑菌作用最强;DCMC-Cu对革兰氏阴性菌大肠杆菌的抑制效果不明显,但对革兰氏阳性菌金黄色葡萄球菌却有着明显的抑制作用;DCMC-Zn对革兰氏阴性菌大肠杆菌有抑制作用,而对革兰氏阳性菌金黄色葡萄球菌的抑制效果不明显。
参考文献:
[1] 吴刚,沈玉华,谢安建,等.N,O-羧甲基壳聚糖的合成和性质研究[J].化学物理学报,2003,16(6):499-503.
[2] 王爱勤,闫志宏,贾宝全,等.羧甲基壳聚糖的制备与质量分析[J].中国生化药物杂志,1996,17(4):147-149.
[3] 赵爱杰,原续波,常津,等.O-羧甲基壳聚糖的制备及应用研究进展[J].高分子通报,2004,(4):59-63.
[4] An N T,Thien D T,Dong N T,et al.Water-solubleN-carboxymethylchitosan derivatives: Preparation,characteristics and its application[J].Carbohydrate Polymers,2009,75(3):489-497.
[5] 林友文,陈伟,罗红斌,等.羧甲基壳聚糖对锌离子的吸附作用研究[J].海峡药学,2000,12(3):69-72.
[6] 湛学军,熊远珍,柳喆,等.羧甲基壳聚糖银的合成及抑菌实验的研究[J].中国生化药物杂志,2001,22(3):142-144.
[7] An N T,Dung P L,Thien D T, et al.An improved method for synthesizingN,N′-dicarboxymethylchitosan[J].Carbohydrate Polymers,2008,73(2):261-264.
[8] 蒋珍菊,王周玉,冯冬.水溶性N-(2-羧基苯甲酰基)化壳聚糖等电点的测定[J].应用化工,2005,34(4):245-247.
[9] 韩笑,谭天伟.羧甲基壳聚糖制备新工艺研究[J].北京化工大学学报,2000,27(3):1-4.
[10] Mima S,Miya M,Iwamoto R,et al.Highly deacetylated chitosan and its properties[J].Journal of Applied Polymer Science,1983,28(6):1909-1917.

