肥胖与非肥胖糖尿病患者特点分析
费朝霞 张作仕 王风 郭文丽
肥胖是糖尿病的主要危险因素之一。据美国国家糖尿病协会报道,轻、中、重度肥胖发展为2型糖尿病的危险性分别是正常体重的2.5与10倍。1998年法国的一项报告,2型糖尿病中肥胖者占60%,在美国亦有超过90%新诊断的糖尿病属于肥胖患者[1]。肥胖也增加1型糖尿病的发病危险[2,3]。英国 Peninsula 医学院 Kibirige 等[4]对 90 多名 1 ~16岁儿童进行了观察,结果发现,年龄、体重与1型糖尿病诊断显著相关,曹冰燕等[5]对北京市19593名6~18岁学龄儿童糖尿病患病现状调查,发现肥胖儿童发病率明显增高。1型糖尿病患儿往往超重。比较肥胖和非肥胖1型的特点,可为临床运动干预及药物治疗提供依据.
1 资料和方法
1.1 临床资料 从2003~2009年内分泌科住院的糖尿病患者中选取测定了谷氨脱羧酶抗体(glutamate decarboxylase antibody,GAD-Ab)者,共956例,其中经典1型糖尿病患者62例,男39例,女23例,年龄9~52岁,平均(30.1±12.3)岁;成人隐匿性自身免疫性糖尿病(latent autoimmune diabetes in adults,LADA)患者96例,男50例,女46例,年龄20~65岁,平均(50.2±13.4)岁;2型糖尿病患者798例,男400例,女398例,年龄25~90岁,平均(58.6 ±15.7)岁。糖尿病诊断参照1999年世界卫生组织标准。均排除继发性糖尿病及妊娠糖尿病。
1.2 方法 测量身高、体重,体重指数(BMI)=体重/身高2。肥胖:BMI>25 kg/m2,测量空腹血糖、餐后2 h血糖、糖化血红蛋白(HbA1c)、血脂、空腹C肽及胰岛素、餐后2 h C肽及胰岛素、GAD-Ab。观察胰岛功能、糖、脂代谢代谢水平、临床合并症及并发症发生情况。
1.3 统计学方法 数据采用SPSS 10.0软件进行统计学分析。正态分布的定量资料两组之间均数比较采用独立样本t检验,多个样本均数的比较采用方差分析,方差齐的样本两两比较用SNK检验,方差不齐的样本两两比较用Dunnett检验。非正态分布的定量资料两组之间均数比较采用秩和检验(Mann-Whitney U),多个样本比较用Kruskal-Wallis H法。定性资料用阳性例数、构成比或率表示,分类变量组间比较用χ2检验,Fishers精确概率法。检验显著性均以0.05为标准。
2 结果
2.1 经典I型糖尿病、LADA及2型糖尿病患者3组间肥胖构成比比较 3组的构成比分别为15/62(24.2%),32/96(33.3%),313/798(39.2%),差异无显著性意义(P>0.05)。见表1。
2.2 肥胖与非肥胖经典1型糖尿病患者临床特点比较 前者合并代谢综合征比例高,差异有显著性意义(P<0.05),见表2。
2.3 肥胖与非肥胖LADA患者临床特征比较 见表1,表2。前者合并代谢综合征和冠心病、高脂血症比例较高(P<0.05),空腹及餐后2 h C肽水平较高(P<0.05),依赖胰岛素治疗比例及合并糖尿病周围神经病变者较低(P<0.05)。

表1 肥胖与非肥胖糖尿病患者代谢状况比较
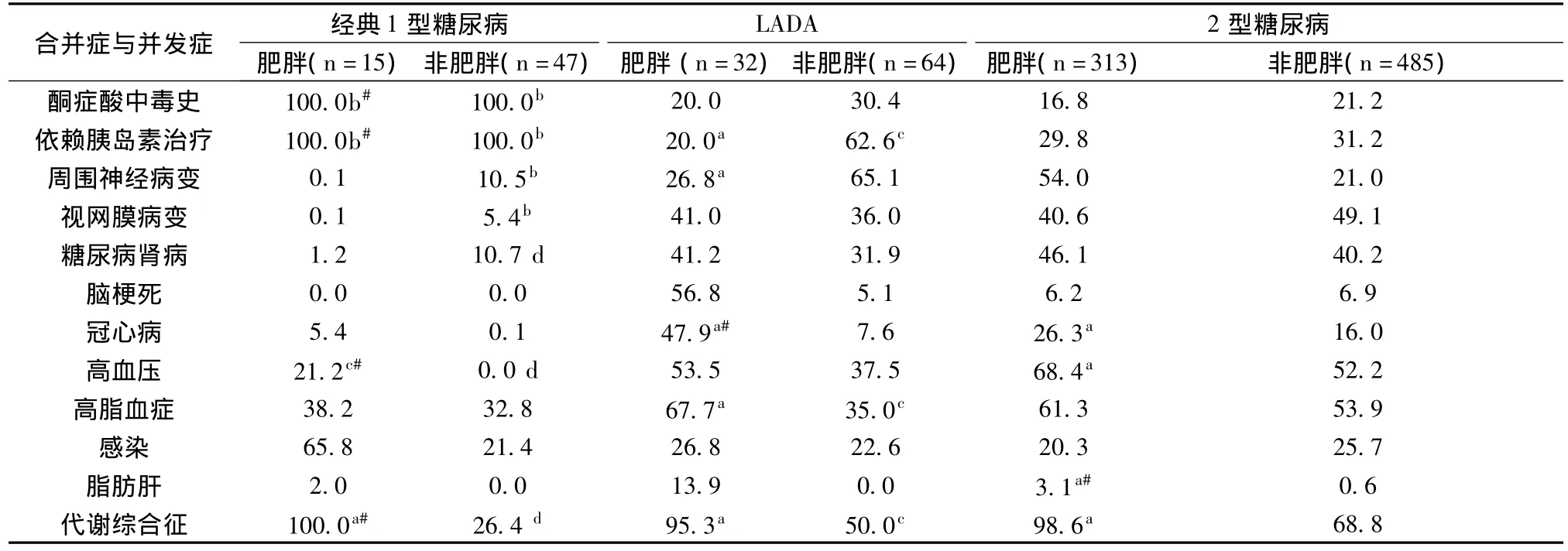
表2 肥胖与非肥胖糖尿病患者合并症与并发症发生率比较(%)
2.4 肥胖经典1型糖尿病与LADA患者比较 前者发病年龄较小、初诊糖尿病时空腹血糖水平较高、发生酮症酸中毒及依赖胰岛素治疗比例较高(P<0.05)。
2.5 非肥胖经典1型糖尿病与 LADA患者并发症与合并症情况比较见表2。前者发病年龄较小、病程较短、初诊糖尿病时空腹血糖水平较高、发生酮症酸中毒及依赖胰岛素治疗比例较高,合并糖尿病周围神经病变、视网膜病变均较少(P<0.05)。
3 讨论
本研究显示无论1型还是2型糖尿病,肥胖组发生代谢综合征及冠心病的比例明显高于非肥胖组。他们的发生有着共同的“土壤”即胰岛素抵抗。故对肥胖1型糖尿病患者治疗除早期应用胰岛素积极控制血糖,还需强调减轻胰岛素抵抗[6],包括控制饮食、增加运动、减肥及合理应用改善胰岛素抵抗的药物,如二甲双胍、噻唑脘二酮、ɑ-糖苷酶抑制剂等[7]。
分析本组资料发现,无论是否肥胖,经典1型糖尿病与2型糖尿病之间均存在较明显差异,且符合目前研究已证实的各自临床特征。但LADA作为1型糖尿病的一个亚型,其发病是在遗传易患性基础上由于环境因素诱发的胰岛素B细胞自身免疫性损害。大多数表现为消瘦体形,易发生口服降糖药失效,而依赖于胰岛素降糖,伴有胰岛 B细胞自身抗体(GAD-Ab,ICA,IAA或 -IA2Ab等)阳性。其表型较复杂,肥胖LADA类似2型糖尿病,非肥胖LADA接近经典1型糖尿病。与德国的Lohmann等[7]报道一致。2001年,Lohmann发现GAD-Ab滴度较高或ICA与GAD-A皆阳性的LADA患者临床特征更类似于1型糖尿病患者,即胰岛功能差、低体重、易发生酮症等,称其为LADA-1型,而 GAD-A滴度较低或ICA单一阳性的LADA患者临床特征更类似于2型糖尿病患者,即胰岛素B细胞分泌功能相对较好、体重指数相对较高、不易发生酮症等,称其为LADA-2型。故对肥胖LADA患者的干预治疗应同时增加运动、减肥及合理应用改善胰岛素抵抗的药物,类同于2型糖尿病患者。
本研究显示,尽管肥胖组C肽水平高,但肥胖与非肥胖组LADA在糖代谢控制方面无差异,考虑与血脂有关。脂肪细胞分泌多种脂肪细胞因子,对全身各器官系统具有重要调节功能,且与胰岛素抵抗密切相关。如肿瘤坏死因子ɑ阻碍胰岛素受体及底物IRS-1/IRS-2酪氨酸磷酸化,从而影响胰岛素的信号传导[9]。有人发现瘦素通过直接激活ATP敏感的钾通道,使胰岛B细胞超级化从而抑制胰岛素的分泌;此外瘦素还可通过抑制迷走神经或刺激交感神经来减少胰岛素的分泌。在病理状态下瘦素受体敏感性下降,使正常脂肪-胰岛素轴的反馈机制破坏,引起B细胞去极化,促进胰岛素的分泌导致高胰岛素血症和胰岛素抵抗[10],这也是肥胖的糖尿病患者发生胰岛素抵抗的机制之一。胶原样蛋白-脂联素亦是肥胖和胰岛素抵抗联系的中介,脂联素可抑制肿瘤坏死因子ɑ,促进脂肪酸的燃烧及耗能,改善胰岛素抵抗。肥胖时脂联素减少,肿瘤坏死因子ɑ升高,胰岛素生物活性下降,胰岛素生物活性下降,胰岛素抵抗加重[11]。上述机制可以部分解释为什么肥胖糖尿病患者的C肽水平明显高于非肥胖者,但血糖水平却与后者无显著性差异;因为肥胖患者较严重的胰岛素抵抗使其糖代谢控制较差。
总之肥胖的LADA患者临床表型更类似于2型糖尿病,发生代谢综合征及冠心病的比例高于非肥胖组,对前者的干预治疗应类同于后者。有利于延缓慢性并发症的发生。
[1]Dabelea D,Pettitl DJ,Jones KL,et al.Type 2 diabetes mellitus in minority children and adolescents.An emerging problem.Endocrinol Metab Clin North Am,1999,28(4):709-729.
[2]周郦楠,王实,宋光熠,等.下丘脑、瘦素及肥胖.中国临床康复,2003,7(15):2206-2207.
[3]高政南,王颖,孙葳,等.大连地区常住居民2497例肥胖与糖尿病分层、多级整群抽样调查.中国临床康复,2003,7(18):2550-2551.
[4]Kibirige M,Metcalf B.Testing the accelerator hypothesis:The relationship between body mass and age at diagnosis of type 1 diabetes.Diabetes Care,2003,26:2865-2870.
[5]曹冰燕,米杰,巩纯秀,等.北京市19593名儿童青少年糖尿病患病现状调查.中华流行病学杂志,2007,28(7):16.
[6]Franz MJ,Bantle JP,Beebe CA,et al.Evidence-based nutrition principles and related complications.Diabete Care,2002,25:148-198.
[7]周智广,杨琳.LADA的诊断要点与治疗方式.中华内分泌代谢杂志,2006,22(1)22.
[8]Lohmann T,Seisser J,Verlohren HJ,et al.Distinet genetic and Immunologic features in patients with onset of IDDM before and after age 40 .Diabetes Care,1997,20:524.
[9]Fernandez-Real JM,Ricart W.Insulin resistance and inflammation in a evolutionary perspective:the contribution of cytokine genotype/phenotype to thriftness.Diabetologia,1999,42(11):1367-1374.
[10]顾卫琼,陈明道,唐金凤,等.中国人血清瘦素水平与肥胖度的关系.中华内分泌代谢杂志1999,15(1):15.
[11]刘岩,邹大进.脂联素在动脉硬化中的保护作用.中国临床康复,2003,7(21):2969-2970.

